Společné stanovisko odborných společností k farmakologické léčbě obezity
Martin Fried1, Dana Müllerová2, Martin Haluzík3, Petr Sucharda4, Jan Boženský5, Vojtěch Hainer Orcid.org 6, Marie Kunešová Orcid.org 6, Iva Málková Orcid.org 7, Šárka Slabá8, Radka Taxová-Braunerová6, Petra Šrámková1, Pavol Holeczy5
+ Pracoviště
Souhrn
Společné stanovisko:
- České obezitologické společnosti ČLS JEP, Společné sekce bariatricko-metabolické chirurgie
- České asociace preventivní kardiologie
- České společnosti pro aterosklerózu
- České diabetologické společnosti
Toto společné stanovisko odborných lékařských společností se vydává vzhledem ke společenské závažnosti problematiky obezity jako chronického onemocnění, které je patofyziologickým nastavením organizmu, na jehož podkladě se zvyšuje riziko rozvoje kardiovaskulárních, metabolických, plicních, nádorových onemocnění a onemocnění pohybového ústrojí, přičemž jeho prevence a správná léčba snižuje jak rozvoj, tak progresi těchto onemocnění. Cílem stanoviska je zvýšit povědomí o obezitě jako o onemocnění, které vyvolává řadu závažných komplikací. Její prevenci a léčbě by proto měla být věnována stejná pozornost jako jiným závažným civilizačním onemocněním.
Úvod
Obezita je celkové onemocnění organizmu, které neléčené významně zvyšuje riziko vzniku a rozvoje diabetes mellitus 2. typu (DM2T), kardiovaskulárních a nádorových onemocnění, vede k ventilační nedostatečnosti a k dalším multiorgánovým a multisystémovým postižením, včetně přetížení pohybového ústrojí, které zhoršují kvalitu života, snižují práceschopnost, zvyšují nemocnost a úmrtnost. Obezita se stala pandemií a podle Světové zdravotnické organizace (WHO) je jednou z největších výzev v oblasti veřejného zdraví 21. století.
V ČR podle dostupných údajů za posledních 40 let dramaticky narostl podíl obyvatel s obezitou. Podle údajů NCDRisC (Non-Communicable Diseases Risk Factor Collaboration, světové sítě, která shromažďuje data ze zdravotnictví, www.ncdrisc.org/index.html) se zvýšilo zastoupení mužů s obezitou prvního stupně více než 2×, s obezitou druhého stupně téměř 5× a s obezitou třetího stupně téměř 14×. U žen byl nárůst menší. Nadváhou či obezitou trpělo v roce 2016 podle analýzy projektu Česko v datech 71 % mužů a téměř 56 % žen, což v té době představovalo dosud nejvyšší číslo v historii. Podobné údaje pro ČR, 72 % mužů a 60 % žen s nadváhou a obezitou, tentokrát z roku 2008, vykazuje databáze WHO, kdy obezita byla shledána u 33 % mužů i žen. O něco příznivější zastoupení nadváhy a obezity – 65 % mužů a 46 % žen vykazuje šetření VZP s agenturou STEM MARK z roku 2013, kdy samotnou obezitou trpí 23 % mužů a 19 % žen. Modely WHO predikují pro ČR nárůst prevalence obezity v roce 2030 na 36 % dospělé populace.
V ČR se podle České lékařské společnosti JEP odhadují přímé i nepřímé zdravotní náklady související s obezitou až na 10 % celkových výdajů na zdravotnictví, což ročně představuje 30 miliard korun – ovšem dosud chybí podrobná farmakoekonomická analýza. Geograficky nejbližší je studie z Německa provedená u osob starších 57 let, která prokázala přibližně 1,7× vyšší přímé celkové náklady na zdravotní péči s obezitou druhého a vyššího stupně (BMI ≥ 35 kg/m2) v porovnání s osobami s normální hmotností [1]. Systematické přehledové studie se shodují, že obezita spotřebovává obrovské množství zdrojů na zdravotní péči [2,3].
Zdravotní rizika obezity
Podle Zpráv o zdraví obyvatel České republiky jsou chronická neinfekční onemocnění hlavní příčinou úmrtnosti a invalidity. ČR patří k evropským zemím s nejvyšší incidencí zhoubných novotvarů, s téměř dvojnásobnou úmrtností na kardiovaskulární onemocnění proti evropským zemím s nejnižší úmrtností. Obezita se svými komplikacemi patří mezi základní determinanty chronických neinfekčních onemocnění, které lze modifikovat. Podle mezinárodních studií se odhaduje atributivní riziko obezity v rozmezí 5–15 % celkové mortality, pro nádorová onemocnění do 8 %, kardiovaskulární onemocnění 7–44 % a DM2T v rozmezí 3–83 % [4].
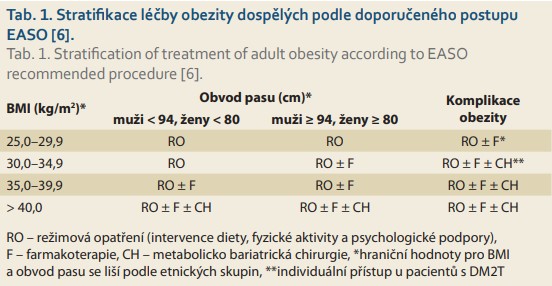
Podle návrhu Evropské společnosti pro studium obezity (European Association for Study of Obesity – EASO) je za nejvyšší zdravotní riziko spojené s obezitou považována přítomnost minimálně jednoho z následujících onemocnění: DM2T, metabolický syndrom, kardiovaskulární/renální orgánové poškození, muskuloskeletální poškození [5]. Vysoké riziko komplikací obezity ale představuje i syndrom spánkové apnoe s ventilační insuficiencí.
Za středně závažné riziko zdravotního stavu spojené s obezitou považuje EASO pozitivní rodinnou anamnézu u příbuzného prvního stupně DM2T, hypertenze, infarktu myokardu či cévní mozkové příhody; u osoby mladší 30 let pak BMI ≥ 35 kg/m2, u starších BMI ≥ 40 kg/m2; viscerální obezitu, porušenou glukózovou toleranci, hypertenzi, dyslipidemii, současné kuřáctví a fyzickou neaktivitu. Mezi středně závažné riziko je možno započítat i současně přítomnou depresi [5].
U obézních, kteří výše uvedená zdravotní rizika nemají, se pak celkové zdravotní riziko považuje za nízké.
Pro praxi má navržená klasifikace závažný dopad na míru intenzity léčby obezity. Čím závažnější stupeň zdravotního rizika, tím důraznější terapeutické intervence je třeba vynaložit, a to nejen na hmotnostní redukci, ale zejména na léčbu komplikací obezity, jejíž iniciální strategii lze navrhnout podle Doporučení pro léčbu obezity navržených výborem EASO pro léčbu obezity (tab. 1) [6].
Obezita je velmi obtížně léčitelné onemocnění; především je obtížné udržet dlouhodobý pokles tělesné hmotnosti. Při snaze o redukci hmotnosti se spouští kompenzační mechanizmy, které snižují metabolizmus a zvyšují produkci hormonů, které zvyšují chuť k jídlu [7,8]. Na druhou stranu již pokles hmotnosti o 5–10 % vede ke snížení nemocnosti nejen na kardiovaskulární onemocnění, hypertenzi a DM2T, ale snižuje též i další zdravotní rizika obezity. U pacientů s DM2T snižuje pokles hmotnosti o 5–10 % koncentraci HbA1c až o 10 mmol/mol, stejně tak systolický a diastolický krevní tlak, což může vést ke snížení potřeby farmakoterapie [9]. Snížení hmotnosti o 15 a více kilogramů bylo v DiRECT studii obézních, s délkou trvání diagnózy DM2T až do 6 let, spojeno s remisí DM2T v 86 %, a to při vysazení antihypertenziv a antidiabetik [10].
Léčba obezity
Léčení obezity vyžaduje multidisciplinární přístup; zároveň je nezbytná pacientova aktivní účast [6,11]. Základem léčby jsou vždy režimová opatření, zejména úprava stravy a dostatečná fyzická aktivita. Pokud nejsou provázena personálně velmi náročnou psychoterapeutickou a motivační podporou, z hlediska dlouhodobého efektu často selhávají. Dlouhodobě je úspěšnější kombinace s podáváním antiobezitik a zvláště s bariatrickou chirurgií. V léčení obezity je tak možno využít kombinace pěti přístupů:
- úprava stravy;
- fyzická aktivita;
- psychoterapie;
- farmakoterapie;
- metabolicko-bariatrická léčba.
Při léčbě komplikací obezity je imperativem, pokud to lze, výběr léků, které hmotnost dále nezvyšují. To se týká diabetu, kardiovaskulárních, psychických, gynekologických, revmatologických, pneumologických, autoimunních a dalších onemocnění.
První tři léčebné postupy, jakkoliv vypadají jednoduše, jsou málo úspěšné. Pacient musí mít motivaci, podporu psychologa, nutričního terapeuta a osobního trenéra pro pohybovou aktivitu zaměřeného na klienty s obezitou. Chování populace je obtížně ovlivnitelné pouze zdravotními argumenty, pokud nejsou podpořeny dalšími faktory, např. ekonomickou motivací či tlakem médií a sociálních sítí.
Pro příští desetiletí se jako perspektivní jeví spolu s chirurgickou léčbou dlouhodobé podávání antiobezitik, tedy léků, které podporují a příznivě ovlivňují pokles nadměrné hmotnosti. Takové léky jsou v současné době k dispozici, ale nejsou ani částečně hrazeny ze všeobecného zdravotního pojištění. Náklady na léčbu jsou však pro velkou část obézních dlouhodobě neúnosné.
Faktická nedostupnost účinných antiobezitik pro indikované pacienty má závažné zdravotně-ekonomické dopady. Nevyužívání účinných možností léčby potvrzených postupy medicíny založené na důkazech má za následek vysokou prevalenci s obezitou spojených nemocí, jejichž léčení je ekonomicky ještě nákladnější a v případě DM2T dokonce méně efektivní.
Jsme přesvědčeni, že úhrada antiobezitik z prostředků všeobecného zdravotního pojištění, alespoň částečná a za vymezených podmínek, je nezbytným krokem ke zlepšení situace a ve svých důsledcích bude jednoznačně ekonomicky efektivní.
I když pro angažování lékařů v léčbě obezity bylo vynaloženo značné úsilí, od zařazení této problematiky do programů pregraduálního vzdělávání vše - obecného lékařství přes vydání doporučených postupů pro praktické lékaře, doporučených postupů pro léčbu metabolickou chirurgií, pro léčbu dětské obezity, pořádání pravidelných postgraduálních školení v obezitologii po zařazení praktických stáží z obezitologie do přípravy ve specializačním vzdělávání z endokrinologie a diabetologie, přesto se většina oborů převážně z důvodů časové tísně problematikou obezity nezabývá.
Obezita se dnes převážně léčí v obezitologických ambulancích a obezitologických centrech. Podle typu vybavení pracoviště, personálního zabezpečení a možností poskytovat vyšší či nejvyšší míru specializované léčebné péče obézním lze pracoviště rozdělit na pracoviště prvního a druhého typu podle standardů akreditace vypracovaných Českou obezitologickou společností ČLS JEP (ČOS). Lékaři, kteří léčbu pacientům poskytují, se většinou rekrutují z lékařů se specializací interní, endokrinologickou, diabetologickou, pediatrickou či chirurgickou. Většinou mají, nikoliv ale povinně, kurz v obezitologii pořádaný pod záštitou ČOS. V současné době není zavedena postgraduální specializace v obezitologii. Podle zákona č. 48/1997 Sb. nejsou ani dostatečně specifikovány výkony potřebné v obezitologii, které by byly v potřebném rozsahu hrazenými službami z veřejného zdravotního pojištění. Na léčbě pacientů s obezitou se podílejí i další odborní zdravotničtí pracovníci specializovaní v oblastech výživy, fyzioterapie a psychoterapie.
Psychologická terapie spočívá v psychologické diagnostice, poradenství a terapii pacienta s obezitou. V diagnostice jde o zjištění psychogenní složky podílející se na nesprávném „proobezigenním“ chování, detekci jejích hereditárních či naučených komponent. V poradenství jde o ovlivnění motivačního chování, naučení se sebeúctě a správnému uspokojování emočních potřeb, postupnému trénování a posilování volního úsilí a naučení se behaviorálním scénářům ve vypjatých psychosociálních situacích.
Dietoterapie v léčbě obezity a přidružených onemocnění zahrnuje dva základní aspekty – energetickou restrikci vedoucí k negativní energetické bilanci a nutriční biologickou kvalitu stravy. Energetickou restrikci s cílem negativní energetické bilance lze dosáhnout pomocí velmi přísné nízkoenergetické diety o energetickém obsahu 1,5–3 MJ/den nebo nízkoenergetické diety s kalorickým obsahem mezi 5 a 7 MJ/den.
Stravou o energetickém obsahu 1,5–3 MJ nelze uhradit denní nároky na požadované mikro- a makronutrienty dospělých, proto byly vyvinuty tzv. VLED, dříve označované jako „VLCD“ diety (Very Low Energy Diets, Very Low Calorie Diets), které představují nutričně definované náhrady jídla v podobě „potravin pro zvláštní výživu“ určených podle současné legislativy „k náhradě celodenní stravy pro regulaci hmotnosti“ nebo „potravin pro zvláštní lékařské potřeby“ tak, aby byly zabezpečeny alespoň minimální denní dávky nutrientů nutné k pokrytí fyziologických potřeb organizmu. Není doporučeno je podávat déle než 3 měsíce, přičemž jejich aplikaci by měl řídit a kontrolovat lékař.
V některých případech, zpravidla při doporučení celkové energie v rozsahu 3–5 MJ/den, se přistupuje ke kombinaci jídla a nutričně definované náhrady jídla. Bylo prokázáno, že náhrada jednoho či dvou denních jídel porcí VLED zlepšuje účinnost kognitivně behaviorální intervence životního stylu (v jedné porci bývá obvykle kolem třetiny denních doporučených dávek esenciálních nutričních faktorů) [12].
Nízkoenergetické diety o obsahu 5–7 MJ/den lze už zajistit vhodně navolenou stravou tak, aby byly pokryty nezbytné fyziologické potřeby základních nutrientů. Pro zajištění nutriční kvality stravy je ale zapotřebí navýšení nutričních znalostí a informovanosti pacienta o obsahu živin, minerálních látek, vitaminů, vlákniny a vody v potravinách a znalost dalších informací o výživě, včetně podpory zajištění dosažitelnosti zdravější volby.
Terapie pohybem a pravidelná fyzická aktivita je integrální součástí léčby obezity, bez ohledu na redukci hmotnosti, protože navýšení kardiorespirační zdatnosti snižuje riziko rozvoje a progresi kardiovaskulárních onemocnění, DM2T a celkovou mortalitu.
Při preskripci objemu a intenzity fyzické aktivity je třeba vycházet z aktuálního zdravotního stavu pacienta, jeho pohybových a kardiorespiračních možností. Na základě zjištěné úrovně kardiorespirační zdatnosti lze individuálně optimalizovat intenzitu a objem pohybové aktivity s ohledem na její očekávaný efekt. U obézních je doporučovaná frekvence cvičení alespoň 5× v týdnu v trvání 30 až 60 minut. Alternativou mohou být i intervalová cvičení trvající minimálně 10 minut několikrát denně, s vyšší intenzitou zátěže. Vždy je nutné začínat z úrovně výchozího stavu, tj. v případě delší neaktivity postupným prodlužováním trvání od 10 minut a přidáváním intenzity z lehké na střední a vyšší. Zároveň je třeba volit takové typy pohybové aktivity, které vedou k navýšení či udržení kardiorespirační zdatnosti a přitom rizikově nezatěžují již tak nadměrnou hmotností přetížený podpůrně-pohybový systém pacientů s obezitou (chůze, plavání, cyklistika a další). Důležitou formou cvičení pro pacienty s obezitou je i dechová rehabilitace a posilování posturálního svalstva.
Farmakologická léčba
U obézních pacientů je třeba zaléčit velmi často se vyskytující komplikace v podobě arteriální hypertenze, dyslipidemie, DM2T, prokoagulačního stavu, které vedou k rozvoji kardiovaskulárních onemocnění a dalších orgánových poškození. Časté jsou i depresivní stavy a syndrom spánkové apnoe, které rovněž prognózu pacienta zhoršují a vyžadují léčebnou intervenci.
Vlastní farmakologická léčba obezity – antiobezitika – může být předepsána u pacientů s hodnotou BMI > 30 kg/m2 nebo > 27 kg/m2 s přidruženými závažnějšími komplikacemi.
Rozhodnutí zahájit farmakologickou léčbu má být individualizováno a realizováno pouze po důkladném vyhodnocení rizik a přínosů všech možností léčby. Taktéž se doporučuje ukončit léčbu a/nebo použít jinou medikaci, pokud po 12 týdnech terapie na cílových dávkách nedojde k úbytku tělesné hmotnosti > 5 %.
Z hlediska farmakoterapie byly v léčbě obezity zatím úspěšné léky s následujícími mechanizmy účinku:
- léky centrálně tlumící chuť k jídlu;
- léky omezující vstřebávání tuku v trávicím traktu;
- léky působící podobným mechanizmem jako hormony trávicího traktu – inkretiny.
Antiobezitika mají za cíl především:
- předcházet morbiditě a mortalitě pacientů s obezitou a snižovat rizika rozvoje komplikací obezity;
- zvyšovat hmotnostní redukci dosaženou úpravou životního stylu;
- zlepšovat již přítomné metabolické poruchy;
- redukovat tělesný tuk zejména v oblasti viscerálního uložení;
- zlepšovat kvalitu života a adherenci k zdraví protektivním režimovým opatřením [13].
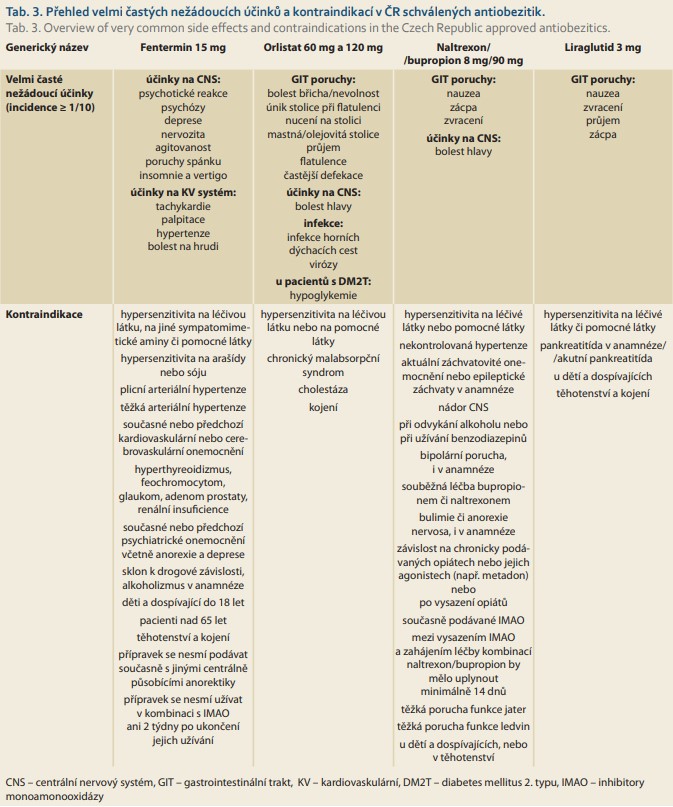
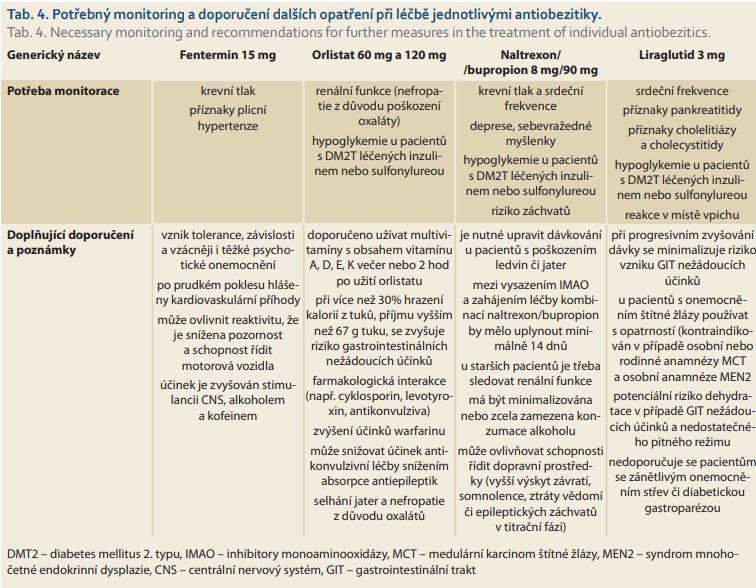
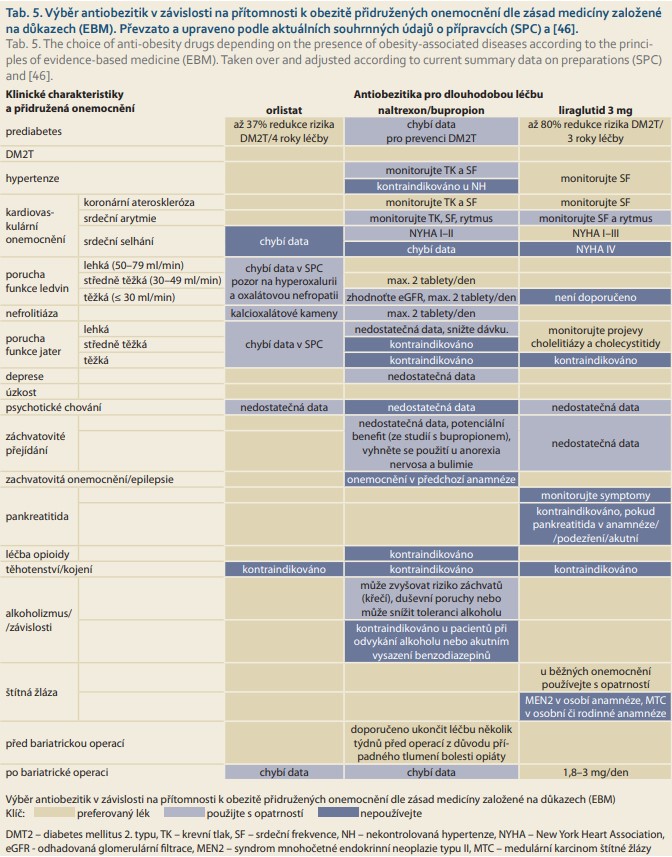
Následuje popis léků v pořadí, jak byly uváděny na český trh. Před předepsáním některého z uvedených antiobezitik je vždy třeba se seznámit s platnou souhrnnou informací o léčivém přípravku (SPC) zveřejněnou na stránkách Státního ústavu pro kontrolu léčiv (www.sukl.cz). Základní informace o dostupných antiobeziticích v ČR jsou v přehledu uvedeny v tab. 2–5.
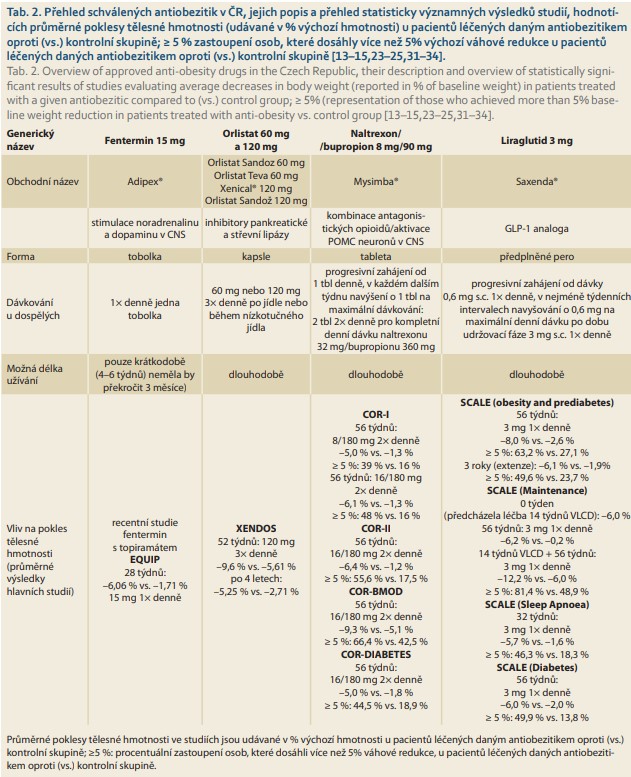
Fentermin
Mechanizmus účinku
Fentermin je léčebnou látkou ze skupiny fenylethylaminů. Stimuluje uvolňování noradrenalinu a dopaminu v centrálním nervovém systému (CNS). V ČR je tato látka na rozdíl od většiny evropských zemí stále registrována jako léčivý přípravek k léčbě obezity. Jedná se o anorektikum, kde je dlouhodobější léčba spojena s rizikem farmakologické tolerance, závislosti a abstinenčními příznaky. Jeho předpis je proto vázán na opiátový recept nebo žádanku s modrým pruhem.
Vliv na redukci tělesné hmotnosti
Vzhledem tomu, že přípravek byl schválen FDA již v roce 1959, nejsou k dispozici recentní prospektivní klinické studie účinnosti a bezpečnosti. Také došlo ke snížení dávkování na 15 mg/den. Částečnou představu o účinnosti a efektech na kardiometabolické parametry mohou poskytnout pouze studie, kde byl fentermin zkoumán v kombinaci s topiramátem, u nás ale není tato kombinace zatím k dispozici.
Dávkování, kontraindikace a nežádoucí účinky
Od roku 2019 došlo k úpravám jeho doporučeného dávkování na maximálně jednu tabletu denně. Tobolky se užívají při snídani, nerozkousané, zapíjí se dostatečným množstvím tekutiny. Přípravek se nepodává večer, protože léčivá látka může způsobit nervozitu a nespavost. Léčba obvykle trvá 4 až 6 týdnů a neměla by překročit 3 měsíce. Pokud je plánována další léčba, je možné ji zopakovat až po přestávce, která je stejně dlouhá, jako byla předcházející terapie s délkou užívání do 3 měsíců. Fentermin je indikován pro pacienty s BMI > 30 kg/m2. Přípravek se nesmí podávat současně s jinými centrálně působícími anorektiky, užívat v kombinaci s inhibitory monoaminooxidázy (IMAO) ani 2 týdny po ukončení jejich užívání. Kontraindikován je také při kardiovaskulárních či cerebrovaskulárních onemocněních, plicní hypertenzi, těžké arteriální hypertenzi, psychiatrických onemocněních, poruchách příjmu potravy, sklonech k drogovým závislostem, abúzu alkoholu, při renálním selhávání, hypertyreioidizmu, feochromocytomu, u starších 65 let, mladších 18 let, těhotných a kojících. Z nežádoucích účinků jsou nejčastěji popisovány účinky na CNS (psychotické reakce, psychózy, deprese, nervozita, agitovanost, poruchy spánku, insomnie a vertigo) a kardiovaskulární systém ve formě tachykardie, palpitace, hypertenze a bolesti na hrudi.
Orlistat
Mechanizmus účinku
Orlistat je reverzní inhibitor lipáz trávicího traktu, kdy redukuje absorpci tuku z potravy o 30 %. Absorpce orlistatu ve střevě je nižší než 1 % a jeho účinnost byla prokázána v různých randomizovaných studiích [14–16].
Vliv na redukci tělesné hmotnosti
V metaanalýze dvanácti studií s orlistatem a dietními opatřeními se prokázal po roce průměrný 8% pokles výchozí tělesné hmotnosti, který byl udržitelný v následujících 3 letech léčby [15]. Ve studii XENDOS zahrnující 3 304 pacientů bez DM2T byl po roce pozorován 10,6kg úbytek výchozí tělesné hmotnosti (vs. 6,2 kg ve skupině s placebem), kdy po 4 letech léčby byl udržován úbytek hmotnosti 5,8 kg ve srovnání s výchozí hodnotou (vs. 3,0 kg ve skupině s placebem) [16].
Efekty na další kardiometabolické parametry
Léčba orlistatem je rovněž spojována se signifikantním úbytkem v obvodu pasu, hodnot krevního tlaku, celkového cholesterolu, LDL cholesterolu a postprandiální koncentrace triglyceridů [14,17–19]. Po 4 letech léčby orlistatem se snížila incidence DM2T oproti skupině s placebem (celková incidence 2,9 vs. 4,2 %) – relativní riziko rozvoje DM2T se snížilo o 37,3 % [16]. Ve studiích s pacienty s DM2T podporuje léčba orlistatem větší pokles tělesné hmotnosti a snížení hladiny HbA1c po 12 měsících ve srovnání s placebem [17,18]. Nebylo však prokázáno vyšší snížení HbA1c, než odpovídá snížení hmotnosti. U pacientů se selháním ledvin a/nebo jater nebyla účinnost orlistatu studována.
Dávkování, kontraindikace a nežádoucí účinky
Orlistat je dostupný v balení 120 mg na lékařský předpis pod obchodním názvem Xenical, Orlistat Sandoz 120 mg a jako volně prodejný lék v síle 60 mg pod obchodním názvem Orlistat Sandoz 60 mg či Orlistat Teva 60 mg. Doporučené dávkování u síly 120 mg je 3× denně bezprostředně před jídlem, během jídla nebo až 1 hodinu po každém hlavním jídle za dodržování nízkokalorické diety. Pokud se vynechá jedno jídlo, popř. jídlo neobsahuje tuk, není třeba orlistat užít.
Hlavní nežádoucí účinky jsou pozorovány na gastrointestinální úrovni: olejovitý anální výtok (4–27 %), bolest břicha (< 26 %), nadýmání a fekální výtok (2–24 %), imperativní střevní naléhavost (3–22 %) (tab. 2) [20,21]. Orlistat má poměrně málo kontraindikací, může ovlivnit absorpci jiných léků (amiodaron, antikonvulziva, antiretrovirové léky, propafenon, cyklosporin a levothyroxin) a vitaminů rozpustných v tucích (betakaroten a vitaminy A, D, E, K) [20]. Z toho důvodu se doporučuje oddělit podání těchto léků po dobu 3–4 hodin po užití orlistatu [20]. Orlistat také může ovlivnit antikoagulační účinek antagonistů vitaminu K. Při dlouhodobé léčbě se doporučuje užívání vitaminů rozpustných v tucích.
Kombinace naltrexon/bupropion s postupným uvolňováním
Mechanizmus účinku
Bupropion je selektivní inhibitor zpětného vychytávání dopaminu a noradrenalinu a americký Úřad pro kontrolu potravin a léčiv (FDA – Food and Drug Administration) jej schválil již v roce 1985 jako antidepresivum a lék pro odvykání závislosti na tabáku [22]. Naltrexon je antagonista opioidních receptorů schválený FDA pro léčbu závislostí na alkoholu a dalších opiátech [23]. Mechanizmus, kterým kombinace naltrexon/bupropion s postupným uvolňováním způsobuje pokles tělesné hmotnosti, pravděpodobně odvisí od schopnosti bupropionu stimulovat neurony POMC/CART (proopiomelanokortinem regulovaná transkripce kokainu a amfetaminu) a naltrexonu, antagonisty opioidního receptoru, jehož fyziologická aktivace při aktivaci POMC/CART vede k řízenému vyhasnutí aktivace POMC/CART [7]. Blokování této inhibiční zpětnovazebné smyčky naltrexonem tak vede k silnější a déletrvající aktivaci neuronů POMC.
Vliv na redukci tělesné hmotnosti
Vliv na redukci tělesné hmotnost byl studován v rámci klinického programu COR (Contrave Obesity Research). V rámci tohoto klinického programu byly realizovány čtyři randomizované klinické studie. Ve všech studiích byla zkoumána účinnost a bezpečnost kombinace naltrexon/bupropion v celkové denní dávce 32 mg naltrexon /360 mg bupropion.
Studie COR-I [1] zkoumala vliv kombinace naltrexonem v dávce 16 nebo 32 mg/den s bupropionem v dávce 360 mg/den na tělesnou hmotnost pacientů s nadváhou či obezitou a dyslipidemií nebo hypertenzí v randomizované, dvojitě zaslepené studii [24]. Úbytek tělesné hmotnosti byl u léčených kombinací naltrexon/bupropion s postupným uvolňováním statisticky významný oproti skupině s placebem a činil 6,1 % výchozí hmotnosti ve skupině s naltrexonem v dávce 32 mg, 5,0 % ve skupině s naltrexonem v dávce 16 mg a 1,3 % ve skupině s placebem. Ve dvojitě zaslepené studii COR-II trvající 56 týdnů s 1 496 randomizovanými pacienty s nadváhou nebo obezitou, dyslipidemií a/nebo hypertenzí užívali účastníci placebo nebo kombinaci s postupným uvolňováním naltrexonu v dávce 32 mg/den a bupropionu v dávce 360 mg/den. Bylo zjištěno signifikantní snížení výchozí tělesné hmotnosti (–6,4 vs. –1,2 %; p < 0,001), dále došlo ke zlepšení markerů kardiometabolického rizika, kvality života a kontroly chuti k jídlu [24].
Studie COR-Diabetes hodnotila účinnost léčby naltrexonem v dávce 32 mg a bupropionem v dávce 360 mg během 56 týdnů u pacientů s DM2T a nadváhou nebo obezitou s užíváním perorálních antidiabetik, nebo bez nich, kdy do studie nebyli zařazeni pacienti léčení inzulinem a/nebo analogy receptoru GLP-1 [25]. Léčba kombinací naltrexon/bupropion vyvolala u pacientů s DM2T a nadváhou/obezitou vyšší úbytek tělesné hmotnosti (pokles o 5,0 vs. 1,8 %; p < 0,001), s větším podílem pacientů (44,5 %), kteří dosáhli vyššího poklesu než 5 % výchozí hmotnosti ve srovnání s placebem. Léčba kombinací naltrexon/bupropion s postupným uvolňováním rovněž souvisela s průměrným snížení HbA1c (–0,6 vs. –0,1 %) a větší podíl pacientů dosáhl hladiny HbA1c < 7,0 %. Léčba kombinací naltrexon/bupropion zlepšovala některé z faktorů kardiovaskulárního rizika [25]. V poslední studii COR-BMOD byli všichni pacienti zařazeni do programu strukturovaných změn životního stylu a randomizováni k léčbě naltrexonem v dávce 32 mg a bupropionem v dávce 360 mg s postupným uvolňováním (n = 591), nebo k podávání placeba (n = 202) [26]. V rámci této studie byl po 56 týdnech zaznamenán větší pokles tělesné hmotnosti u intervenované skupiny ve srovnání s kontrolní s placebem (–9,3 vs. –5,1 %; p < 0,001), kdy 80,4 % pacientů snížilo svou výchozí hmotnost o > 5 % [26].
Efekty na další kardiometabolické parametry
V rámci uvedených klinických hodnocení bylo u pacientů léčených kombinací naltrexon/bupropion pozorováno zlepšení u obvodu pasu (včetně pacientů s DM2T), triglyceridemie, HDL cholesterolemie a poměru LDL-C/HDL-C v porovnání s placebem. U pacientů s DM2T došlo ke zlepšení parametrů kontroly glykemie (pokles HbA1c, inzulinu nalačno a HOMA-IR) v porovnání s placebem. V klinických studiích fáze III s kombinací naltrexon/bupropion byly pozorovány nárůsty systolického krevního tlaku o 1,1–2,6 mm Hg a mírný nárůst tepové frekvence [22,24].
Kardiovaskulární bezpečnost kombinace naltrexon/bupropion měla prokázat randomizovaná, multicentrická, dvojitě zaslepená, placebem kontrolovaná studie LIGHT [27]. Do studie bylo zařazeno 8 910 pacientů s obezitou ve vysokém kardiovaskulárním riziku. Pacienti měli být sledování po dobu až 4 let. Bohužel na základě požadavku hlavních řešitelů této studie bylo klinické hodnocení předčasně ukončeno. Byl porušen protokol studie, neboť byly společností Orexigen zveřejněny průběžné důvěrné výsledky. Kardiovaskulární bezpečnost kombinace naltrexon/bupropion nebyla definitivně stanovena a je potřeba provést novou kardiovaskulární studii.
Dávkování, kontraindikace a nežádoucí účinky
Fixní kombinace naltrexon/bupropion je u nás dostupná pod obchodním názvem Mysimba a je na lékařský předpis. Jedna tableta kombinace naltrexon/bupropion obsahuje 8 mg naltrexonu a 90 mg bupropionu. Lék se postupně titruje první týden jedna jedna tableta ráno, druhý týden jedna tableta ráno a jedna tableta večer, třetí týden dvě tablety ráno a jedna tableta večer a čtvrtý týden dvě tablety ráno a dvě tablety večer. Maximální doporučená denní dávka přípravku Mysimba jsou dvě tablety 2× denně v celkové dávce 32 mg naltrexonu a 360 mg bupropionu.
Nejčastějšími nežádoucími účinky kombinace naltrexon/bupropion jsou nauzea, zácpa (velmi časté), zvracení (velmi časté), závrať (časté) a sucho v ústech (časté). Gastrointestinální nežádoucí účinky (nauzea, zácpa, zvracení) většinou samy ustoupují během 4 týdnů a téměř všechny během 24 týdnů.
Liraglutid
Mechanizmus účinku
Liraglutid je 97% homologem nativního receptoru glukagon-like peptidu-1 (GLP), který má dvě hlavní odlišnosti: nahrazení lysinu na pozici 34 argininem a přidání laterálního řetězce palmitové kyseliny na pozici 26 [28,29]. Zmíněné odlišnosti snižují citlivost liraglutidu k degradaci dipeptidyl peptidázou-4 (DPP-4), a prodlužují tak jeho poločas, což umožňuje terapeutické podávání liraglutidu 1× denně ve formě subkutánní injekce [29]. Liraglutid v dávce 3,0 mg vede u pacientů s obezitou ke zvýšení pocitu sytosti, snížení pocitu hladu, s výsledným snížením energetického příjmu až o 16 % [30–32].
Vliv na redukci tělesné hmotnosti
Klinický program liraglutidu v dávce 3,0 mg SCALE (Satiety and Clinical Adiposity, Liraglutide Evidence) fáze III zahrnuje čtyři multicentrické, randomizované, dvojitě zaslepené, placebem kontrolované studie s paralelními skupinami: SCALE Obesity and Prediabetes, SCALE Diabetes, SCALE Maintenance a SCALE Sleep Apnoea [32,33]. Ve všech studiích SCALE byla léčba liraglutidem zahájena v dávce 0,6 mg a navyšována až do dosažení maximální denní dávky 3,0 mg. Maximální dávkování bylo dodrženo beze změn během celé studie, do hodnocení výsledků byli zahrnuti všichni randomizovaní pacienti, kteří užili alespoň jednu dávku intervenčního léčiva nebo srovnávaného přípravku.
Studie SCALE Obesity and Prediabetes hodnotila pokles tělesné hmotnosti po 56 týdnech léčby u pacientů s obezitou (BMI ≥ 30 kg/m2) nebo s nadváhou (BMI ≥ 27 kg/m2) s dyslipidemií anebo hypertenzí, avšak bez DM2T. U všech pacientů byl dále proveden screening pro zjištění prediabetického stavu [32]. Pacienti s prediabetem byli dále sledováni až po celkovou dobu 160 týdnů léčby. Po obou léčebných periodách následovalo 12týdenní observační pokračovací období s vysazením léku/placeba. V 56. týdnu došlo u pacientů léčených liraglutidem v dávce 3,0 mg k průměrnému poklesu tělesné hmotnosti o 8,4 kg, což odpovídá 8,0 % výchozí hodnoty, ve srovnání s 2,8 kg (2,6 %) ve skupině s placebem. U pacientů, kteří studii dokončili, byl úbytek hmotnosti ještě větší: 9,6 kg (9,2 %) při léčbě liraglutidem vs. 3,7 kg (3,5 %) při užívání placeba. Pacienti s prediabetem, kteří pokračovali v léčbě (celkově byli léčeni 160 týdnů až 3 roky), dosáhli úbytku tělesné hmotnosti 7,1 % ve srovnání s 2,7 % ve skupině s placebem (p < 0,0001). Během 56 týdnů léčby dosáhla remise prediabetu většina pacientů (69,2 vs. 32,7 %; p = 0,0001). Ve 160. týdnu léčby byl DM2T diagnostikován u 3 % pacientů léčených liraglutidem a u 11 % pacientů, kterým bylo podáváno placebo. Odhadovaný čas do nástupu DM2T byl u pacientů léčených liraglutidem v dávce 3,0 mg 2,7× delší. Liraglutid po 3 letech léčby tedy snížil riziko rozvoje DM2T u prediabetiků téměř o 80 % ve srovnání s placebem [34].
Studie SCALE Diabetes trvající 56 týdnů byla navržena k hodnocení schopnosti liraglutidu v dávce 3,0 mg snížit tělesnou hmotnost pacientů s nedostatečně kontrolovaným DM2T s obezitou či nadváhou [35]. Studie randomizovala pacienty (v poměru 2: 1: 1) k léčbě liraglutidem v dávce 3,0 mg (n = 423), liraglutidem v dávce 1,8 mg (n = 211), nebo k podávání placeba (n = 212). Pokles tělesné hmotnosti po 56 týdnech byl 6,0 % při léčbě liraglutidem 3,0 mg a 2,0 % při užívání placeba. Ve vztahu ke kompenzaci diabetu se po 56 týdnech léčby hladina HbA1c snížila v průměru o 13 mmol/mol u pacientů randomizovaných k léčbě liraglutidem v dávce 3,0 mg vs. 4 mmol/mol s placebem (p < 0,0001).
Ve studii SCALE Maintenance byla zkoumána schopnost liraglutidu v dávce 3,0 mg zvýšit úbytek tělesné hmotnosti, který byl dosažen během 12 týdnů léčby velmi přísnou nízkokalorickou dietou (VLCD) a pravidelnou fyzickou aktivitou u pacientů bez DM2T s nadváhou (BMI > 27 kg/m2 a komorbidity) nebo obezitou [36]. Pacienti během této první fáze průměrně zredukovali 6 % tělesné hmotnosti. V léčebné následující fázi v 0. týdnu byli pacienti randomizováni do skupin užívajících buď liraglutid, nebo placebo. Po 56 týdnech léčby liraglutidem bylo ve srovnání s výchozí hodnotou dosaženo dalšího úbytku tělesné hmotnosti o 6,2 % oproti 0,2 % u skupiny s placebem (p < 0,0001). Za celkové období (14 týdnů VLCD + 56 týdnů léčby liraglutidem v dávce 3 mg) dosáhl hmotnostní pokles pacientů 12,2 % výchozí tělesné hmotnosti.
Čtvrtá studie SCALE Sleep Apnoea byla navržena ke zhodnocení vlivu léčby liraglutidem v dávce 3,0 mg na zlepšení parametrů, které se vztahují ke spánku a k tělesné hmotnosti u obézních pacientů se syndromem obstrukční spánkové apnoe (OSA) středního nebo závažného stupně, kteří nejsou schopni používat přístroj CPAP, popř. jej netolerují [31]. Závažnost syndromu OSA byla určena podle indexu apnoe/hyperpnoe (AHI) [37]. Po 32 týdnech bylo při léčbě liraglutidem v dávce 3,0 mg dosaženo signifikantního snížení hodnoty AHI ve srovnání s placebem (12,2 vs. 6,1 příhody/hod; p = 0,015). Podobně vyšší podíl pacientů vyřešil svoji respirační poruchu dosažením hodnoty AHI < 5 příhod/hod (5,4 % při léčbě liraglutidem vs. 1,2 % při užívání placeba) a také vyšší podíl (26,2 vs. 19,3 % s placebem) dosáhl snížení své hodnoty AHI < 15 příhod/hod, čímž se klasifikovali jako skupina s mírným syndromem OSA, které bylo umožněno nepoužívat přístroj CPAP. Co se týče tělesné hmotnosti, léčba liraglutidem v dávce 3,0 mg způsobila pokles o 5,7 %, což bylo významně více než ve skupině s placebem 1,6 % (p < 0,0001).
Efekt na další kardiometabolické parametry
Kardiovaskulární bezpečnost liraglutidu je popsána ve studii LEADER. Délka expozice byla mezi 3,5 a 5 lety. Liraglutid v dávce 1,8 mg u pacientů s DM2T ve vysokém kardiovaskulárním riziku nebo již s anamnézou kardiovaskulární příhody oproti placebu významně snížil výskyt závažných nežádoucích kardiovaskulárních příhod (MACE, kompozit smrti z kardiovaskulárních příčin, nefatálního infarktu myokardu a nefatálních cévních mozkových příhod) o 13 %. Samotné riziko úmrtí z kardiovaskulárních příčin bylo sníženo až o 22 % [38], významně bylo sníženo i riziko celkové mortality (o 15 %). K podobným závěrům dospěla také metaanalýza dat SCALE, tj. že léčba liraglutidem v dávce 3 mg je bezpečná. Na základě silných důkazů o prokázané kardioprotektivitě ve studii LEADER jsou GLP-1 analoga s prokázanou kardioprotektivitou včetně liraglutidu lékem druhé volby (po metforminu) v nových doporučeních ADA/EASD pro pacienty s DM2T typu s převažujícím aterosklerotickým kardiovaskulárním onemocněním a také u pacientů s DM2T a obezitou, kde zároveň přispívají k redukci tělesné hmotnosti [35]. Léčba liraglutidem v dávce 3,0 mg byla rovněž doprovázena zvýšením tepové frekvence o 2–3 tepy/min, aniž by byl zaznamenán vyšší výskyt kardiovaskulárních příhod [36]. Tento účinek nezávisel na dávce a tepová frekvence se normalizovala po ukončení léčby.
Zároveň bylo zjištěno, že došlo ke zlepšení některých parametrů nad úroveň, kterou lze očekávat při poklesu hmotnosti. Liraglutid tak ovlivňuje některé kardiovaskulární parametry přímo, tedy i nezávisle na poklesu hmotnosti. Jde zejména o krevní tlak, glykovaný hemoglobin, glykemii na lačno, hladinu LDL či celkového cholesterolu [39].
Léčba liraglutidem v dávce 3,0 mg vedla ke zlepšení kvality života v následujících parametrech: fyzická kondice, sebeúcta, sexuální život, obecná úzkost v práci. Stejně tak vedla ke zlepšení hodnot systolického a diastolického krevního tlaku či lipidového profilu (významné snížení hladin celkového a LDL cholesterolu, triglyceridů, společně se zvýšením hladin HDL cholesterolu). Snížily se rovněž hladiny C-reaktivního proteinu a zvýšily se hladiny adiponektinu [33,35,36,40,41].
Dávkování, kontraindikace a nežádoucí účinky
Liraglutid pro léčbu obezity v dávce 3 mg je u nás dostupný pod obchodním názvem Saxenda. Počáteční dávka je 0,6 mg 1× denně. Dávka se postupně navyšuje v přírůstcích po 0,6 mg v nejméně týdenních intervalech (0,6–1,2–1,8–2,4–3,0 mg), aby se zlepšila gastrointestinální snášenlivost. Liraglutid se podává 1× denně kdykoliv v průběhu dne, nezávisle na jídle, ideálně ve stejnou dobu. Aplikuje se injekčně do podkoží břicha, stehna nebo horní části paže. Maximální denní dávka liraglutidu je 3,0 mg/den.
Co se týče bezpečnosti a tolerance, vyšší podíl pacientů léčených liraglutidem v dávce 3,0 mg udával nežádoucí příznaky ve srovnání s placebem (91,6 vs. 83,6 %). Bezpečnostní profil liraglutidu v dávce 3,0 mg byl shodný s účinky liraglutidu v dávce 1,8 mg, který je užíván v léčbě DM2T a byl podobný jak při krátkodobém užívání 56 týdnů, tak i při dlouhodobém užívání. Celkově nejčastěji byly zaznamenány gastrointestinální nežádoucí účinky (nauzea, zvracení, průjem, zácpa). Incidence nevolnosti dosáhla svého maxima v období zvyšování dávky a byla vyšší při vyšších dávkách [33,35,36]. Ve 12. týdnu dosáhla incidence nevolnosti při léčbě liraglutidem v dávce 3,0 mg kolem 10 %. Nevolnost byla přechodná, mírné (73 %) nebo střední závažnosti (24 %). Reakce se obvykle objevily během prvních týdnů léčby a zeslábly během několika dní nebo týdnů pokračující léčby. Pouze 3 % pacientů ukončila studii z důvodu nevolnosti.
Analoga GLP-1 receptoru účinkují v závislosti na glukóze, takže spontánně uváděná četnost hypoglykemie u pacientů bez DM2T užívajících liraglutid byla nízká, přičemž nebyla hlášena závažná hypoglykemie [33]. Ve studii SCALE Diabetes měli pacienti léčení liraglutidem vyšší výskyt hypoglykemie ve srovnání s pacienty užívajícími placebo, zejména u skupiny, které byla zároveň podávána sulfonylurea [35]. Při zahájení podávání liraglutidu má být zváženo snížení dávky derivátů sulfonylurey či inzulinu, aby se snížilo riziko hypoglykemie.
Během programu SCALE bylo pozorováno nepatrné zvýšení hladin amylázy a lipázy v séru, přičemž nebyla překročena průměrná horní hranice normálních hodnot a po ukončení léčby se hladiny normalizovaly [33,35,41].
Během studie SCALE Obesity and Prediabetes byla četnost výskytu biliární litiázy vyšší ve skupině s liraglutidem v dávce 3,0 mg než s placebem (2,5/100 vs. 1,0/100 paciento-roků léčby), přičemž nebyly zaznamenány rozdíly v četnosti hepatobiliárních příhod během studií SCALE Diabetes, Maintenance a Sleep Apnoea [33,35,36,41].
Liraglutid vykazuje velmi dobrý bezpečnostní profil s minimem kontraindikací jeho užívání. Jeho podávání není doporučeno u pacientů s pankreatitidou nebo cholecystitidou či jejich přítomností v předchozím období, u pacientů s mnohočetnou endokrinní neoplazií a u pacientů, kteří mají anamnézu medulárního karcinomu štítné žlázy. Opatrnost při podávání se doporučuje i při pokročilém onemocnění ledvin nebo jater a u pacientů s cholelitiázou a gastroparézou.
Algoritmus volby jednotlivých antiobezitik
Dnes, po dlouhé době, jsou k dispozici čtyři antiobezitika s různými mechanizmy účinku a další nové léky budou pravděpodobně v čase přibývat. Je tedy více než důležité vědět, jakou účinnost tyto léky mají, jaké mají nežádoucí účinky a podle jakých kritérií zvolit vhodný lék pro konkrétního pacienta.
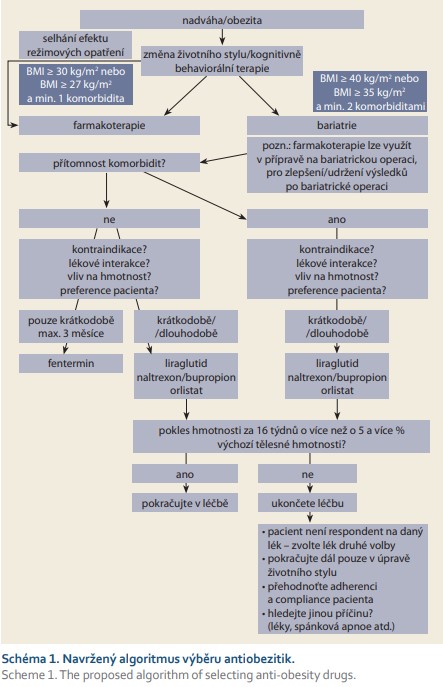
Doporučovaný postup při výběru vhodného antiobezitika
Při volbě vhodného antiobezitka pro konkrétního pacienta je možné se držet uvedeného schématu 1.
Antiobezitika jsou indikována, pokud pacient splňuje indikační kritéria:
- BMI ≥ 30 kg/m2 nebo;
- BMI ≥ 27 kg/m2 za přítomnosti alespoň jedné komorbidity související s hmotností.
V dalším kroku by měla o volbě vhodného antiobezitika rozhodnout přítomnost, či nepřítomnost komplikací a komorbidit. Pokud nejsou, lze volit ze čtyř stávajících antiobezitik, kdy o výběru vhodného antiobezitika je třeba rozhodnout na základě:
- kontraindikací;
- lékových interakcí;
- účinnosti na pokles hmotnosti;
- preference pacienta (tablety vs. injekční léčba, cena atd.).
Jsou-li přítomny již konkrétní komplikace obezity či komorbidity, mělo by být upřednostněno antiobezitikum s jednoznačně prokázaným benefitem podle medicíny založené na důkazech. V případě pacientů s prediabetem, DM2T a kardiovaskulárním onemocněním by měla být preference antiobezitik v tomto pořadí liraglutid – orlistat – kombinace naltrexon/bupropion. Pro liraglutid hovoří největší účinnost při snížení hmotnosti, přímý vliv na některé složky metabolického syndromu a zatím nejsilnější důkazy o kardiovaskulární bezpečnosti. Nicméně je třeba se vyvarovat použití liraglutidu u pacientů s předchozím onemocněním pankreatitidou nebo cholecystitidou, u pacientů s mnohočetnou endokrinní neoplazií a u pacientů s anamnézou medulárního karcinomu štítné žlázy. Opatrnost při podávání se doporučuje při pokročilém onemocnění ledvin nebo jater, v přítomnosti cholelitiázy a gastroparézy.
Kombinace naltrexon/bupropion vyhovuje pacientům, kteří nezvládají dodržovat dietní opatření, prokazují jistou impulzivitu v přijímání potravy nebo se u nich vyskytují poruchy jako přejídání a z těchto důvodů se jim komplikuje návyk na dietu. Před tím, než je medikace předepsána, je třeba přezkoumat kontraindikace jejího použití, nemožnost podání u pacientů s nekontrolovanou hypertenzí, při poruchách příjmu potravy (anorexia nervosa a bulimie), při závažné depresi, u pacientů léčených inhibitory monoaminooxidázy (IMAO), u těch, kteří jsou ve fázi náhlého odvykání alkoholu nebo léčeni léky s opioidním účinkem. Zvláštní pozornost by měla být věnována přítomnosti srdeční arytmie, glaukomu s úzkým úhlem, přetrvávající migrény, záchvatů generalizované úzkosti, bipolární poruchy a poruch funkce jater či ledvin.
Nejběžnější nežádoucí účinky obou přípravků – jak kombinace naltrexon/bupropion, tak liraglutidu – jsou přechodné a nepředstavují hlavní důvod pro ukončení léčby. Těmi jsou v současné době především limity finanční. Další důvody, které ovlivňují přijetí dlouhodobé léčby, jsou potřeba užívat čtyři tablety denně v případě přípravku Mysimba nebo subkutánně denně aplikovat přípravek Saxenda.
Orlistat lze s výhodou předepisovat u pacientů bez intestinálního onemocnění, kteří si nepřejí lék s možnými centrálními účinky a kteří volním úsilím obtížně zvládají jak nepravidelnost v jídle, tak preferenci tučné stravy. Orlistat může interferovat s podáváním warfarinu a je třeba u pacientů léčených warfarinem při léčbě orlistatem dávku warfarinu upravovat.
K předepisování fenterminu je třeba přistupovat pouze výjimečně, z důvodu vysokého rizika vzniku závislosti a také řady závažných nežádoucích účinků.
Pokud u pacientů po 12 týdnech léčby na cílové dávce nedochází k poklesu tělesné hmotnosti alespoň o 5 %, má být léčba ukončena, protože na podkladě výsledků klinických studií je prokázáno, že u každého antiobezitika existují tzv. non-respondéři. Tito pacienti na léčbu daným antiobezitikem nereagují nebo reagují minimálně. Odhadnout, zda pacient bude na léčbu odpovídat, lze zatím pouze empiricky. U těchto pacientů je třeba buď vyzkoušet jiný léčebný přípravek, nebo hledat další možnosti léčby obezity. U liraglutidu bylo non-respondérů ve studii SCALE Obesity and Prediabetes kolem 32,5 % u nediabetiků a 49,6 % u pacientů s DM2T. Na druhou stranu pacienti, kteří na léčbu reagovali dobře v prvních 16 týdnech, dosahovali lepších průměrných výsledků. Pokles hmotnosti respondérů byl v průměru 11,5 % výchozí hodnoty u nediabetiků a 9,3 % výchozí hodnoty u pacientů s DM2T [42]. Antiobezitika, která lze užívat dlouhodobě, jsou liraglutid, naltrexon/bupropion a orlistat. V prvním roce léčby dochází k poklesu hmotnosti, následně pomáhají antiobezitika k udržení dosaženého poklesu tělesné hmotnosti z prvního roku léčby [35].
Bohužel proti dlouhodobému užívání zatím hovoří chybění jakékoliv úhrady pojišťovnami a v případě moderních preparátů vysoká cena.
Účinek léčby antiobezitiky je třeba podpořit dalšími běžnými přístupy v léčbě obezity. Studie s liraglutidem v kombinaci s intenzivní behaviorální terapií a úpravou životního stylu prokazují, že v této kombinaci lze dosáhnout významně vyššího poklesu tělesné hmotnosti o 11,5 % oproti výchozí hodnotě vs. 6,1 % u intenzivní behaviorální terapie samotné [43]. V podobné studii s naltrexon/bupropionem v kombinaci s intenzivní behaviorální terapií bylo dosaženo 9,4% redukce tělesné hmotnosti vs. 5,1 % u intenzivní behaviorální terapie samotné [26]. Antiobezitika lze také úspěšně využít v přípravě na bariatrické operace [44]. Pomáhají po bariatrických operacích k zabránění nárůstu hmotnosti či k mírnému zlepšení výsledků bariatrických operací [45]. Kombinovat antiobezitika navzájem se nedoporučuje, neboť existují pouze minimální zkušenosti a zcela chybí randomizované klinické studie, které by prokázaly, že účinnost a bezpečnost případných kombinací převažují nad případnými riziky. Opakovaně bylo také prokázáno, že vysazení farmak snižujících tělesnou hmotnost nebo jejich nahrazení placebem obvykle vedlo k opětnému nárůstu tělesné hmotnosti. V této souvislosti je třeba upozornit na to, že farmaka upravují často geneticky podmíněnou metabolickou nebo regulační poruchu u obezity, a proto je třeba počítat s jejich dlouhodobým, často celoživotním podáváním, podobně jako je tomu u jiných komplexních chorob, např. u hypertenze. Při nezbytnosti jejich vysazení, nejčastěji z finančních důvodů, lze do jisté míry limitovat toto navýšení jak důkladnou edukací pacienta v režimových opatřeních, tak i postupným snižováním dávky antiobezitika při jeho vysazování. I nadále je však nutné sledovat pacienta s cílem minimalizovat nárůst tělesné hmotnosti.
Závěr
Obezita je chronické onemocnění, které v posledních 30 letech dosahuje rozměrů celosvětové pandemie. Z hlediska jednotlivce zhoršuje kvalitu života a pracovní výkonnost. Zmnožení tuku v organizmu nad optimální mez a jeho zánětlivá změna spojená s dysfunkcí tukové tkáně je podkladem pro rozvoj zejména kardiometabolických komplikací obezity, které, jsou-li neléčené, významně zkracují život. V současné době je již řada léčebných postupů, které prognózu a kvalitu života nemocných s obezitou výrazně zlepšují, od režimových opatření přes farmakoterapii až k bariatricko-metabolické chirurgii. Základním omezením pro použití léků v léčení obezity je zcela chybějící úhrada z veřejného zdravotního pojištění, což zásadně snižuje jejich dostupnost pro potřebné nemocné. Na úhradu antiobezitik nelze nadále pohlížet jako na ekonomicky neúnosné náklady. Jejich alespoň částečné hrazení ze zdravotního pojištění u dobře motivovaných pacientů s vyšším stupněm obezity a přítomností závažných komorbidit, kteří prokázali compliance k režimovým opatřením a dietě, považujeme za součást efektivního využívání zdrojů, a to zejména z pohledu předcházení vzniku a rozvoje DM2T, kardiovaskulárních komplikací, některých nádorových onemocnění, ventilační nedostatečnosti, přetížení pohybového aparátu, psychosociálních stigmatizací, pracovní neschopnosti a snížené kvality života. Definice podskupiny pacientů s největším benefitem z farmakoterapie by měla vyplynout z diskuze odborníků s aktivním zapojením odborných společností, které podpořily toto stanovisko.
Doručeno/Submitted: 13. 11. 2020
Přijato/Accepted: 18. 11. 2020
prof. MUDr. Martin Fried, CSc.
OB KLINIKA, a.s.
Pod Krejcárkem 975/2
130 00 Praha 3-Žižkov
martin.fried@obklinika.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. König HH, Lehnert T, Brenner H et al. Health service use and costs associated with excess weight in older adults in Germany. Age Ageing 2015; 44 (4): 616–623. doi: 10.1093/ageing/afu120.
2. Specchia ML, Veneziano MA, Cadeddu C et al. Economic impact of adult obesity on health systems: a systematic review. Eur J Public Health 2015; 25 (2): 255–262. doi: 10.1093/eurpub/cku170.
3. Tremmel M, Gerdtham UG, Nilsson PM et al. Economic burden of obesity: a systematic literature review. Int J Environ Res Public Health 2017; 14 (4): 435. doi: 10.3390/ijerph14040435.
4. Flegal KM, Panagiotou OA, Graubard BI. Estimating population attributable fractions to quantify the health burden of obesity. Ann Epidemiol 2015; 25 (3): 201–207. doi: 10.1016/j.annepidem.2014.11.010.
5. Hebebrand J, Holm JC, Woodward E et al. A proposal of the European association for the study of obesity to improve the ICD-11 dia gnostic criteria for obesity based on the three dimensions etiology, degree of adiposity and health risk. Obes Facts 2017; 10 (4): 284–307. doi: 10.1159/000479208.
6. Yumuk V, Tsigos C, Fried M et al. European guidelines for obesity management in adults. Obes Facts 2015; 8 (6): 402–424. doi: 10.1159/000442721.
7. Greenway FL. Physiological adaptations to weight loss and factors favouring weight regain. Int J Obes (Lond) 2015; 39 (8): 1188–1196. doi: 10.1038/ijo.2015.59.
8. Sumithran P, Prendergast LA, Delbridge E et al. Long-term persistence of hormonal adaptations to weight loss. N Engl J Med 2011; 365 (17): 1597–1604. doi: 10.1056/NEJMoa1105816.
9. Jensen MD, Ryan DH, Apovian CM et al. 2013 AHA/ACC/TOS guideline for the mana gement of overweight and obesity in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and The Obesity Society. J Am Coll Cardiol 2014; 63 (25 Pt B): 2985–3023. doi: 10.1016/j.jacc.2013.11.004.
10. Lean ME, Leslie WS, Barnes AC et al. Primary care-led weight management for remission of type 2 diabetes (DiRECT): an open-label, cluster-randomised trial. Lancet 2018; 391 (10120): 541–551. doi: 10.1016/S0140-6736 (17) 33102-1.
11. Schutz DD, Busetto L, Dicker D et al. European practical and patient-centred guidelines for adult obesity management in primary care. Obes Facts 2019; 12 (1): 40–66. doi: 10.1159/000496183.
12. Wadden TA, West DS, Neiberg RH et al. One-year weight losses in the Look AHEAD study: factors associated with success. Obesity (Silver Spring) 2009; 17 (4): 713–722. doi: 10.1038/oby.2008.637.
13. Hainer V. Základy klinické obezitologie. Praha: Grada 2011.
14. Sjöström L, Rissanen A, Andersen T et al. Randomised placebo-controlled trial of orlistat for weight loss and prevention of weight regain in obese patients. European Multicentre Orlistat Study Group. Lancet 1998; 352 (9123): 167–172. doi: 10.1016/s0140-6736 (97) 11509-4.
15. Leblanc ES, O’Connor E, Whitlock EP et al. Effectiveness of primary care-relevant treatments for obesity in adults: a systematic evidence review for the U.S. Preventive Services Task Force. Ann Intern Med 2011; 155 (7): 434–447. doi: 10.7326/0003-4819-155-7-201110040-00006.
16. Torgerson JS, Hauptman J, Boldrin MN et al. XENical in the prevention of diabetes in obese subjects (XENDOS) study: a randomized study of orlistat as an adjunct to lifestyle changes for the prevention of type 2 diabetes in obese patients. Diabetes Care 2004; 27 (1): 155–161. doi: 10.2337/diacare.27.1.155.
17. Davidson MH, Hauptman J, DiGirolamo M et al. Weight control and risk factor reduction in obese subjects treated for 2 years with orlistat: a randomized controlled trial. JAMA 1999; 281 (3): 235–242. doi: 10.1001/jama.281.3.235.
18. Kelley DE, Bray GA, Pi-Sunyer FX et al. Clinical efficacy of orlistat therapy in overweight and obese patients with insulin-treated type 2 diabetes: A 1-year randomized controlled trial. Diabetes Care 2002; 25 (6): 1033–1041. doi: 10.2337/diacare.25.6.1033.
19. Tonstad S, Pometta D, Erkelens DW et al. The effect of the gastrointestinal lipase inhibitor, orlistat, on serum lipids and lipoproteins in patients with primary hyperlipidaemia. Eur J Clin Pharmacol 1994; 46 (5): 405–410. doi: 10.1007/BF00191901.
20. Hvizdos KM, Markham A. Orlistat: a review of its use in the management of obesity. Drugs 1999; 58 (4): 743–760. doi: 10.2165/00003495-19995804 0-00015.
21. McNeely W, Benfield P. Orlistat. Drugs 1998; 56 (2): 241–250. doi: 10.2165/00003495-19985 6020-00007.
22. Greig SL, Keating GM. Naltrexone ER/Bupropion ER: a review in obesity management. Drugs 2015; 75 (11): 1269–1280. doi: 10.1007/ s40265-015-0427-5.
23. Caixàs A, Albert L, Capel I et al. Naltrexone sustained-release/bupropion sustained-release for the management of obesity: review of the data to date. Drug Des Devel Ther 2014; 8: 1419–1427. doi: 10.2147/DDDT.S55587.
24. Greenway FL, Dunayevich E, Tollefson G et al. Comparison of combined bupropion and naltrexone therapy for obesity with monotherapy and placebo. J Clin Endocrinol Metab 2009; 94 (12): 4898–4906. doi: 10.1210/jc.2009-1350.
25. Hollander P, Gupta AK, Plodkowski R et al. Effects of naltrexone sustained-release/bupropion sustained-release combination therapy on body weight and glycemic parameters in overweight and obese patients with type 2 diabetes. Diabetes Care 2013; 36 (12): 4022–4029. doi: 10.2337/dc13-0234.
26. Wadden TA, Foreyt JP, Foster GD et al. Weight loss with naltrexone SR/bupropion SR combination therapy as an adjunct to behavior modification: the COR-BMOD trial. Obesity (Silver Spring) 2011; 19 (1): 110–120. doi: 10.1038/oby.2010.147.
27. Nissen SE, Wolski KE, Prcela L et al. Effect of naltrexone-bupropion on major adverse cardiovascular events in overweight and obese patients with cardiovascular risk factors: a randomized clinical trial. JAMA 2016; 315 (10): 990–1004. doi: 10.1001/jama.2016.1558.
28. Bode B. An overview of the pharmacokinetics, efficacy and safety of liraglutide. Diabetes Res Clin Pract 2012; 97 (1): 27–42. doi: 10.1016/j.diabres.2011.12.015.
29. Jacobsen LV, Flint A, Olsen AK et al. Liraglutide in type 2 diabetes mellitus: clinical pharmacokinetics and pharmacodynamics. Clin Pharmacokinet 2016; 55 (6): 657–672. doi: 10.1007/s40262-015-0343-6.
30. van Can J, Sloth B, Jensen CB et al. Effects of the once-daily GLP-1 analog liraglutide on gastric emptying, glycemic parameters, appetite and energy metabolism in obese, non-diabetic adults. Int J Obes (Lond) 2014; 38 (6): 784–793. doi: 10.1038/ijo.2013.162.
31. Flint A, Kapitza C, Hindsberger C et al. The once-daily human glucagon-like peptide-1 (GLP-1) analog liraglutide improves postprandial glucose levels in type 2 diabetes patients. Adv Ther 2011; 28 (3): 213–226. doi: 10.1007/s12325-010-0110-x.
32. Horowitz M, Flint A, Jones KL et al. Effect of the once-daily human GLP-1 analogue liraglutide on appetite, energy intake, energy expenditure and gastric emptying in type 2 diabetes. Diabetes Res Clin Pract 2012; 97 (2): 258–266. doi: 10.1016/j.diabres.2012.02.016.
33. Pi-Sunyer X, Astrup A, Fujioka K et al. A randomized, controlled trial of 3.0 mg of liraglutide in weight management. N Engl J Med 2015; 373 (1): 11–22. doi: 10.1056/NEJMoa1411 892.
34. le Roux CW, Astrup A, Fujioka K et al. 3 years of liraglutide versus placebo for type 2 diabetes risk reduction and weight management in individuals with prediabetes: a randomised, double-blind trial. Lancet 2017; 389 (10077): 1399–1409. doi: 10.1016/S0140-6736 (17) 30069-7.
35. Davies MJ, D‘Alessio DA, Fradkin J et al. Management of hyperglycemia in type 2 diabetes, 2018. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Dia Care 2018; 41 (12): 2669–2701. doi: 10.2337/dci18-0033.
36. Wadden TA, Hollander P, Klein S et al. Weight maintenance and additional weight loss with liraglutide after low-calorie-diet-induced weight loss: The SCALE Maintenance randomized study. Int J Obes (Lond) 2015; 39 (1): 187. doi: 10.1038/ijo.2014.88.
37. Sleep-related breathing disorders in adults: recommendations for syndrome definition and measurement techniques in clinical research. The Report of an American Academy of Sleep Medicine Task Force. Sleep 1999; 22 (5): 667–689.
38. Marso SP, Daniels GH, Brown-Frandsen K et al. Liraglutide and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2016; 375 (4): 311–322. doi: 10.1056/NEJMoa1603827.
39. Bays H, Pi-Sunyer X, Hemmingsson JU et al. Liraglutide 3.0 mg for weight management: weight-loss dependent and independent effects. Curr Med Res Opin 2017; 33 (2): 225–229. doi: 10.1080/03007995.2016.1251892.
40. Kolotkin RL, Fujioka K, Wolden ML et al. Improvements in health-related quality of life with liraglutide 3.0 mg compared with placebo in weight management. Clin Obes 2016; 6 (4): 233–242. doi: 10.1111/cob.12146.
41. Blackman A, Foster GD, Zammit G et al. Effect of liraglutide 3.0 mg in individuals with obesity and moderate or severe obstructive sleep apnea: the SCALE sleep apnea randomized clinical trial. Int J Obes (Lond) 2016; 40 (8): 1310–1319. doi: 10.1038/ijo.2016.52.
42. Fujioka K, O‘neil PM, Davies M et al. Early weight loss with liraglutide 3.0 mg predicts 1-year weight loss and is associated with improvements in cinical markers. Obesity (Silver Spring) 2016; 24 (11): 2278–2288. doi: 10.1002/oby.21629.
43. Wadden TA, Walsh OA, Berkowitz RI et al. Intensive behavioral therapy for obesity combined with liraglutide 3.0 mg: a randomized controlled trial. Obesity (Silver Spring) 2019; 27 (1): 75–86. doi: 10.1002/oby.22359.
44. Modi R, Rye P, Cawsey et al. Liraglutide effects on upper gastrointestinal investigations: implications prior to bariatric surgery. Obes Surg2018; 28 (7): 2113–2116. doi: 10.1007/s11695-018-3249-1.
45. Suliman M, Buckley A, Tikriti AA et al. Routine clinical use of liraglutide 3 mg for the treatment of obesity: outcomes in non‐surgical and bariatric surgery patients. Diabetes Obes Metab 2019; 21 (6): 1498–1501. doi: 10.1111/dom.13672.