Využití umělé inteligence v koloskopii
Dana Zimandlová1, Ilja Tachecí1
+ Pracoviště
Souhrn
Východiska: Umělá inteligence (AI) představuje významný nástroj zvyšování a standardizace kvality koloskopického vyšetření. Její přínos spočívá nejen v detekci lézí a podpoře kvality vyšetření, ale i v potenciálním snížení nákladů prostřednictvím omezení nutnosti histologického vyšetření a optimalizace prevence kolorektálního karcinomu. Cíl: Cílem této přehledové práce je zhodnotit aktuální možnosti využití AI v koloskopii včetně analýzy jejího přínosu v detekci adenomů (CADe), optické diagnostice polypů (CADx), hodnocení zánětlivé aktivity u IBD, posouzení kvality vyšetření a shrnutí současných doporučení odborných společností. Závěry: AI prokazuje významné zlepšení míry detekce adenomů, zejména u méně zkušených endoskopistů. V oblasti CADx se jeví jako slibná především u diminutivních polypů, přesto její výkonnost často nedosahuje kritérií potřebných k náhradě histologického vyšetření. U idiopatických střevních zánětů může AI napomoci standardizaci hodnocení zánětlivé aktivity a predikci dysplazie, zatím však bez rutinního klinického uplatnění. Dále byly popsány možnosti využití v hodnocení kvality koloskopie, jako je střevní příprava, vizualizace sliznice či dosažení céka. V neposlední řadě je třeba zohlednit ekonomické a technické aspekty implementace AI do praxe. AI může být v budoucnu významnou pomůckou pro zlepšení kvality koloskopie, především prostřednictvím zvýšení detekce lézí a podpory standardizace vyšetření. Zatím však zůstává řada omezení – například nedostatečná standardizace tréninkových dat, variabilita výkonnosti různých modelů a absence přesvědčivých dat o dlouhodobém dopadu na epidemiologii kolorektálního karcinomu. Implementace AI by proto měla probíhat s důrazem na informovanost uživatelů, přehled o možnostech i limitacích a s ohledem na potřeby zdravotnického systému.
Klíčová slova
koloskopie, umělá inteligence, CADe, CADx, idiopatické střevní záněty, kvalita endoskopie
Principy umělé inteligence
Umělá inteligence (AI – artificial intelligence) je disciplína informatiky zaměřená na návrh a implementaci algoritmů, které napodobují nebo podporují kognitivní funkce člověka, jako jsou učení, rozhodování, rozpoznávání vzorců či řešení problémů. Moderní přístupy v AI využívají především metody strojového učení (ML – machine learning) a hlubokého učení (DL – deep learning), jež umožňují zpracovávat a analyzovat rozsáhlé datové soubory za účelem tvorby prediktivních a rozhodovacích modelů. Hluboké učení často pracuje s konvolučními neuronovými sítěmi (CNN – convolutional neural networks), které jsou inspirovány strukturou a funkcemi lidského mozku. Tyto sítě dokážou automaticky extrahovat specifické rysy z dat, například z obrazových nebo videozáznamů, bez nutnosti lidského zásahu.
V oblasti digestivní endoskopie umožňují systémy využívající AI detekci relevantních struktur, jako jsou polypy nebo dosažení dna céka, a to prostřednictvím analýzy endoskopických snímků nebo videozáznamů, na základě předchozího učení z rozsáhlých datových sad označených odborníky [1,2].
Očekávané využití umělé inteligence v koloskopii
Stanovisko Evropské společnosti pro gastrointestinální endoskopii (ESGE) z roku 2022 týkající se očekávaného přínosu AI v digestivní endoskopii vyjmenovává několik potenciálních oblastí, ve kterých by AI mohla zvýšit kvalitu koloskopického vyšetření. Jedná se o objektivní zhodnocení střevní přípravy, potvrzení kompletnosti vyšetření tlustého střeva, zhodnocení kompletnosti (%) obhlédnutí sliznice, detekci neoplastických lézí a jejich optickou diagnostiku čili predikci histologie polypu [3]. V porovnání s prudkým nárůstem dat a využití AI u screeningové či dispenzární koloskopie, zůstává vývoj modelů pro koloskopii u idiopatických střevních zánětů významně pozadu. Další studie hodnotí kvalitu přípravy před koloskopickým vyšetřením, upozorňují na mrtvý úhel čili oblasti sliznice, které nejsou během vyšetření zobrazeny. Několik systémů AI je také komerčně dostupných, první byl schválen americkou FDA (U.S. Food and Drug Administration) v roce 2021 v indikaci detekce polypů tračníku.
Detekce polypů
Jedním z indikátorů kvality koloskopického vyšetření je míra detekce adenomu (ADR – adenoma detection rate). Je prokázáno, že vyšší hodnota tohoto parametru snižuje riziko intervalového karcinomu (vzestup ADR o 1 % snižuje toto riziko o 3–6 %). ADR jednotlivých endoskopistů je v reálné praxi ovšem velmi variabilní (7–53 %) [4]. Příčiny přehlédnutí polypu mohou být jak na straně endoskopisty (dané nedostatečnou zkušeností, technikou vysouvání přístroje, únavou či vyrušováním z okolí), tak i v charakteru léze (nenápadný, subtilní vzhled, sesilní pilovitá léze), případně v důsledku nedostatečné střevní přípravy. V nedávné době bylo vyvinuto vícero modelů AI sloužících k prosté detekci polypů tračníku s cílem snížit adenoma miss rate (AMR – míru přehlédnutých adenomů) a dalších neoplastických lézí, a to tak, že upozorní endoskopistu na podezřelou lézi označením na monitoru nejčastěji barevným rámečkem, případně zvukovým upozorněním (obr. 1). Tyto systémy (nazývané CADe – computer-aided detection) se postupně technicky zdokonalují, což se projevilo postupným zvyšováním jejich senzitivity a současně snížením množství falešně pozitivních detekcí (většinou byly jako polypy nesprávně označeny desuflované slizniční řasy nebo zbytky stolice) [5]. Jednou z příčin tohoto pozitivního trendu může být i kvalitnější trénování modelů AI, které se stále častěji provádějí na krátkých videosekvencích lézí více připomínajících reálné vyšetření a cíl tréninku, tedy detekci neoplastické léze v „pohybu“ v reálném čase, místo na statických endoskopických obrázcích.
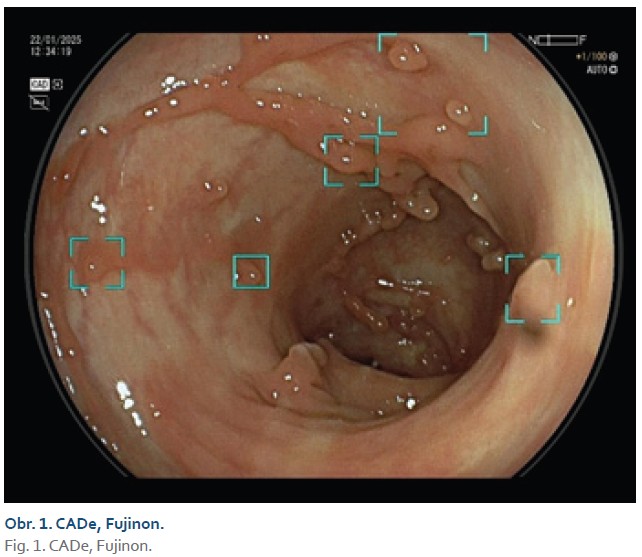
Metaanalýza 44 randomizovaných klinických studií (s více než 30 000 pacienty) srovnávala výsledky koloskopií s/bez CADe na základě hodnocení průměrného počtu adenomů nalezených v rámci jedné koloskopie (APC – adenoma per colonoscopy) a průměrného počtu pokročilých kolorektálních neoplazií rovněž v rámci jednoho koloskopického vyšetření. Sekundárními výstupy byly ADR, AMR, míra detekce pokročilých adenomů. Dále byl hodnocen vytahovací čas a resekce non-neoplastických lézí. Využití CADe bylo spojeno s vyšším průměrným APC (0,98 vs. 0,78), ADR (44,7 vs. 36,7 %), výsledky u pokročilých adenomů se statisticky významně nelišily (průměrný počet na jednu koloskopii byl 0,16 vs. 0,15 bez CADe, míra detekce byla 12,7 vs. 11,5 %) [6]. Limitací tohoto systematického přehledu je významná heterogenita studií a absence zaslepení endoskopistů.
Zajímavá jsou data prokazující různý přínos AI při koloskopii v závislosti na zkušenostech endoskopisty. Také metaanalýza 21 randomizovaných studií prokázala vyšší detekci polypů tračníku při využití AI, ADR se průměrně zvýšil na 44 %, a to především u méně zkušených endoskopistů. U jejich zkušenějších kolegů dosahovala AI srovnatelných výsledků se standardní koloskopií. Toto zjištění by mohlo mít významný dopad na plošné využití AI v pregraduálním tréninku začínajících endoskopistů. Tento možný přínos však musíme hodnotit i v kontextu získávání dalších endoskopických dovedností a návyků, kam patří například kvalita ovládání endoskopu při jeho vysouvání. AI dokáže detekovat samozřejmě pouze ty léze, které jsou zobrazeny v zorném poli optiky endoskopu. Přínos CADe poněkud relativizuje fakt, že byl převážně omezen na zvýšenou detekci diminutivních adenomů, což se neprokázalo u adenomů pokročilých (které jsou zřídka přehlédnuty při kvalitním standardním vyšetření) [7].
Limitací použití těchto modelů v klinické praxi může být rovněž současně zvýšená detekce non-neoplastických lézí (hyperplastických polypů), vedoucí teoreticky k nárůstu nadbytečných polypektomií [8]. Přesto tyto obavy některé práce mírní, výše zmíněná metaanalýza prokazuje na významném vzorku průměrné prodloužení vytahovacího času při využití CADe pouze 53 s. Při asistenci CADe byly resekovány pouze dvě non-neoplastické léze navíc na deset koloskopií [6]. Další nevýhodou metody může být již zmíněný potenciálně vyšší záchyt falešně pozitivních detekcí, což může vést také k prodloužení doby vyšetření. Cílem vyvíjených modelů AI by tedy mělo být tuto falešnou pozitivitu minimalizovat či zcela eliminovat.
V letošním roce byla různými odbornými společnostmi představena první doporučení týkající se použití CADe systémů v klinické praxi. ESGE (European Society of Gastrointestinal Endoscopy) zaujímá stanovisko, že většina dobře informovaných pacientů, kteří se rozhodli podstoupit screeningové nebo dispenzární vyšetření, by upřednostnila asistenci AI, a to z důvodu potenciálního benefitu snížení incidence a mortality na kolorektální karcinom. Experti, kteří toto doporučení vytvořili, jej však sami označují za slabé, protože vliv AI na klíčové epidemiologické parametry kolorektálního karcinomu je pravděpodobně dosud limitovaný a současně se zvyšuje riziko vyšší zátěže zdravotnických systémů i nemocných plynoucí z vyšší detekce polypů, a tedy častějších dispenzárních intervalů (tab. 1) [9].

American Gastroenterological Association (AGA) dospěla k závěru, že v současnosti nelze vyslovit jednoznačné doporučení implementace AI do běžné klinické praxe, a to z podobných důvodů, které ve svém dokumentu uvádí ESGE [10]. Z modelových studií víme, že CADe asistovaná koloskopie pravděpodobně sníží výskyt kolorektálního karcinomu o jedenáct případů na 10 000 vyšetřených pacientů, mortalitu o dva případy z 10 000 koloskopií, a naopak navýší počet dispenzárních koloskopií o 635 z 10 000 vyšetřených jedinců [10]. Na reálná data si nicméně musíme ještě počkat. K tématu se vyjadřuje také recentní doporučený postup České gastroenterologické společnosti, který říká, že AI nelze ještě akceptovat jako standardní součást diagnostické koloskopie, zatím by měla být používána v rámci výzkumu či při tréninku začínajících endoskopistů [11]. Doporučení také upozorňují, že před zavedením modelů CADe k běžnému klinickému využití je důležité znát podrobnější informace o jejich vývoji, trénování, kvalitě a množství dat použitých k tréningu a validaci systému, současně by uživatelé měli být informováni o jejich limitacích [10].
Optická diagnostika polypů (CADx – computer-aided diagnosis), schopnost predikce histologie polypu in vivo
Predikce histologie má význam u polypů a plochých lézí tračníku všech velikostí. Většina polypů (až 80 %) nalezených při koloskopickém vyšetření jsou polypy diminutivní (do 5 mm v průměru) a malé (do 9 mm), jejichž neoplastický potenciál je zanedbatelný či nízký. V současné klinické praxi jsou všechny polypy odstraňovány a odesílány k histologickému vyšetření, což ve většině případů nemá zásadní benefit pro pacienta a současně zatěžuje zdravotní systém a zvyšuje finanční náklady, prodlužuje dobu vyšetření a zvyšuje riziko komplikací [3]. S cílem zvýšit cost-efektivitu definovala Americká společnost pro gastrointestinální endoskopii (ASGE) v managementu těchto lézí již v roce 2011 takzvaná PIVI kritéria (Preservation and Incorporation of Valuable endoscopic innovations), v roce 2022 vytvořila SODA kritéria (Simple Optical Diagnosis Accuracy) také evropská ESGE. K zavedení strategie „resect and discard“ (odstraň a histologicky nevyšetřuj) pro diminutivní adenomy do rutinní praxe je třeba dosáhnout v rutinní klinické praxi alespoň 90% shody v určení dispenzárního intervalu po polypektomii mezi optickou diagnózou během výkonu a na základě histologického vyšetření. U strategie „diagnose and leave“ (diagnostikuj a ponech in situ) pro diminutivní hyperplastické polypy rektosigmatu je třeba dosáhnout minimálně 90% negativní prediktivní hodnoty v identifikaci adenomu. ESGE stanovila pro strategii „resect and discard“ jako minimální 80% senzitivitu i specificitu a pro přístup „diagnose and leave“ 90% senzitivitu a 80% specificitu [12,13]. Pro přijetí optické diagnostiky diminutivních polypů pomocí AI (CADx – computer-aided diagnosis) by měla AI samozřejmě dosahovat minimálně hodnot výše uvedených strategií [3].
Optická diagnostika polypů se opírá především o metody virtuální chromoendoskopie (NBI, BLI), využívána je také zvětšující endoskopie (nejčastěji ve formě optického „near focus“). Endocytoskopie, konfokální laserová endomikroskopie a autofluorescenční endoskopie jsou využívány spíše raritně [14]. Přesnost predikce histologie je mezi jednotlivými gastroenterology významně variabilní. Zkušení intervenční endoskopisté jsou schopni spolu s využitím pokročilých zobrazovacích technik a endoskopů s vysokým rozlišením predikovat histologii polypu s vysokou přesností. Na druhou stranu mnoho endoskopistů postrádá stále v optické diagnostice dostatečnou jistotu a rutinu.
V letošním roce byla publikována metaanalýza jedenácti studií, která hodnotila přesnost CADx u polypů velikosti do 5 mm v rektosigmatu a zbytku tračníku. Specificita a přesnost CADx byla významně nižší v proximální části tračníku (specificita 62 vs. 85 % v rektosigmatu a přesnost 81 vs. 86 % v rektosigmatu) [15]. Další metaanalýza deseti studií se zaměřila na zhodnocení strategie „diagnose and leave“ [16]. Primárním výstupem byl podíl polypů určených modelem CADx jako nenádorové, a tudíž možné ponechat in situ, a naopak, kolik polypů bylo CADx označeno jako falešně neoplastických, a tudíž odstraněných zbytečně. Jako zlatý standard sloužilo histologické vyšetření. Podíl zbytečně odstraněných non-neoplastických polypů byl podobný jak u CADx asistovaných, tak i neasistovaných vyšetření (58,4 vs. 55,4 %), podíl neoplastických lézí, které nebyly správně označeny, byl v obou skupinách stejný (8 %). Studií se však účastnili lékaři s vysokou spolehlivostí v optické diagnostice (s více než 91% senzitivitou i specificitou). Skutečný diagnostický přínos techniky CADx u diminutivních polypů rektosigmatu tak zůstává nejistý a do budoucna by se studie měly zaměřit také na méně zkušené endoskopisty. Několik metaanalýz s využitím CADx prokázalo zlepšení optické diagnózy u non-expertních endoskopistů, zatímco u zkušených endoskopistů (kteří jsou ve studiích definováni různě – většinou dle počtu provedených koloskopií nebo hodnoty ADR) ke zlepšení histologické predikce nedošlo, což lze na základě jejich dlouhodobých zkušeností a znalostí očekávat [17]. Autoři metaanalýzy upozorňují také na rozdílné výkony různých CADx modelů, některé nepřesáhly 80% hranici vyžadovanou pro uplatnění strategie „diagnose and leave“ [16]. Toto zjištění znovu zvýrazňuje význam kvality trénování a nutnosti standardizace těchto zásadních fází tvorby systémů AI.
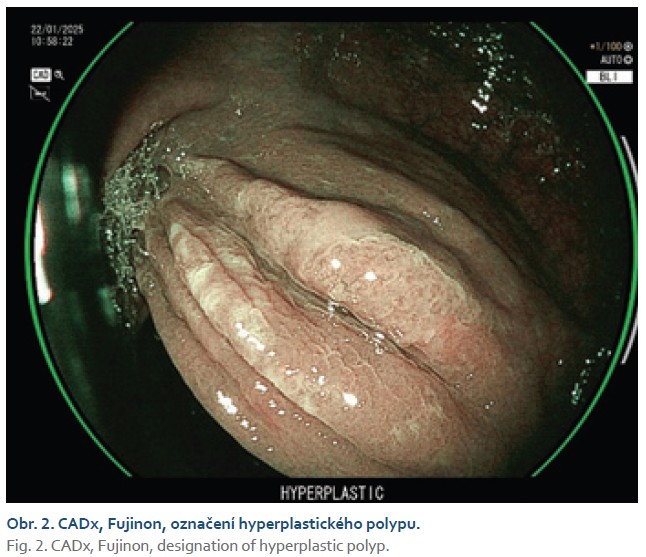
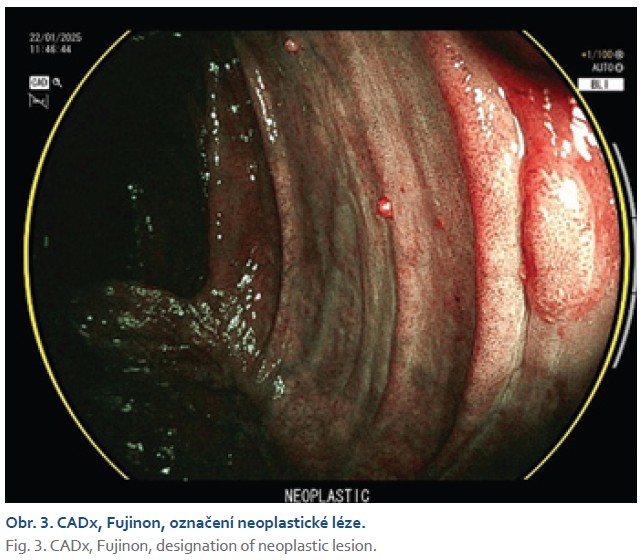
Zajímavá je práce, která srovnávala predikci histologie dvou komerčně dostupných CADx systémů trénovaných na odlišných datasetech, kdy negativní prediktivní hodnota u diminutivních polypů rektosigmatu u obou dosahovala kritéria pro strategii „diagnose and leave“ [17]. Současné modely danou lézi označují adenom/non-adenom a nejsou schopny rozlišit jiné typy polypů, např. pilovitou lézi (obr. 2, 3).
Hloubka submukózní invaze
Relativně nižší pozornost se dosud věnovala schopnosti AI predikovat hloubku submukózní invaze u časných karcinomů tračníku a z toho plynoucí šance přesnějšího posouzení možnosti kurativního odstranění léze endoskopickou technikou (endoskopickou slizniční resekcí, submukózní disekcí, full-thickness resekcí) nebo chirurgickým přístupem [14]. Senzitivita rozlišení T1 léze v plochých neoplastických lézích v endoskopické komunitě se pohybuje mezi 25 a 54 % [18]. První AI studie využívaly konfokální laserovou endomikroskopii a endocytoskopii čili techniky v rutinní praxi nepoužívané. Později se objevují práce využívající zvětšující endoskopii a virtuální chromoendoskopii, s možností klasifikovat neoplastickou lézi dle NICE (Narrow band imaging International Colorectal Endoscopic classification) či JNET (Japan NBI expert team), nicméně systémy převážně pracují se statickými obrázky, takže je nelze použít při rozhodování v reálném čase. Dosahují senzitivity 58,8–96,7 % a specificity 75,0–94,4 %. Ve většině studií však diagnostická přesnost rozhodně nepřesáhla přesnost zkušených endoskopistů [19]. V roce 2023 hodnotili čínští autoři třináct poměrně heterogenních, převážně asijských retrospektivních studií prováděných v rámci jednoho centra s obdobným závěrem. Některé z testovaných modelů AI umožňují méně zkušeným endoskopistům charakterizovat polypy s podobnou přesností, které dosahují zkušení intervenční endoskopisté, a vést tak k výběru vhodné resekční techniky. Dosud vyvinuté modely však ještě z výše uvedených důvodů nelze zařadit do běžné klinické praxe [20]. Do budoucna má AI v této oblasti potenciál správně referovat léze intervenčním koloskopistům či chirurgům, navíc bude v případě endoskopické resekce možné vynechat biopsii, která vede k fibrotizaci a může následný endoskopický výkon významně komplikovat [17].
Idiopatické střevní záněty
Přestože první studie hodnotící zánětlivou aktivitu u ulcerózní kolitidy pomocí AI proběhla již v roce 2003, není postavení AI v klinické praxi managementu IBD (inflammatory bowel disease) dosud definováno [21]. Výzkum zabývající se použitím AI při koloskopii u idiopatických střevních zánětů se věnuje několika oblastem: stanovení diagnózy IBD, určení zánětlivé aktivity onemocnění, monitorování odpovědi na léčbu (zde by měla v probíhajících klinických studiích AI potenciál nahradit centrální hodnocení) a identifikace dysplazie a neoplastických lézí. Většina modelů AI v oblasti IBD se zaměřuje na objektivní zhodnocení zánětu a slizničního zhojení ulcerózní kolitidy, což má význam při spolurozhodování o léčebném postupu. U ulcerózní kolitidy je nejčastěji používáno endoskopické Mayo subskóre (MES) nebo Ulcerative Colitis Endoscopic Index of Severity (UCEIS), aktivitu terminální ileitidy u Crohnovy choroby hodnotíme pomocí Rutgeertsova skóre [22]. Bylo prokázáno, že hodnocení zánětlivé aktivity IBD mezi jednotlivými endo- skopisty vykazuje významnou variabilitu – např. ve studii portugalských autorů vzájemná shoda mezi 58 lékaři pro MES byla 0,47 a pro Rutgeertsovo skóre 0,33 [23]. K řešení tohoto problému s cílem minimalizovat variabilitu v hodnocení mezi jednotlivými lékaři byly vytvořeny AI modely, které rozliší slizniční zhojení (MES 0,1) proti vysoké aktivitě zánětu (MES 2,3) s 94,5% přesností; 84,6% senzitivitou a 96,9% specificitou [24]. Nejvyšší diagnostická přesnost byla docílena u MES 3 (vysoká aktivita) a MES 0 (kompletní endoskopická remise), naopak rozlišení mírné a střední aktivity bylo nedostatečné. Vysvětlením může být to, že algoritmy AI jsou trénovány na datech anotovaných lékaři, a proto jejich výstupy odráží nedostatky vstupních informací [22]. Do budoucna by však mohla být AI užitečným nástrojem pro zlepšení hodnocení aktivity zánětlivých střevních nemocí a ke snížení variability hodnocení aktivity kolitidy mezi endoskopisty.
Další uplatnění AI u IBD se soustředí na usnadnění stanovení diagnózy idiopatického střevního zánětu, případně na diferenciální diagnostiku ulcerózní kolitidy a Crohnovy choroby. Ve studii autorů z Velké Británie byly vytvořeny tři modely AI hodnotící endoskopický nález, histologický nález a kombinaci těchto dvou nálezů s přesností 71 %, 76,9 % a 82,7 %. Následně byl kombinovaný model testován na 48 dětech s diagnózou IBD, který správně klasifikoval až 83,3 % nemocných. O něco úspěšnější byl systém AI, který pracuje s konfokální laserovou endomikroskopií. V rozlišení Crohnovy choroby a ulcerózní kolitidy dosáhl senzitivity 92,3 % a specificity 91,3 % [25]. V každém případě se jedná o modely experimentální a jejich cesta ke klinickému využití bude pravděpodobně ještě dlouhá.
Nemocní s extenzivní formou ulcerózní kolitidy nebo Crohnovy choroby postihující tlusté střevo s trváním delším než 8–10 let mají zvýšené riziko vzniku IBD asociované dysplazie a kolorektálního karcinomu. Dalšími rizikovými faktory jsou stenóza tračníku, současná primární sklerozující cholangitida či rodinná anamnéza kolorektálního karcinomu. Detekovat kolorektální neoplazie v terénu IBD je náročné z důvodu současně přítomných zánětlivých změn, pozánětlivých polypů i jizvení po proběhlém zánětu a také z hlediska morfologie léze (která je obvykle plochá a její okraje jsou obtížně odlišitelné od okolní sliznice). Ačkoli při použití AI v preventivní či dispenzární koloskopii dominuje detekce a optická diagnostika polypů, u IBD nemocných je tomu právě naopak. Současná data pocházejí pouze z kazuistických sdělení a studií s nízkými počty nemocných, k vytvoření doporučených postupů je třeba dalších prospektivních multicentrických studií [20]. Prevalence makroskopicky viditelných lézí je nízká, proto je náročné pro trénování umělé inteligence nasbírat dostatečné množství obrazových dat. Jeden z IBD specifických CADe systémů prokázal přesnost detekce 96,8 % v bílém světle, při použití chromoendoskopie se přesnost snížila na 77,8 %, limitací je, že tento model byl trénován na statických obrázcích [26].
Hodnocení indikátorů kvality koloskopie
Odborné společnosti pro gastrointestinální endoskopii publikovaly doporučení týkající se indikátorů kvality koloskopického vyšetření, mezi které patří mimo jiné kvalita střevní přípravy, měření vysouvacího času, ADR či procento dosažení dna céka [27]. I v této oblasti probíhá výzkum vlivu AI na sledované parametry. Klinické studie prokázaly, že nedostatečná očista tračníku může vést k přehlédnutí až 42 % adenomů [28]. Hodnocení kvality přípravy endoskopisty je však subjektivní a interindividuálně variabilní i při užívání validovaných škál, nejčastěji Boston Bowel Preparation Scale (BBPS). Jsou proto vyvíjeny systémy AI, které automaticky zhodnotí kvalitu očisty (po opláchnutí sliznice) a několik studií potvrdilo, že tyto modely dosahují vysoké přesnosti. Ta dosahovala po tréninku na statických endoskopických obrázcích až 95,3 %. Pokud však byly modely AI použity při vyhodnocení vyšetření v reálném čase, přesnost klesla k 89 % [29]. Nicméně AI by mohla vyšetřujícího lékaře upozornit na oblasti sliznice, které nebyly z důvodu nekvalitní očisty dostatečně prohlédnuty, a doporučit dočištění. Toho lze rovněž využít při tréninku začínajících endoskopistů. Procento vizualizované sliznice souvisí s vysouvacím časem výkonu a koreluje s ADR a rizikem vzniku intervalového karcinomu. Podle doporučených postupů by vysouvací čas výkonu neměl být kratší než 6 minut. V roce 2012 byl na pouhých čtrnácti vyšetřeních vyzkoušen AI systém vyhodnocující procento vysouvacího času s adekvátní vizualizací (hodnocena byla jasnost obrazu, rychlost vysouvání přístroje a kvalita očisty tračníku) [30]. Hodnocení AI a zkušeného endoskopisty bylo v souladu. Další systémy AI automaticky detekují ústí appendixu či ileocékální chlopeň jako důkaz kompletního vyšetření tračníku s přesností 85,7 %, resp. 91,3 % [31].
Umělá inteligence a endoskopisté
Průzkum provedený mezi 124 gastroenterology v USA v letech 2018 a 2019 ukázal, že většina z nich projevila zájem o použití AI v koloskopii (86 %) a domnívala se, že CADe může zlepšit jejich endoskopický výkon (84,7 %), ale existovaly obavy z nákladů (75,2 %), závislosti lékaře a ztráty zkušenosti v důsledku přílišného spoléhání se na AI (62,8 %) a prodloužení doby výkonu (60,3 %). Na rozdíl od podpory CADe souhlasilo pouze 57,2 % respondentů s použitím CADx k podpoře strategie „diagnose and leave“ u hyperplastických polypů. Začínající endoskopisté podporovali užití CADx více. Tyto údaje byly získány od endoskopistů, kteří s AI modely ještě nepracovali [32]. Ideálně povede interakce mezi AI a vyšetřujícím lékařem ke zlepšení kvality koloskopie podporou rozhodování lékaře. Nevýhodou mohou být četná falešně pozitivní upozornění systému AI na přítomnost polypu (z důvodu nízké specificity) vedoucí k tomu, že endoskopista návrhy AI nesleduje a následně systematicky nerespektuje. Naopak se vyšetřující může na výstupy a závěry AI až nekriticky spoléhat, a vyloučit tak vlastní znalosti a zkušenost [33]. Budoucí výzkum by se mohl zaměřit i na interakce různých skupin endoskopistů s AI, přičemž roli mohou hrát nejen jejich odborné zkušenosti, ale také individuální psychosociální charakteristiky.
Umělá inteligence a finanční hledisko
V současné době jsou k dispozici komerčně vyráběné systémy AI převážně využívané v terciárních centrech. Pro jejich větší rozšíření do běžné klinické praxe je nicméně třeba zohlednit i komplexní finanční hledisko, a to nejen ve smyslu pořizovací ceny systému. Existují studie zabývající se úsporami nákladů – např. použití CADx systému při využití strategie „leave-in-situ“. Průměrné snížení nákladů na jedno koloskopické vyšetření se odhaduje na $119 (Japonsko), $52 (Velká Británie), $34 (Norsko) a $125 (USA) [34]. Další modelová studie z USA odhaduje redukci nákladů při využití CADe v rámci screeningového koloskopického programu – redukce incidence kolorektálního karcinomu o 4,8 % a mortality o 3,6 % a snížení nákladů na pacienta o $57. Ročně by tak bylo dosaženo v populaci USA úspory $300 milionů [35]. Na druhou stranu jsou všechna tato data vzhledem ke specifickým podmínkám českého zdravotnictví pouze obtížně přenositelné do tuzemských podmínek.
Zavedení AI do klinické praxe má několik omezení. Především je to heterogenita dat užitých k tréninku a validaci jednotlivých AI systémů. Americká společnost pro gastrointestinální endoskopii (ASGE) proto navrhuje vytvořit a spravovat profesionální knihovnu kvalitních a ověřených dat. Je nutné překonat také regulační překážky a vyřešit právní začlenění AI. V roce 2021 zveřejnil úřad FDA „Akční plán pro software jako zdravotnický prostředek založený na umělé inteligenci/strojovém učení (AI/ML) “. V tomto plánu je uvedena povinnost výrobce identifikovat jasně data použitá k tréninku algoritmu, použitou logiku, úlohu. Tyto informace mají sloužit jako důkaz o výkonnosti modelu [36].
Závěr
Umělá inteligence představuje významný nástroj pro podporu kvality koloskopických vyšetření, zejména v oblasti detekce adenomů (CADe), optické diagnostiky polypů (CADx), hodnocení aktivity idiopatických střevních zánětů a posuzování indikátorů kvality výkonu. Největší přínos AI se zatím prokázal u méně zkušených endoskopistů, kde může přispět ke snížení variability v kvalitě provedení výkonu.
Zatímco systémy CADe již nacházejí uplatnění v klinické praxi, CADx zůstává převážně v experimentální fázi – zejména kvůli nejednotné kvalitě tréninkových dat, nedostatečné specifitě v proximálním tračníku a obavám z nadbytečných intervencí. U idiopatických střevních zánětů lze očekávat, že AI pomůže zlepšit objektivitu a reprodukovatelnost hodnocení endoskopického nálezu, přičemž další rozvoj vyžaduje rozsáhlejší validované studie. Otázkou zůstává i klinický dopad na dlouhodobé parametry – např. výskyt intervalového karcinomu, změny dispenzárních intervalů a skutečný přínos pro pacienty.
Praktické využití AI v běžné praxi je dále limitováno náklady, dostupností systémů a potřebou hlubší informovanosti ze strany zdravotníků. AI by měla být vnímána jako podpůrný nástroj lékaře, nikoli jako jeho náhrada. Budoucí výzkum by měl zohlednit nejen technologické aspekty, ale i interakci AI s uživatelem, včetně jeho odborných a psychosociálních charakteristik. Důraz by měl být kladen také na transparentnost vývoje, dostupnost datových knihoven a jednotná regulační pravidla.
ORCID autora
I. Tachecí 0000-0003-3583-2651.
Doručeno/Submitted: 22. 7. 2024
Přijato/Accepted: 20. 5. 2025
Korespondenční autorka
MUDr. Dana Zimandlová
II. interní gastroenterologická klinika
LF HK UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
dana.zimandlova@fnhk.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Spadaccini M, Massimi D, Mori Y et al. Artificial intelligence-aided endoscopy and colorectal cancer screening. Diagnostics 2023; 13(6): 1102. doi: 10.3390/diagnostics13061102.
2. Biamonte P, Damico F, Fasulo E et al. New technologies in digestive endoscopy for ulcerative colitis patients. Biomedicines 2023; 11(8): 2139. doi: 10.3390/biomedicines11082139.
3. Messmann H, Bisschops R, Antonelli G et al. Expected value of artificial intelligence in gastrointestinal endoscopy: European Society of Gastrointestinal Endoscopy (ESGE) Position Statement. Endoscopy 2022; 54(12): 1211–1231. doi: 10.1055/a-1950-5694.
4. Urban G, Tripathi P, Alkayali T et al. Deep learning localizes and identifies polyps in real time with 96% accuracy in screening colonoscopy. Gastroenterology 2018; 155(4): 1069.e8–1078.e8. doi: 10.1053/j.gastro.2018.06.037.
5. Taghiakbari M, Mori Y, von Renteln D. Artificial intelligence-assisted colonoscopy: a review of current state of practice and research. World J Gastroenterol 2021; 27(47): 8103–8122. doi: 10.3748/wjg.v27.i47.8103.
6. Soleymanjahi S, Huebner J, Elmansy L et al. Artificial intelligence.assisted colonoscopy for polyp detection. Ann Intern Med 2024; 177(12): 1652–1663. doi: 10.7326/ANNALS-24-00981.
7. Hassan C, Spadaccini M, Mori Y et al. Real-time computer-aided detection of colorectal neoplasia during colonoscopy: a systematic review and meta-analysis. Ann Intern Med 2023; 176(9): 1209–1220. doi: 10.7326/M22-3678.
8. Berzin TM, Parasa S, Wallace MB et al. Position statement on priorities for artificial intelligence in GI endoscopy: a report by the ASGE Task Force. Gastrointest Endosc 2020; 92(4): 951–959. doi: 10.1016/j.gie.2020.06.035.
9. Bretthauer M, Ahmed J, Antonelli G et al. Use of computer-assisted detection (CADe) colonoscopy in colorectal cancer screening and surveillance: ESGE position statement. Endoscopy 2025. doi: 10.1055/a-2543-0370. In press.
10. Sultan S, Shung DL, Kolb JM et al. AGA living clinical practice guideline on computer-aided detection assisted colonoscopy. Gastroenterology 2025; 168(4): 691–700. doi: 10.1053/j.gastro.2025.01.002.
11. Falt P, Cyrany J, Kunovský L et al. Doporučené postupy České gastroenterologické společnosti ČLS JEP pro diagnostickou a terapeutickou koloskopii – aktualizované vydání 2024. Gastroent Hepatol 2024; 78(3): 197–235. doi: 10.48095/ccgh2024197.
12. Houwen BBSL, Hassan C, Coupé VMH et al. Definition of competence standards for optical diagnosis of diminutive colorectal polyps: European Society of Gastrointestinal Endoscopy (ESGE) Position Statement. Endoscopy 2022; 54(1): 88–99. doi: 10.1055/a-1689-5130.
13. Hossain E, Abdelrahim M, Tanasescu A et al. Performance of a novel computer-aided diagnosis system in the characterization of colorectal polyps, and its role in meeting Preservation and Incorporation of Valuable Endoscopic Innovations standards set by the American Society of Gastrointestinal Endoscopy. DEN Open 2023; 3(1): e178. doi: 10.1002/deo2.178.
14. Young EJ, Rajandran A, Philpott HL et al. Mucosal imaging in colon polyps: new advances and what the future may hold. World J Gastroenterol 2022; 28(47): 6632–6661. doi: 10.3748/wjg.v28.i47.6632.
15. Rizkala T, Hassan C, Mori Y et al. Accuracy of computer -aided diagnosis in colonoscopy varies according to polyp location: a systematic review and meta-analysis. Clin Gastroenterol Hepatol 2025; 23(4): 531–541. doi: 10.1016/j.cgh.2024.08.021.
16. Hassan C, Misawa M, Rizkala T et al. Computer-aided diagnosis for colorectal polyps in situ. Ann Intern Med 2024; 177(7): 919–928. doi: 10.7326/M23-2865.
17. Young E, Edwards L, Singh R. The role of artifical intelligence in colorectal cancer screening: lesion detection and lesion characterization. Cancers 2023; 15(21): 5126. doi: 10.3390/cancers152115126.
18. Thijssen A, Schreuder RM, Dehghani N et al. Improving the endoscopic recognition of early colorectal carcinoma using artificial intelligence: current evidence and future directions. Endosc Int Open 2024: 12(10): E1102–E1117. doi: 10.1055/a-2403-3103.
19. Ichimasa K, Kudo S, Misawa M et al. Role of artificial intelligence in the management of T1 colorectal cancer. Dig Liver Dis 2024; 56(7): 1144–1147. doi: 10.1016/j.dld.2024.01.202.
20. Bai J, Liu K, Gao L et al. Computer-aided diagnosis in predicting the invasion depth of early colorectal cancer: a systematic review and meta-analysis of diagnostic test accuracy. Surg Endosc 2023; 37(9): 6627–6639. doi: 10.1007/s00464-023-10223-6.
21. Pal P, Pooja K, Nabi Z et al. Artificial intelligence in endoscopy related to inflammatory bowel disease: a systematic review. Indian J Gastroenterol 2024; 43(1): 172–187. doi: 10.1007/s12664-024-01531-3.
22. Yang LS, Perry E, Shan L et al. Clinical application and diagnostic accuracy of artificial intelligence in colonoscopy for inflammatory bowel disease: systematic review. Endosc Int Open 2022; 10(7): E1004–E1013. doi: 10.1055/ a-1846-0642.
23. Fernandes SR, Pinto JSLD, da Costa PM et al. Disagreement among gastroenterologists using the Mayo and Rutgeerts Endoscopic Scores. Inflamm Bowel Dis 2018; 24(2): 254–260. doi: 10.1093/ibd/izx066.
24. Huang TY, Zhan SQ, Chen PJ et al. Accurate diagnosis of endoscopic mucosal healing in ulcerative colitis using deep learning and machine learning. J Chin Med Assoc 2021; 84(7): 678–681. doi: 10.1097/JCMA.0000000000000559.
25. Solitano V, Zilli A, Franchelucci G et al. Artificial endoscopy and inflammatory bowel disease: welcome to the future. J Clin Med 2022; 11(3): 569. doi: 10.3390/jcm11030569.
26. Vinsard DG, Fetzer JR, Agrawal U et al. Development of an artificial intelligence tool for detecting colorectal lesions in iflammatory bowel disease. Innovations 2023; 2(2): 91–101. doi: 10.1016/j.igie.2023.03.004.
27. Rex DK, Schoenfeld PS, Cohen J et al. Quality indicators for colonoscopy. Gastrointest Endosc 2015; 81(1): 31–53. doi: 10.1016/j.gie.2014.07.058.
28. Lebwohl B, Kastrinos F, Gllick M et al. The impact of suboptimal bowel preparation on adenoma miss rates and the factors associated with early repeat colonoscopy. Gastrointest Endosc 2011; 73(6): 1207–1214. doi: 10.1016/j.gie.2011.01.051.
29. Zhou J, Wu L, Wan X et al. A novel artifical intelligence system for the assessment of bowel preparation (with video). Gastrointes Endosc 2020; 91(2): 428.e2–435.e2. doi: 10.1016/j.gie.2019.11.026.
30. Filip D, Gao X, Angulo-Rodriguéz L et al. Colometer: a real-time quality feedback system for screening colonoscopy. World J Gastroenterol 2012; 18(32): 4270–4277. doi: 10.3748/wjg.v18.i32.4270.
31. Taghiakbari M, Mori Y, von Renteln D. Artificial intelligence-assisted colonoscopy: a review of current state of practice and research. World J Gastroenterol 2021; 27(47): 8103–8122. doi: 10.3748/wjg.v27.i47.8103.
32. Tham S, Koh FH, Ladlad J et al. The imitation game: a review of the use of artificial intelligence in colonoscopy, and endoscopists perception thereof. Ann Coloproctol 2023; 39(5): 385–394. doi: 10.3393/ac.2022.00878.0125.
33. Antonelli G, Rizkala T, Lacopini F et al. Current and future implications of artificial intelligence in colonoscopy. Ann Gastroenterol 2023; 36(2): 114–122. doi: 10.20524/aog. 2023.0781.
34. Mori Y, Kudo SE, East JE et al. Cost savings in colonoscopy with artificial intelligence-aided polyp diagnosis: an add-on analysis of a clinical trial. Gastrointest Endosc 2020; 92(4): 905.e1–911.e1. doi: 10.1016/j.gie.2020.03.3759.
35. Areia M, Mori Y, Correale L et al. Cost-effectiveness of artificial intelligence for screening colonoscopy: a modelling study. Lancet Digit Health 2022; 4(6): e436–e444. doi: 10.1016/S2589-7500(22)00042-5.
36. Berzin TM, Parasa S, Wallace MB et al. Postion statement on priorities for artificial intelligence in GI endoscopy: a report by the ASGE Task Force. Gastrointest Endosc 2020; 92(4): 951–959. doi: 10.1016/j.gie.2020.06.035.