Vícenásobná endosonograficky navigovaná drenáž ohraničené pankreatické nekrózy – kazuistika
Iva Rennétová1, Jiřina Pintová Orcid.org 2
+ Pracoviště
Souhrn
Akutní pankreatitida je zánětlivé onemocnění slinivky břišní. Ve většině případů probíhá v lehké formě se spontánní regresí, avšak u části pacientů dochází k rozvoji těžké nekrotické pankreatitidy. Cílem kazuistiky je ukázat možnosti intervenční léčby peripankreatických tekutinových kolekcí, které vznikají jako komplikace akutní pankreatitidy. Popisujeme případ 41letého muže s biliární pankreatitidou, u něhož došlo k rozvoji vícečetných infikovaných ohraničených nekróz (WON). Po selhání konzervativní léčby byla provedena endosonograficky (EUS) navigovaná drenáž tří dominantních kolekcí tzv. multiple transluminal gateway technikou (MTGT) se zavedením lumen apozičních metalických stentů (LAMS). Pro nedostatečnou klinickou odezvu na drenáž následovala endoskopická nekrektomie za použití zařízení EndoRotor umožňujícího jednodušší odstranění nekrotických hmot. Terapie vedla k postupné regresi kolekcí, klinické stabilizaci a úplnému zotavení pacienta. Zvolený postup odpovídá konceptu „step-up-approach“, kdy se v léčbě postupuje od méně invazivních metod k invazivnějším. Metoda MTGT se osvědčuje zejména u vícečetných nebo rozsáhlých kolekcí, kde jednovstupový přístup není dostatečný, což potvrzuje i referovaná kazuistika.
Klíčová slova
endoskopická drenáž, lumen apoziční metalický stent, ohraničená pankreatická nekróza, pankreatická tekutinová kolekce
Úvod
Akutní pankreatitida je zánětlivé onemocnění postihující slinivku. Tento stav je nejběžnějším onemocněním tohoto orgánu a zároveň jde o jednu z nejčastějších gastrointestinálních chorob vyžadujících hospitalizaci [1]. Akutní pankreatitida probíhá u většiny nemocných v lehké formě, v 10–20 % však dochází k rozvoji těžké nekrotické pankreatitidy. Přestože byly zavedeny nové postupy v léčbě komplikujících pankreatických tekutinových kolekcí, těžká akutní pankreatitida je stále spojena s vysokou úmrtností.
V závislosti na tíži onemocnění se u části nemocných vyvinou systémové nebo lokální komplikace či kombinace obojího. Pro účely tohoto článku jsou zmíněny lokální komplikace, tzv. peripankreatické tekutinové kolekce (PFC). Podle revidované Atlantské klasifikace z roku 2012 se rozdělují podle vývoje v čase a přítomnosti nekrózy na akutní peripankreatickou tekutinovou kolekci, akutní nekrotickou kolekci, pseudocystu a ohraničenou pankreatickou nekrózu (WON – walled-off necrosis) [2].
Cílem intervenční léčby tekutinových kolekcí je jejich drenáž, v případě nekrózy se může přistoupit k odstranění nekrotického materiálu neboli nekrektomii (debridementu). K endoskopické drenáži je vhodná kolekce ohraničená, k čemuž většinou dochází za 4 týdny od vzniku pankreatitidy. Ohraničeným kolekcím odpovídá pseudocysta a WON. Intervenci vyžadují symptomatické kolekce. Mohou se projevovat nově vzniklými nebo zhoršenými bolestmi břicha, poruchou pasáže a neprospíváním při lokálním útlaku trávicího traktu kolekcí. Dále se drénují infikované kolekce projevující se febriliemi a příznaky sepse.
Kazuistika
V kazuistice je prezentován případ muže (41 let) přijatého na jednotku intenzivní péče chirurgického oddělení pro několikadenní bolesti břicha lokalizované do epigastria, které vznikly po dietní chybě. Diagnostikována byla akutní biliární pankreatitida. V osobní anamnéze nebyla přítomna žádná chronická onemocnění ani medikace, pacient udával příležitostnou konzumaci alkoholu a kouření cca 10 cigaret denně.
Abdominální ultrazvukové vyšetření prokázalo dilataci extra- i intrahepatálních žlučových cest, ve žlučníku byla přítomna četná litiáza. Tento nález byl doprovázen laboratorními známkami obstrukčního ikteru. Druhý den následovala endoskopická retrográdní cholangiopankreatografie (ERCP) s papilotomií a revizí žlučových cest bez průkazu choledocholitiázy. Pacient nebyl stentován. Po výkonu byl klinicky stabilní, bez bolestí břicha, laboratorně došlo k poklesu cholestatických a pankreatických enzymů. Devátý den došlo k recidivě bolestí břicha a febriliím. Následně se provedlo CT břicha s nálezem pankreatitidy Balthazar D. Hemokultury i ostatní kultivace byly negativní, avšak laboratorně dominovala leukocytóza a elevovaný prokalcitonin. Proto byla nasazena antibiotické terapie s dobrým klinickým efektem.
Čtrnáctý den se klinický stav pacienta opět zhoršil. Laboratorně bylo výrazně zvýšené CRP a přetrvávala leukocytóza. CT restaging prokázal progresi pankreatitidy do stadia Balthazar E. Během dalších 14 dnů klinický stav pacienta unduloval v závislosti na změnách antibiotické terapie, s přechodnými obdobími stabilizace a opakovanou eskalací septických projevů.
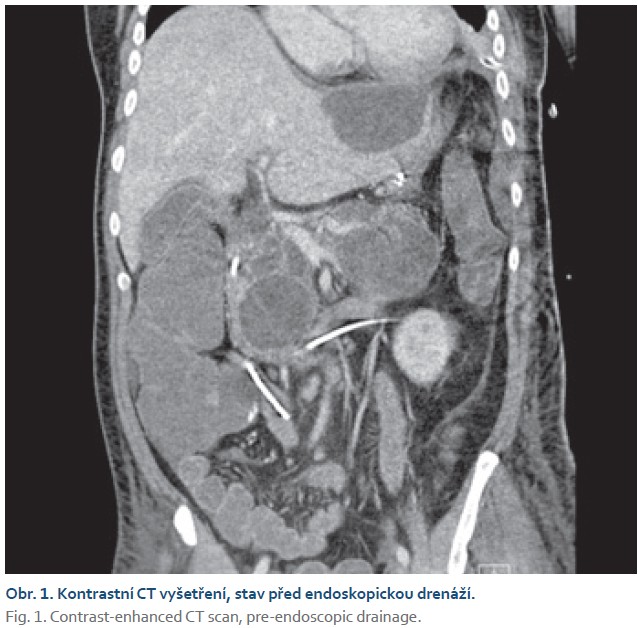
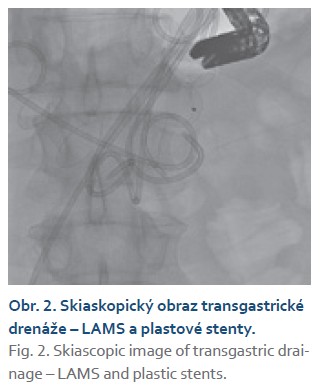
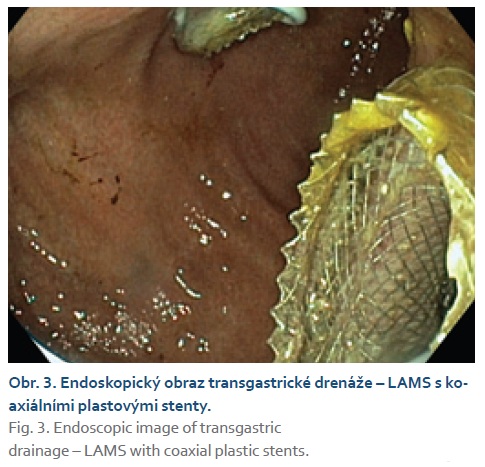
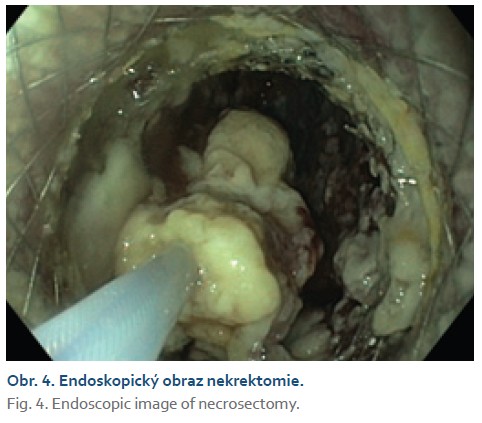
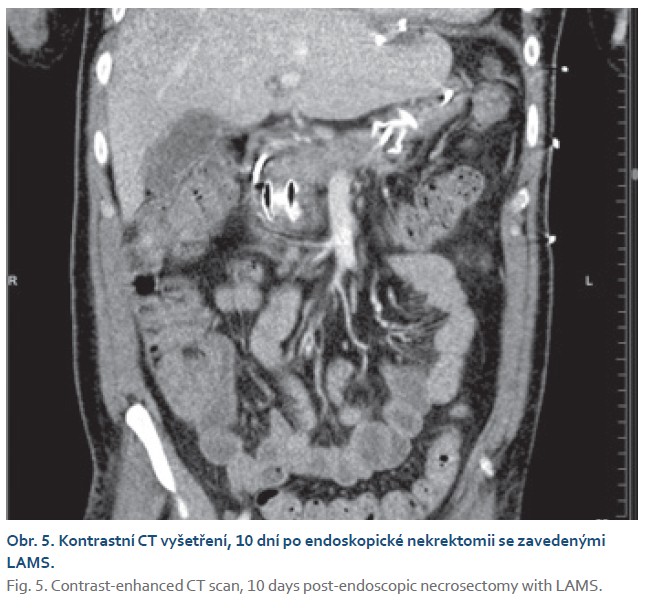
Dvacátý pátý den došlo k náhlému zhoršení stavu s hyposaturací, na RTG plic byla prokázána levostranná bronchopneumonie. Pacient byl přeložen na ARO a od 27. dne ventilován pro vyčerpání. Pro trvající septický stav bylo 29. den provedeno CT břicha. CT zobrazilo kolekce charakteru WON velikostně 6–10 cm podél levého laloku jater, při těle pankreatu a v levém mezogastriu. V CT obraze byly všechny kolekce infikované s přítomností plynu a vzájemně spolu nekomunikovaly (obr. 1). Byla indikována EUS navigovaná drenáž každé kolekce zvlášť, tzv. multiple transluminal gateway technikou. Při drenáži vytékal z dutin hnisavý obsah. K drenáži byly použity LAMS stenty typu HOT Axios a koaxiální plastové stenty jako prevence obturace LAMS (obr. 2, 3). Po intervenci došlo k poklesu zánětlivých markerů. Čtyřicátý den bylo pro přetrvávající febrilie provedeno kontrolní CT, které ukázalo pouze částečnou regresi kolekcí. Následovala přímá endoskopická nekrektomie všech tří kolekcí pomocí systému EndoRotor (obr. 4). Nekrózy byly téměř kompletně odstraněny, do původních LAMS byly znovuzavedeny koaxiální plastové stenty. Antibiotická terapie byla ukončena (obr. 5). Padesátý osmý den byly extrahovány všechny stenty. Stav pacienta se již dále nekomplikoval, zahájil se weaning.
Šedesátý třetí den byl pacient přeložen k rehabilitaci a realimentaci na oddělení následné intenzivní péče. Do domácí péče byl propuštěn po 3 měsících od přijetí. Kontrolní CT provedené 4 měsíce od začátku obtíží potvrdilo kompletní regresi všech kolekcí. Jedenáct měsíců od začátku onemocnění pacient podstoupil elektivní cholecystektomii.
Diskuze
Metodou první volby v diagnostice lokálních komplikací akutní pankreatitidy je kontrastní CT vyšetření. U pacientů s kontraindikací podání kontrastní látky je variantou magnetická rezonance (MR). CT je indikováno po více než 72 hod od začátku příznaků k určení tíže pankreatitidy. Další CT vyšetření se opakuje zpravidla za 4 týdny. Tato doba je důležitá z hlediska vývoje kolekce a ke zhodnocení možnosti intervence. V terapeutické rozvaze pak může pomoci i EUS či MR, které lépe rozliší, zda se jedná o WON, či o pseudocystu [3]. Zobrazovací vyšetření dává informaci i o topografii kolekcí, endoskopicky lze drénovat pouze kolekce v těsné blízkosti žaludeční nebo duodenální stěny.
V léčbě infikované pankreatické nekrózy je jednoznačně dávána přednost konzervativním postupům a miniinvazivním metodám před otevřenými chirurgickými výkony. Pokud není endoskopický přístup z anatomických nebo jiných důvodů možný, je indikována perkutánní intervence nebo videoasistovaný retroperitoneální debridement (VARD) [4]. Ve srovnání s „otevřenou“ chirurgií vykazují miniinvazivní techniky nižší výskyt závažných komplikací [5]. Ke klasické chirurgické léčbě se tedy přistupuje pouze v případě, kdy selžou výše uvedené miniinvazivní techniky [4].
Perkutánní drenáž je možné provést i v kombinaci s endoskopickým přístupem, tzv. dual-modality approach. Z této metody profitují pacienti, u nichž se pankreatická kolekce šíří parakolicky či zasahuje do pánve, a endoskopická drenáž je tudíž nedostatečná. Nevýhodou perkutánní drenáže je možnost vzniku pankreatokutánní píštěle [6].
Způsob, jímž se postupuje od metod méně invazivních k metodám více invazivním, se nazývá „step-up-approach“. Ačkoli ve studiích srovnávajících endoskopický a mikrochirurgický step-up přístup nebyl významný rozdíl v mortalitě, ve skupině pacientů léčených endoskopicky byl nižší výskyt závažných komplikací a kratší doba hospitalizace [7,8].
Metodou první volby je EUS navigovaná transmurální drenáž, která je jednoznačně technicky úspěšnější než v minulosti hojně využívaná konvenční transmurální drenáž, tzv. blind access, a úměrně s dostupností endosonografie ji zcela nahradila [9,10]. Ač citované studie zahrnovaly pouze pacienty s pankreatickými pseudocystami, lze výsledky dle ESGE doporučení zobecnit i na pacienty s WON [3]. Samotná EUS navigovaná drenáž může být provedena „klasickou Seldingerovou metodou“, což je výkon o několika po sobě následujících krocích – punkce jehlou, zavedení vodiče, vstup do kolekce pomocí cystotomu, dilatace vzniklého otvoru balonkem a následné zavedení vlastního stentu. Seldingerova metoda je technicky náročný výkon, který s sebou nese vysoké riziko komplikací, jež mohou vyžadovat i chirurgickou revizi.
K dispozici jsou stenty plastové, obvykle se zavádí několik double pigtailových stentů. Zásadním okamžikem bylo v roce 2011 představení lumen apozičních metalických stentů vyvinutých s cílem snadnější a bezpečnější transgastrické a transduodenální drenáže tekutinových kolekcí [11]. Kromě širšího průměru lumen mají krátkou délku a na obou stranách rozšířené okraje ve tvaru nálevky, což zajišťuje přitažení stěn dvou drénovaných struktur. To je zásadní v prevenci jejich malpozice a následné, byť relativně vzácné migrace stentu [12]. Silikonový potah na povrchu stentu brání vzniku leaku. Zavádění první generace LAMS vyžadovalo postup ve více krocích Seldingerovou metodou. Nová generace stentů používaná od roku 2015 má v zaváděcím systému zabudovanou elektrokauterizační jednotku umožňující jednokrokové zavedení stentu, tzv. electrocautery-enhanced lumen apposing metal stent (ECE-LAMS). Po iniciální punkci drénované struktury elektrokauterizačním koncem stentu, který nahrazuje cystotom, je přímo zaveden adjustovaný stent do drénované struktury. Distální konec stentu je rozvinut pod EUS kontrolou a proximální pod endoskopickou nebo EUS kontrolou [13]. Na výběr je více variant délek a průměrů. Volba typu stentu závisí na velikosti interpozita a charakteru drénované kolekce. Výhodou širšího lumen je, že odpadá nutnost extrakce stentu při nekrektomii. Bylo provedeno mnoho studií srovnávajících terapeutickou úspěšnost drenáže plastovými a metalickými stenty. Systematický přehled 17 studií ukázal, že neexistuje rozdíl v celkové efektivitě léčby (zahrnující pseudocysty i WON) [14]. Často citovaná studie Bang et al. taktéž neprokázala rozdíl v efektivitě drenáže plastovými nebo LAMS stenty u pacientů s WON. Drenáž LAMS stenty však může být zatížena vyšším rizikem odloženého krvácení z aroze okolních cév [15,16]. I přes tuto skutečnost, vyšší cenu a srovnatelné klinické výsledky jsou LAMS stenty v praxi používanější pro jednoduchost zavedení, schopnost drenáže solidních nekrotických hmot a možnosti provedení nekrektomie cestou metalického stentu [17]. K prevenci nejčastějších nežádoucích účinků LAMS, jako je krvácení či okluze stentu, bylo navrženo použití koaxiálních plastových double pigtailových stentů. Ve prospěch této techniky hovoří studie Vaňka et al. Vykázala nejen významně menší výskyt celkových nežádoucích účinků, ale i nižší frekvenci okluze stentu u pacientů s drénovaným WON a přidaným koaxiálním plastovým stentem [18].
ESGE doporučuje řešit WON jednovstupově. Pokud je však přítomno více kolekcí nebo jedna kolekce > 12 cm, případně při nedostatečné klinické odpovědi na jednovstupovou drenáž, doporučuje se provést drenáž na více místech z žaludku či dvanáctníku tzv. multiple transluminal gateway technikou [3]. Tato technika usnadňuje drenáž nekrotického obsahu WON a snižuje nutnost následných nekrektomií. O této problematice existuje jen málo studií, navíc jich je většina retrospektivních. Nejčastěji citovaná je studie Varadarajulu et al., která zhodnotila léčbu technikou MTGT jako signifikantně úspěšnější, s nižší potřebou následných chirurgických zákroků oproti konvenční technice drenáže [19]. Nedávná italská prospektivní studie Binda et al. taktéž potvrdila vysokou technickou úspěšnost této léčby, bez reziduální nekrózy či rekurence WON během sledování. Limitací je však malý počet zúčastněných pacientů [20].
Někteří pacienti profitují už jen ze samotné drenáže PFC, kdy u nich dojde ke zlepšení klinického stavu a postupné redukci kolekce. U jiných je naopak nutné provést přímou endoskopickou nekrektomii, (DEN), někdy i vícenásobnou. Preferenčně se i v tomto případě řídíme step-up přístupem a DEN provádíme s časovým odstupem po zhodnocení klinické odezvy na předchozí drenáž. Existují však studie, z nichž vyplývá možný benefit DEN provedené ihned po zavedení LAMS v rámci jedné terapeutické procedury. Při DEN v první době byl zjištěn nižší počet reintervencí nutných ke kompletnímu vymizení WON bez signifikantního rozdílu v celkových a periprocedurálních komplikacích oproti odložené DEN [21,22]. K samotnému výkonu se používá terapeutický gastroskop s přímou optikou, jímž se následně zavádí akcesoria potřebná k nekrektomii. Tekutou složku WON lze odsát přímo endoskopem. K extrakci nekróz existuje široké portfolio akcesorií určené primárně k jiným indikacím (bioptické kleště, polypektomické kličky, extrakční síťky atd.) a často je nutná jejich kombinace. Nejen z tohoto důvodu, ale i z nutnosti vícenásobného průchodu endoskopu fistulou při extrakci nekróz je DEN časově náročný výkon, a proto byla vyvinuta nová specializovaná zařízení s cílem zrychlit a zjednodušit tuto proceduru [23]. EndoRotor Powered Endoscopic Debridement, Interscope Medical se zavádí do pracovního kanálu terapeutického přístroje. Zoubkovaný hrot EndoRotoru, který je otočný o 360°, resekuje nekrotickou hmotu a současně ji podtlakem nasává do dutého katétru připojeného na sání do vakuové nádoby. Tato technika se jeví jako bezpečná a účinná ve srovnání s publikovanými údaji při terapii konvenčními endoskopickými metodami. Nicméně k potvrzení jsou zapotřebí další randomizované studie [24].
Závěr
EUS navigovaná drenáž pomocí ECE-LAMS stentů představuje bezpečnou a klinicky úspěšnou terapii pankreatických tekutinových kolekcí. Navzdory limitovanému množství publikovaných studií týkajících se použití vícenásobné transluminální drenáže je tato technika dobře tolerovaná. Zároveň se jeví jako efektivní při drenáži mnohočetných WON, kde by jednovstupová metoda nebyla dostatečně účinná. Jak ukazuje referovaná kazuistika, může takový přístup snížit počet nutných intervencí, a tím i celkovou zátěž pacienta.
ORCID autorky
J. Pintová 0000-0002-1734-274X.
Doručeno/Submitted: 1. 4. 2025
Přijato/Accepted: 19. 5. 2025
Korespondenční autorka
MUDr. Iva Rennétová
Gastroenterologické oddělení
Oblastní nemocnice Mladá Boleslav, a. s.
nemocnice Středočeského kraje
tř. Václava Klementa 147/23
293 01 Mladá Boleslav
iva.rennetova@onmb.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Xiao AY, Tan ML, Wu LM et al. Global incidence and mortality of pancreatic diseases: a systematic review, meta-analysis, and meta-regression of population-based cohort studies. Lancet Gastroenterol Hepatol 2016; 1(1): 45–55. doi: 10.1016/S2468-1253(16)30004-8.
2. Banks PA, Bollen TL, Dervenis C et al. Classification of acute pancreatitis – 2012: revision of the Atlanta classification and definitions by international consensus. Gut 2013; 62(1): 102–111. doi: 10.1136/gutjnl-2012-302779.
3. Arvanitakis M, Dumonceau JM, Albert J et al. Endoscopic management of acute necrotizing pancreatitis: European Society of Gastrointestinal Endoscopy (ESGE) evidence-based multidisciplinary guidelines. Endoscopy 2018; 50(6): 524–546. doi: 10.1055/a-0588-5365.
4. Maňák J, Rejchrt S, Andrašina T et al. Těžká akutní pankreatitida. 2022 [online]. Dostupné z: https: //kdp.uzis.cz/res/guideline/37-tezka-akutni-pankreatitida-final.pdf.
5. van Santvoort HC, Besselink MG, Bakker OJ et al. A step-up approach or open necrosectomy for necrotizing pancreatitis. N Engl J Med 2010; 362(16): 1491–1502. doi: 10.1056/NEJMoa0908821.
6. Husťák R, Martínek J. Pankreatická nekróza a tekutinové kolekce. In: Martínek J, Trunečka P (eds). Gastroenterologie a hepatologie v algoritmech. Praha: Maxdorf 2021: 435–442.
7. van Brunschot S, van Grinsven J, van Santvoort HC et al. Endoscopic or surgical step-up approach for infected necrotising pancreatitis: a multicentre randomised trial. Lancet 2018; 391(10115): 51–58. doi: 10.1016/S0140-6736(17)32404-2.
8. Bang JY, Wilcox CM, Arnoletti JP et al. Superiority of endoscopic interventions over minimally invasive surgery for infected necrotizing pancreatitis: meta-analysis of randomized trials. Dig Endosc 2020; 32(3): 298–308. doi: 10.1111/den.13470.
9. Varadarajulu S, Christein JD, Tamhane A et al. Prospective randomized trial comparing EUS and EGD for transmural drainage of pancreatic pseudocysts (with videos). Gastrointest Endosc 2008; 68(6): 1102–1111. doi: 10.1016/j.gie.2008.04.028.
10. Moon SH, Choi SY, Jung SW et al. Endoscopic ultrasound-guided versus conventional transmural drainage for pancreatic pseudocysts: a prospective randomized trial. Endoscopy 2009; 41(10): 842–848. doi: 10.1055/s-0029-1215133.
11. Binmoeller KF, Shah J. A novel lumen-apposing stent for transluminal drainage of nonadherent extraintestinal fluid collections. Endoscopy 2011; 43(4): 337–342. doi: 10.1055/s-0030-1256127.
12. Štěpán M, Urban O, Fojtík P, et al. Migrace samoexpandibilního metalického stentu do drénované pseudocysty po endoskopické pseudocystogastrostomii a jeho endoskopická extrakce. Gastroent Hepatol 2018; 72(3): 221–224. doi: 10.14735/amgh2018221.
13. Pintová J, Procházka R, Nosek V. Endosonograficky navigované drenážní výkony novými metalickými apozičními stenty s elektrokauterizační jednotkou (stent Hot AXIOS) – vlastní soubor 20 pacientů. Gastroent Hepatol 2018; 72(4): 309–316. doi: 10.14735/amgh2018309.
14. Bang JY, Hawes R, Bartolucci A et al. Efficacy of metal and plastic stents for transmural drainage of pancreatic fluid collections: a systematic review. Dig Endosc 2015; 27(4): 486–498. doi: 10.1111/den.12418.
15. Bang JY, Navaneethan U, Hasan MK et al. Non-superiority of lumen-apposing metal stents over plastic stents for drainage of walled-off necrosis in a randomised trial. Gut 2019; 68(7): 1200–1209. doi: 10.1136/gutjnl-2017-315335.
16. Lang GD, Fritz C, Bhat T et al. EUS-guided drainage of peripancreatic fluid collections with lumen-apposing metal stents and plastic double-pigtail stents: comparison of efficacy and adverse event rates. Gastrointest Endosc 2018; 87(1): 150–157. doi: 10.1016/j.gie.2017.06.029.
17. Poc K, Mačinga P, Štirand P et al. Endosonograficky navigovaná drenáž pankreatických kolekcí – vlastní zkušenosti. Gastroent Hepatol 2017; 71(5): 401–408. doi: 10.14735/amgh2017401.
18. Vanek P, Falt P, Vitek P et al. EUS-guided transluminal drainage using lumen-apposing metal stents with or without coaxial plastic stents for treatment of walled-off necrotizing pancreatitis: a prospective bicentric randomized controlled trial. Gastrointest Endosc 2023; 97(6): 1070–1080. doi: 10.1016/j.gie.2022.12.026.
19. Varadarajulu S, Phadnis MA, Christein JD et al. Multiple transluminal gateway technique for EUS-guided drainage of symptomatic walled-off pancreatic necrosis. Gastrointest Endosc 2011; 74(1): 74–80. doi: 10.1016/j.gie.2011.03.1122.
20. Binda C, Dabizzi E, Anderloni A et al. Single-step endoscopic ultrasound-guided multiple gateway drainage of complex walled-off necrosis with lumen apposing metal stents. Eur J Gastroenterol Hepatol 2020; 32(10): 1401–1404. doi: 10.1097/MEG.0000000000001793.
21. Yan L, Dargan A, Nieto J et al. Direct endoscopic necrosectomy at the time of transmural stent placement results in earlier resolution of complex walled-off pancreatic necrosis: results from a large multicenter United States trial. Endosc Ultrasound 2019; 8(3): 172–179. doi: 10.4103/eus.eus_108_17.
22. Bang JY, Lakhtakia S, Thakkar S et al. Upfront endoscopic necrosectomy or step-up endoscopic approach for infected necrotising pancreatitis (DESTIN): a single-blinded, multicentre, randomised trial. Lancet Gastroenterol Hepatol 2024; 9(1): 22–33. doi: 10.1016/S2468-1253(23)00331-X.
23. Binda C, Fabbri S, Perini B et al. Endoscopic ultrasound-guided drainage of pancreatic fluid collections: not all queries are already solved. Medicina 2024; 60(2): 333. doi: 10.3390/medicina60020333.
24. Stassen PMC, de Jonge PJF, Bruno MJ et al. Safety and efficacy of a novel resection system for direct endoscopic necrosectomy of walled-off pancreas necrosis: a prospective, international, multicenter trial. Gastrointest Endosc 2022; 95(3): 471–479. doi: 10.1016/j.gie.2021.09.025.