Endoskopická intermuskulární disekce karcinomu rekta s hlubokou submukózní invazí
Ondřej Urban1, Přemysl Falt1, Patrik Flodr2, Ivo Uberall2
+ Pracoviště
Souhrn
Formou kazuistického sdělení prezentujeme případ úspěšné léčby T1 adenokarcinomu rekta s hlubokou submukózní invazí metodou endoskopické intermuskulární disekce.
Klíčová slova
kolorektální karcinom, endoskopická intermuskulární disekce, endoskopická submukózní disekce
Úvod
V léčbě karcinomů rekta s nízkým rizikem metastazování do lymfatických uzlin je metodou volby endoskopická terapie, zejména endoskopická slizniční resekce (EMR) a endoskopická submukózní disekce (ESD). Za „low-risk“ léze jsou považovány karcinomy s vysokou nebo střední diferenciací (G1–2), hloubkou invaze do submukózy ≤ 1 mm, nepřítomností invaze do krevních a lymfatických cév a nervových pletení a nepřítomností tzv. buddingu vyššího stupně (bd2 nebo bd3) [1]. Karcinomy, u nichž je některé z uvedených kritérií pozitivní, jsou označovány jako „high-risk“ a jsou indikovány k dodatečné chirurgické léčbě. Některé práce z poslední doby však ukazují, že v případech, kdy je submukózní invaze > 1 mm jediným rizikovým faktorem, je pravděpodobnost metastazování do lymfatických uzlin nízká, takže nadále nepředstavuje silnou indikaci k dodatečné chirurgické léčbě [2]. Nezbytnou podmínkou kurativní endoskopické léčby zůstává ve všech případech en bloc R0 resekce.
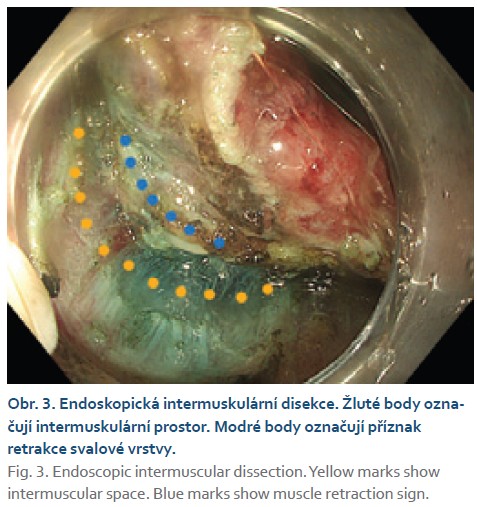
Endoskopickou intermuskulární disekci (EID) poprvé popsali Rahni et al. v roce 2017 [3]. Technicky se jedná se o analogii ESD, avšak disekce je v potřebném rozsahu provedena v prostoru mezi vnitřní cirkulární a zevní longitudinální vrstvou muscularis propria. EID umožnuje R0 resekci lézí s pozitivním příznakem retrakce svalové vrstvy (muscle retraction sign). V prezentovaném kazuistickém sdělení dokumentujeme případ úspěšné EID a diskutujeme o potenciální indikaci této nové metody.
Popis případu
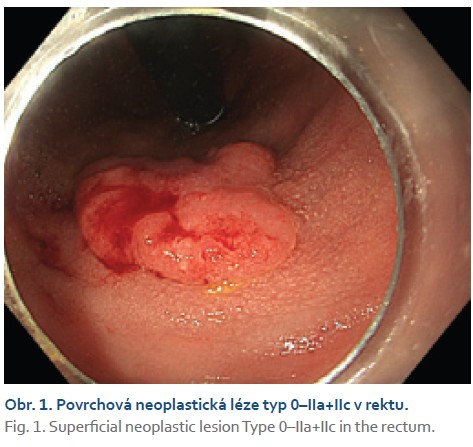
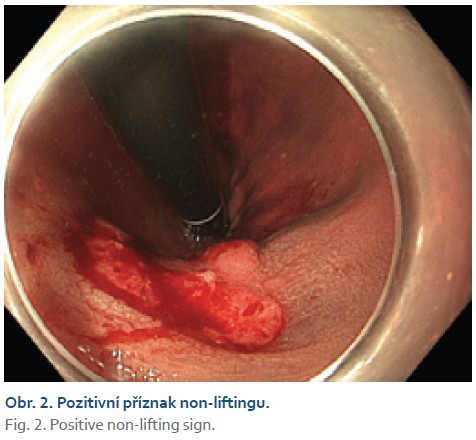
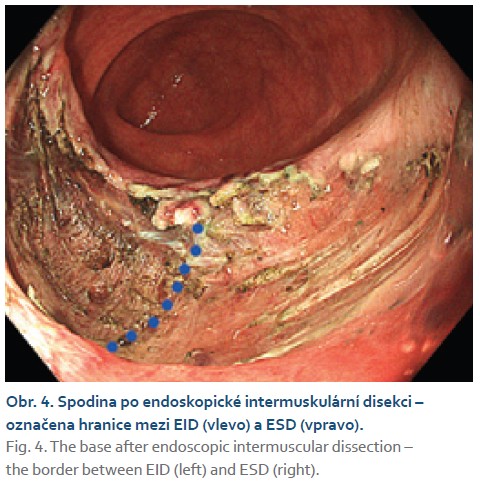
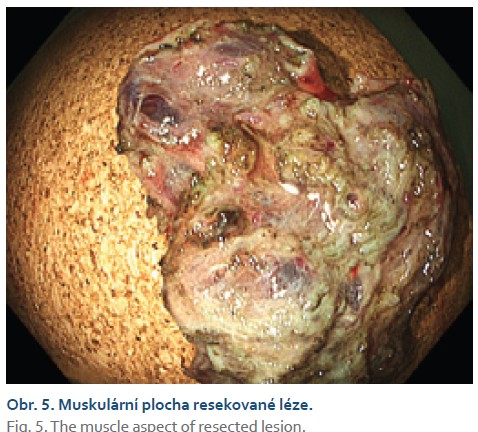
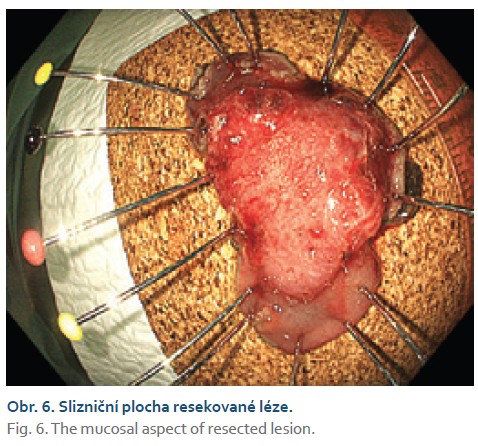
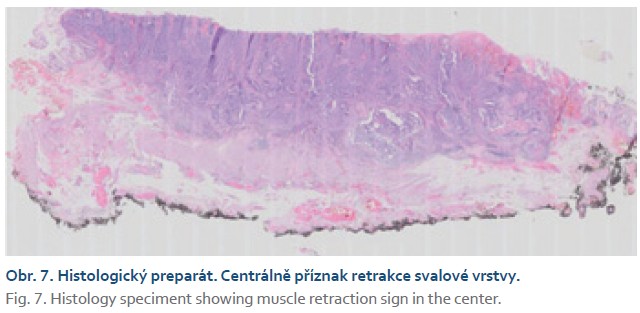
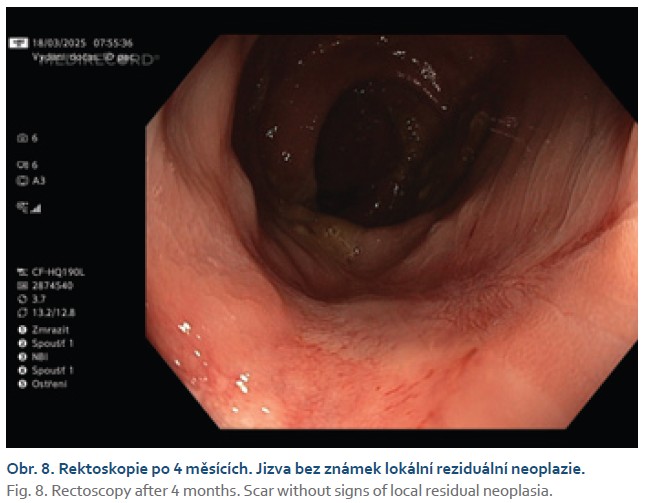
Čtyřiasedmdesátiletá žena s anamnézou metabolického syndromu, diabetes mellitus 2. typu a chirurgické a onkologické léčby karcinomu prsu byla referována na naše pracoviště k endoskopické léčbě povrchové neoplastické léze rekta diagnostikované při screeningové koloskopii. Výkon provádíme v sedaci midazolamem. Gastroskop Olympus GIF EZ 1500 s průhledným nástavcem (capem, Disposable Distal Attachement, OLYMPUS) délky 4 mm zavádíme do rekta. Ve vzdálenosti asi 2 cm od anorektálního přechodu nacházíme vyvýšenou povrchovou neoplastickou lézi s centrálním vpáčením, tj. typu 0–IIa +IIc podle Pařížské klasifikace, o průměru 20 mm (obr. 1). Při endoskopii v módu narrow band imaging (NBI) klasifikujeme lézi jako Japan NBI expert team (JNET) typ 3 svědčící pro hlubokou submukózní invazi. Provádíme podpich léze fyziologickým roztokem a pozorujeme pozitivní příznak non-liftingu (obr. 2). Rozhodujeme se proto provést EID. Použijeme akcesorium dual-knife s délkou řezacího drátu 1,5 mm (OLYMPUS, MODELS KD-650U). Výkon začínáme cirkulární incizí submukózy ve vzdálenosti 5 mm od okraje léze. Poté do submukózy pod lézi aplikujeme roztok EndoClot® Submucosal Injection Solution a pokračujeme disekcí submukózy směrem k centrální části léze až vizualizujeme příznak retrakce svalové vrstvy, která je přitažena tumorem a má trojúhelníkovitý tvar. V této fázi provádíme myotomii vnitřní svalové vrstvy rekta a otevíráme intermuskulární prostor, který rozšiřujeme další injekcí fyziologického roztoku zbarveného metylenovou modří (obr. 3). Dále pokračujeme intermuskulární disekcí mezi vnitřní cirkulární a zevní longitudinální svalovou vrstvou rekta až do dosažení kompletní disekce pod invadující částí léze.Výkon ukončujeme standardní disekcí submukózy na zbylém obvodu léze. Prohlížíme spodinu po EID, vylučujeme perforaci (obr. 4). En bloc resekát rozměrů 40 × 25 mm vybavujeme síťkou a fixujeme na korkové podložce (obr. 5, 6). Po výkonu nemocnou hospitalizujeme 72 hodin. Pooperační průběh byl bez komplikací, pro elevaci C-reaktivního proteinu byla indikována antibiotická léčba amoxicilinem s klavulanátem s promptní normalizací laboratorního nálezu. Resekát vyšetřuje patolog s velkou zkušeností s hodnocením endoskopických resekátů. Hodnotí lézi jako středně diferencovaný adenokarcinom, který dosahuje do submukózy, bez jednoznačné invaze do muscularis propria, hloubka invaze do submukózy je 3,5 mm. Neoplazie nedosahuje okrajů, je vzdálena 2,3 mm od laterálního a 2,6 mm od kontralaterálního okraje a 1 mm od značené spodiny. Byl popsán budding nízkého stupně (db1) a vyloučili invazi do lymfatických a krevních cév (obr. 7). Nemocná je následně konzultována v mezioborové komisi pro onemocnění gastrointestinálního traktu FN Olomouc, která konstatuje kompletní (R0) endoskopickou resekci „high-risk“ karcinomu a vzhledem k přítomnosti hluboké submukózní invaze jako jedinému rizikovému faktoru metastazování do lymfatických uzlin považuje endoskopický výkon za dostatečný, protože riziko amputace rekta i vzhledem k perioperačnímu riziku u dané nemocné významně převyšuje riziko lymfatické diseminace. Následuje stagingové CT, které je beze známek lymfadenopatie a bez dalších pozoruhodností. Nemocná je dále dispensarizována gastroenterologem (obr. 8).
Diskuze
Cílem endoskopické resekce submukózně invadujícího kolorektálního karcinomu je en bloc R0 resekce, které lze dosáhnout endoskopicky nebo chirurgicky. Vzhledem ke stejným onkologickým výsledkům a nižší invazivitě jsou v současnosti preferovány metody endoskopické, které byly vyvinuty japonskými endoskopisty a jsou dnes globálně rozšířeny. Můžeme je rozdělit na:
- 1. metody založené na resekci kličkou (EMR – endoskopická slizniční resekce);
- 2. endoskopickou submukózní disekci (ESD), využívající diatermické nože.
Hlavní výhodou metody ESD je potenciál provést en bloc resekci bez ohledu na plošný rozsah léze. Obě metody poskytují resekát k histologickému stagingu, který podle tradičního pojetí rozdělí resekované karcinomy podle rizika metastázování do lymfatických uzlin na nízkorizikové (low-risk) a vysokorizikové (high-risk). Nízkorizikové karcinomy jsou definovány vertikální a horizontální resekční linií negativní na přítomnost nádorových buněk (R0 resekce), příznivou histologií (dobře nebo středně diferencovaný adenokarcinom), hloubkou invaze ≤ 1 000 µm (měřeno od lamina muscularis mucosae), nepřítomností invaze do krevních a lymfatických cév a nervových pletení a nepřítomností buddingu vyššího stupně (bd2 nebo bd3).
Podíl low-risk lézí na celkovém počtu endoskopicky resekovaných KRK se ve studiích pohybuje kolem 90 % a panuje všeobecná shoda, že tyto léze nevyžadují žádnou další terapii. Pozitivita nejméně jednoho z uvedených kritérií definuje high-risk karcinomy, které jsou indikovány k onkologicky radikální chirurgické léčbě včetně lymfadenektomie. V písemnictví lze nalézt celou řadu studií, které prokazují bezpečnost primárně endoskopického přístupu a které se staly základem pro doporučení mezinárodních i domácích odborných institucí [1,4,5]. Například metaanalýza Dang et al. čítající 71 studií a obsahující 5 167 endoskopicky léčených pacientů s T1 KRK ze čtyř světadílů ukázala, že rekurence karcinomu nastala pouze ve 209 (3,3 %) případech, z toho lokální v 1,9 % a vzdálená v 1,6 %. V případech low-risk karcinomů nastala rekurence v 0,7 % a byla většinou lokální, v případech high-risk to bylo v 7 %. Zatímco úmrtí v důsledku KRK nastalo v celém souboru v 1,7 %, přítomnost rekurence znamenala riziko úmrtí 41 % [6]. V japonském prospektivním souboru 4 667 pacientů s T1 KRK, který publikovali Oka et al., bylo celkové riziko lymfatických metastáz 10,4 %, riziko rekurence u low-risk karcinomů bylo 0,4 % bez dodatečné chirurgické léčby a 5leté přežití bez nádoru nastalo v 99, 6 % [7]. Vzhledem k zaměření našeho sdělení je významné, že lokalizace v rektu představovala nezávislý rizikový faktor pro rekurenci.
Z výše uvedeného vyplývá, že endoskopická resekce může být považována za kurativní v případě low-risk karcinomů (bez potřeby další terapie) a naopak má být následována dodatečnou chirurgickou resekcí v případech high-risk lézí. Přesto je nutné tento postup považovat za suboptimální: přibližně 90 % dodatečných chirurgických resekcí se nakonec ukáže jako nadbytečných, protože resekát kolon nebo rekta a spádových lymfatických uzlin je při histologickém vyšetření negativní na přítomnost nádoru. Kritéria pro indikaci k dodatečné chirurgické léčbě navíc nejsou sjednocena.
Snaha minimalizovat podíl nadbytečných operací po endoskopické léčbě vede k pokusům o další stratifikaci high-risk karcinomů. Ukazuje se, že jednotlivé histologické rizikové faktory nemají stejnou váhu a riziko roste exponenciálně s jejich počtem. Například v metaanalýze publikované Zwager et al. zahrnující 67 studií s 21 238 pacienty s T1 KRK bylo celkové riziko metastázování do lymfatických uzlin 11,2 %. Pokud byla hluboká submukózní invaze jediným rizikovým faktorem, bylo riziko 2,6 %. Autoři uzavírají, že hluboká submukózní invaze má být jako indikace k chirurgické léčbě přehodnocena [2]. V našem vlastním souboru 102 nemocných léčených metodami ESD a FTR mělo invazivní karcinom 29 (28,5 %), z toho se ve 12 (12 %) případech jednalo o hlubší než povrchovou (sm1) submukózní invazi (11× sm2+3; 1× T2). Dodatečné chirurgické léčbě se podrobilo jedenáct z nich, histologické vyšetření prokázalo v jediném případě reziduum HGIEN v resekátu, všechny ostatní byly negativní na přítomnost nádoru ve stěně střeva nebo v lymfatických uzlinách [8]. Na základě literárních údajů a vlastní zkušenosti můžeme konstatovat, že význam submukózní invaze T1 KRK jako indikace k dodatečné chirurgické léčbě je přeceňován a má být hodnocen individuálně.
Pokud akceptujeme, že je hluboká submukózní invaze pouze relativním rizikovým faktorem, jsou u těchto pacientů metody založené na disekci v submukóze nevhodné pro riziko R1 vertikální resekce, kterou považujeme za jednoznačnou indikaci k dodatečné chirurgické léčbě. Je proto důležité tyto léze rozpoznat a využít metody, které umožňují resekci v hlubších vrstvách stěny. Metodám k odlišení hluboké submukózní invaze se věnuje řada prací. Na tomto místě je pouze vyjmenujeme s konstatováním, že žádná z nich není univerzální. Hloubku invaze in vivo odhadujeme na základě kombinace endoskopických, endosonografických (EUS) a radiologických metod. Při konvenční endoskopii se jedná zejména o expanzivní vzhled, tuhost, nepravidelnost a hrbolatý povrch léze, v případě ploché léze je to intenzivní zarudnutí, table-like deprese nebo protruze ve snížené části. V okolí léze je typické sbíhání řas, deformace lumen a snížená distenzibilita stěny. Při vyšetření mikrostruktury sliznice při endoskopii s vysokým rozlišením se jedná zejména o přítomnost tvaru jamek typu Vn (pit pattern Vn), při vyšetření v módu NBI se jedná většinou o léze v kategorii JNET 3. Co se týče EUS, v naší vlastní studii byla diagnostická přesnost vysokofrekvenční katétrové endosonografie pro T stadium 90 % [9]. Léze s hlubokou submukózní invazí vykazují pozitivní příznak non-liftingu. Radiologické metody (CT, MR) obecně vykazují významný overstaging a nejsou preferovány.
Metodu EID popsali jako první Rahni et al. v roce 2017 jako tzv. peranální endoskopickou myektomii (PAEM). Odstranili karcinom rekta pT1b s hlubkou submukózní invazí 4350 µm. Hlavní výhodu metody spatřují v možnosti odstranit karcinomy s příznakem retrakce svalové vrstvy pod lézí [3]. V roce 2023 publikovali Tribonias et al. soubor 23 nemocných léčených EID pro karcinom nebo benigní lézi rekta s fibrózou [10]. Potvrzují, že metoda EID je vhodná zejména pro léze s pozitivním příznakem retrakce svalové vrstvy, která může být způsobena nádorovou invazí, ale až ve 30 % případů je jejím podkladem fibróza submukózy při mechanickém dráždění peristaltikou. Tyto dvě prognosticky odlišné situace je in vivo velmi obtížné odlišit.
T1 KRK s hlubokou submukózní invazí lze odstranit rovněž metodou FTR. O této metodě referuje řada prací, včetně naší [8]. Za hlavní výhodu lze považovat použitelnost v celém kolon, naopak lokalizace v distální třetině rekta není pro FTR vhodná. Hlavní limitací FTR je velikost léze, je-li > 20 mm, narůstá riziko R1 resekce. Dalšími možnostmi léčby T1 karcinomů rekta jsou transanální excize (TAE) a transanální endoskopická mikrochirurgie (TEM). TEM je méně vhodná pro léze ve vzdálenosti do 3 cm od anu a objemné nebo na velké ploše rostoucí léze. Obecně panuje shoda, že metody lokální excize mají být vždy preferovány před otevřenou operací, která je zatížena mortalitou a morbiditou, včetně rizika ztráty funkce svěračů a genito-uretrální dysfunkce.
Závěry
Závěrem uvádíme, že jsme metodou EID odstranili karcinom rekta ve stadiu pT1b. Domníváme se, že EID je vhodná zejména pro high-risk karcinomy rekta s hlubokou submukózní invazí, je-li jediným pozitivním rizikovým faktorem metastazování do lymfatických uzlin. Druhou indikací jsou léze s fibrózou submukózy. Jedná se o novou metodu, která rozšiřuje potenciál endoskopické léčby, avšak její postavení musí být ověřeno dalšími studiemi.
ORCID autorů
O. Urban 0000-0002-6705-7912,
P. Falt 0000-0001-8843-4716,
P. Flodr 0000-0002-7982-5229,
I. Uberall 0000-0002-3330-3054.
Doručeno/Submitted: 21. 3. 2025
Přijato/Accepted: 8. 4. 2025
Korespondenční autor
prof. MUDr. Ondřej Urban, Ph.D.
II. interní klinika – gastroenterologická a geriatrická
LF UP a FN Olomouc
Zdravotníků 248/7
779 00 Olomouc
Ondrej.Urban@fnol.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Falt P, Cyrany J, Kunovský L et al. Doporučené postupy České gastroenterologické společnosti ČLS JEP pro diagnostickou a terapeutickou koloskopii – aktualizované vydání 2024. Gastroent Hepatol 2024; 78(3): 197–235. doi: 10.48095/ccgh2024197.
2. Zwager LW, Bastiaansen BAJ, Montazeri NSM et al. Deep submucosal invasion is not an independent risk factor for lymph node metastasis in T1 colorectal cancer: a meta-analysis. Gastroenterology 2022; 163(1): 174–189. doi: 10.1053/j.gastro.2022.04.010.
3. Rahni DO, Toyonaga T, Ohara Y et al. First reported case of per anal endoscopic myectomy (PAEM): a novel endoscopic technique for resection of lesions with severe fibrosis in the rectum. Endosc Int Open 2017; 5(3): E146–E150. doi: 10.1055/s-0042-122965.
4. Pimentel-Nunes P, Libânio D, Bastiaansen BAJ et al. Endoscopic submucosal dissection for superficial gastrointestinal lesions: European Society of Gastrointestinal Endoscopy (ESGE) guideline – update 2022. Endoscopy 2022; 54(6): 591–622. doi: 10.1055/a-1811-7025.
5. NCCN. NCCN Guidelines, version 2. 2021 [online]. Dostupné z: https: //www.nccn.org/.
6. Dang H, Dekkers N, le Cessie S et al. Risk and time pattern of recurrences after local endoscopic resection of T1 colorectal cancer: a meta-analysis. Clin Gastroenterol Hepatol 2022; 20(2): e298–e314. doi: 10.1016/j.cgh.2020.11.032.
7. Oka S, Tanaka S, Kajiwara Y et al. Treatment decision for locally resected T1 colorectal carcinoma-verification of the Japanese guideline criteria for additional surgery based on long-term clinical outcomes. Am J Gastroenterol 2024; 119(10): 2019–2027. doi: 10.14309/ajg.0000000000002715.
8. Falt P, Zapletalová J, Urban O. Endoscopic full-thickness resection versus endoscopic submucosal dissection in the treatment of colonic neoplastic lesions ≤ 30 mm-a single-center experience. Surg Endosc 2022; 36(3): 2062–2069. doi: 10.1007/s00464-021-08492-0.
9. Urban O, Kliment M, Fojtik P et al. High-frequency ultrasound probe sonography staging for colorectal neoplasia with superficial morphology: its utility and impact on patient management. Surg Endosc 2011; 25(10): 3393–3399. doi: 10.1007/s00464-011-1737-7.
10. Tribonias G, Komeda Y, Leontidis N et al. Endoscopic intermuscular dissection (EID) for removing early rectal cancers and benign fibrotic rectal lesions. Tech Coloproctol 2023; 27(12): 1393–1400. doi: 10.1007/s10151-023- 02862-7.