Autoimunitní chronická pankreatitida a idiopatické střevní záněty
David Solil1, Petr Dítě1, Tomáš Kupka2,3, Marie Přecechtělová1, Jiří Dolina Orcid.org 1, Bohuslav Kianička Orcid.org 4
+ Pracoviště
Souhrn
Autoimunitní pankreatitida (AIP) představuje zvláštní podskupinu chronické pankreatitidy, která se vyznačuje fibroinflamačním procesem pankreatu s dopadem na jeho exokrinní i endokrinní funkci. Článek se zaměřuje na klinickou charakteristiku, diagnostiku a terapii obou typů AIP, přičemž zvláštní důraz je kladen na její spojitost s idiopatickými střevními záněty (IBD). Zatímco vztah mezi AIP 1. typu a idiopatickými střevními záněty je vzácný, u AIP 2. typu se vyskytuje významně častěji. Studie ukazují, že prevalence AIP u pacientů s idiopatickými střevními záněty je vyšší než v běžné populaci a může významně ovlivnit průběh základního střevního onemocnění. Diagnostické obtíže přinášejí podobnost s malignitami pankreatu, což zdůrazňuje význam pečlivé diferenciální diagnostiky. V léčbě AIP zůstávají kortikosteroidy první volbou, přičemž u kortikodependentních pacientů přichází v úvahu i další imunomodulační terapie (azathioprim, rituximab). Článek poskytuje přehled současných poznatků o vzájemném vztahu AIP a IBD a zdůrazňuje potřebu včasné diagnostiky a multidisciplinárního přístupu v jejich managementu.
Klíčová slova
idiopatické střevní záněty, chronická pankreatitida, autoimunní pankreatitida, pankreatická exokrinní insuficience
Úvod
Autoimunitní pankreatitida (AIP) je subtřídou chronické pankreatitidy. Dle diagnostických kritérií pro autoimunitní pankreatitidu International Consensus Diagnostic Criteria for Autoimmune Pancreatitis (ICDC) je onemocnění klinicky většinou charakterizováno nebolestivým obstrukčním ikterem s pankreatickou masou, nebo bez ní, s histologickým obrazem lymfoplazmatické infiltrace [1]. Hlavní znaky jednotlivých forem nemoci ukazuje tab. 1.
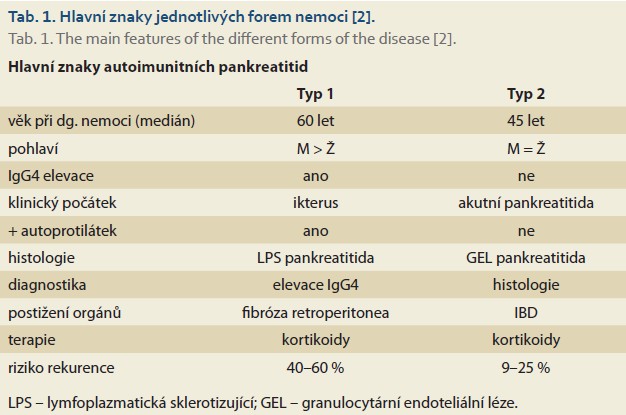
Chronický zánět pankreatu je charakterizován jako fibroinflamační proces se změnami jak endokrinní, tak exokrinní funkce pankreatu. Incidence onemocnění je v rozmezí 4,4–11,9/100 000 obyvatel. Významná je jeho vyšší koincidence u pacientů s idiopatickými střevními záněty (IBD). Přítomnost chronické pankreatitidy se popisuje až u 42–56 % pacientů s idiopatickými střevními záněty [3,4]. Autoimunitní pankreatitida a spojení s idiopatickými střevními záněty není tak častá u 1. typu pankreatitidy, avšak u 2. typu autoimunitní pankreatitidy je častější, a to i ve srovnání s nálezem s běžnou populací [5]. Obecně tak platí, že především 2. typ AIP je vázán na idiopatické střevní záněty. Japonské studie nalezly prevalenci AIP 2. typu u osob s idiopatickými střevními záněty v 0,3–0,5 %, což je přibližně 100krát více než v běžné populaci [6,7].
Autoimunitní pankreatitida a idiopatické střevní záněty
Autoimunitní pankreatitida 1. typu, která je zvláště častou v regionu východních zemí, s incidencí 3,1 a prevalencí 10,1/100 000 obyvatel, je řazena do skupiny IgG4 pozitivních chorob (IgG4-related disease). Histologicky je klasifikována jako pankreatitida s lymfoplazmatickou infiltrací se storiformní fibrózou, obliterativní flebitidou a abundantní přítomností IgG4 pozitivních buněk v pankreatické tkáni (> 10 HPF), ale i v plazmě. Charakteristickou je pozitivní terapeutická odpověď na aplikaci kortikosteroidů.
Méně frekventní 2. typ AIP se častěji vyskytuje v západních zemích. Například v USA je podíl 2. typu na všech AIP kolem 14 %, v Evropě 13 %, naproti tomu 4 % v Asii. U 2. typu AIP není typickým markerem spojení se zvýšenou hladinou sérových IgG4, avšak zásadním markerem je pozitivita granulocytárních endoteliálních lézí (GEL), které se vyskytují především v inter- a intralobulárních vývodech. GEL substance jsou zásadním markerem v diagnostice AIP 2. typu, a to přesto, že jsou přítomny i v heterotopickém pankreatu nebo v nenádorových oblastech pankreatických resekátů u operací z indikace nádoru. Charakteristickou je také pozitivní terapeutická odezva na podání kortikoidů.
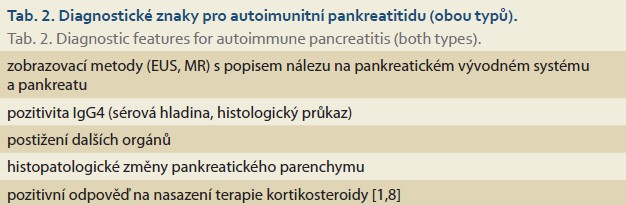
Dle ICDC je diagnostika obou typů autoimunitní pankreatitidy založena na kombinaci zásadních znaků (tab. 2).
Prevalence idiopatických střevních zánětu u nemocných s AIP je až 15krát vyšší než u běžné populace [9,10]. Diagnóza idiopatických střevních zánětů obvykle předchází o 2–5 let diagnóze AIP [11] s kumulativním zvýšením pravděpodobnosti zjištění AIP po 1 roce v 0,2 % a po 10 letech v 0,8 % [6,7]. Významným je fakt, že AIP může být i prvým diagnostickým znakem až u 25 % nemocných s idiopatickým střevním zánětem [11]. U osob s preexistujícím onemocněním ve smyslu idiopatického střevního zánětu v době stanovení diagnózy AIP vykazuje většina nemocných vysoce aktivní formu střevního postižení [2]. Průměrný věk osob v době stanovení diagnózy AIP byl 35 let a nebyla popsána rozdílnost postižení ve vztahu k pohlaví [11].
Klinické projevy AIP u nemocných s idiopatickými střevními záněty nejsou zásadně odlišné, jestliže se jedná o AIP bez současně přítomného střevního postižení. Častým iniciálním onemocněním v době prvého kontaktu s nemocným je přítomnost AIP, a to až v 80 %. V 15 % případů je diagnostikována akutní cholangitida [11].
Diskrepantní jsou hypotézy, zda současná přítomnost AIP ovlivňuje průběh idiopatického střevního zánětu. Dle některých autorů je výrazně horší prognóza idiopatického střevního zánětu oproti stavu, probíhá-li idiopatický střevní zánět „izolovaně“. Rovněž vyšší je zastoupení extenzivních forem kolitidy se zvýšením počtu indikací ke kolektomii, a to jak v případě ulcerózní kolitidy, tak Crohnovy nemoci [9]. Jiné studie však nenalezly rozdíly pro extenzivní formu ulcerózní kolitidy a její aktivitu u pacientů s/bez AIP [6]. Jedna z největších retrospektivních, multicentrických studií hodnotící 91 osob s AIP a idiopatickým střevním zánětem (ulcerózní kolitidou) prokázala AIP nezávisle spojenou s kolektomií a s predilekční lokalizací slizničních změn v oblasti rekta. Autoři se domnívají, že existují dvě skupiny nemocných s ulcerózní kolitidou s vyšším rizikem autoimunitní pankreatitidy. První skupina s vysokým rizikem následné kolektomie a druhá skupina s především distální lokalizací kolitidy. Prevalence ulcerózní kolitidy u 2. typu AIP je uváděna od 18 do 83 % [10–12].
Osoby s Crohnovou chorobou s autoimunitní pankreatitidou vykazují nižší výskyt strikturující formy kolitidy, méně často lokalizovanou perianálně, ale s vyšším rizikem indikace ke kolektomii [13].
Morfologicky na zobrazovacích metodách má autoimunitní pankreatitida u nemocných s idiopatickými střevními záněty klasický tvar „párku“ (sausage-like pancreas), žláza je objemově zvětšená. Charakteristickým znakem je tzv. zevní „rim“, tj. proužkovité projasnění pod pankreatickým pouzdrem. Změny pankreatického vývodu jsou buď fokální, nebo difuzní s možnou prestenotickou dilatací. Nález je někdy velmi obtížné odlišit od možných změn indukovaných pankreatickou malignitou [1,14].
Terapie autoimunitní pankreatitidy
V terapii autoimunitní formy pankreatitidy (1. i 2. typu), jsou lékem první volby kortikosteroidy v dávce 0,6–1 mg/kg/den (minimálně prednisolon 20–40 mg/den) po dobu 4 týdnů [15]. Po dosažení remise následně snižujeme dávky o 5 mg v intervalu 2–3 měsíce. Riziko relapsu onemocnění je vyšší u 1. typu AIP (40–60 %) než u 2. typu (9–25 %) [16]. Alternativou léčby, zvláště u osob kortikoid dependentních, je podávání dalších imunomodulačních léků jako azathioprin [13], Chiabrando et al. zveřejnili i možnost užití terapie kolchicinem u 2. typu AIP [17]. Novější terapeutickou alternativou je rovněž aplikace protilátek anti-TNFα, anti-CD20 (rituximab) [15,18].
Síla důkazů podporujících optimální terapeutický postup je však vzhledem k vzácnosti onemocnění nízká.
Exokrinní pankreatická insuficience a idiopatické střevní záněty
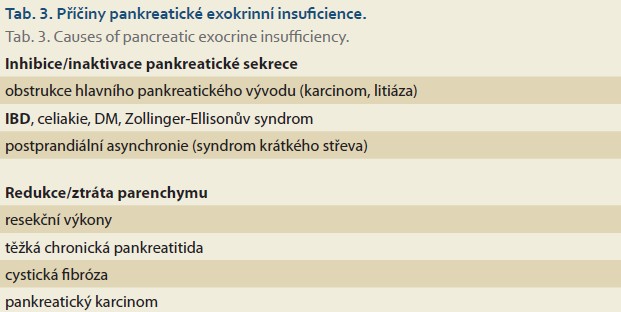
Exokrinní pankreatická insuficience (EPI) je stavem, který vzniká v důsledku nedostatečné produkce a výdeje pankreatických trávicích enzymů, snížení je obvykle < 10 % normy [19]. Nedostatečná zevní pankreatická sekrece je příznakem řady onemocnění slinivky břišní, jako je chronická pankreatitida, obstrukce pankreatického vývodu litiázou či jeho anatomická anomálie (pancreas divisum). Vzniká sekundárně v rámci postresekčních stavů na slinivce a v neposlední řadě je popisován zvýšený výskyt u pacientů s idiopatickými střevními záněty (tab. 3). Italská studie, která užila ke stanovení EPI hladinu fekální elastázy, prokázala exokrinní pankreatickou nedostatečnost u 22 % osob s ulcerózní kolitidou a u 14 % nemocných s Crohnovou chorobou [20]. Starší italská studie se stimulací pankreatu ceruleinem a sekretinem z roku 1988 prokázala v 58 % pokles lipázy u pacientů s Crohnovou chorobou a u 80 % pacientů s ulcerózní kolitidou [21]. Podobné výsledky nalezla skandinávská studie hodnotící u neselektovaného souboru 237 osob s idiopatickým střevním zánětem a exokrinní pankreatickou funkcí za použití PABA testu u 21 % snížení pankreatické sekrece, kdy snížení exkrece PABA (paraaminobenzoová kyselina) bylo na hodnotu < 40 % normy [22].
Příčinou změn exokrinní pankreatické sekrece může být přítomnost autoprotilátek proti acinárním buňkám pankreatu, duodenální reflux, přítomnost pankreaticko-duodenální anomálie nebo porucha hormonální sekrece v duodenu vedoucí k nedostatečné stimulaci sekrece pankreatické šťávy. Možnou příčinou je i onemocnění Crohnovou chorobou s lokalizací v duodenu [23–25].
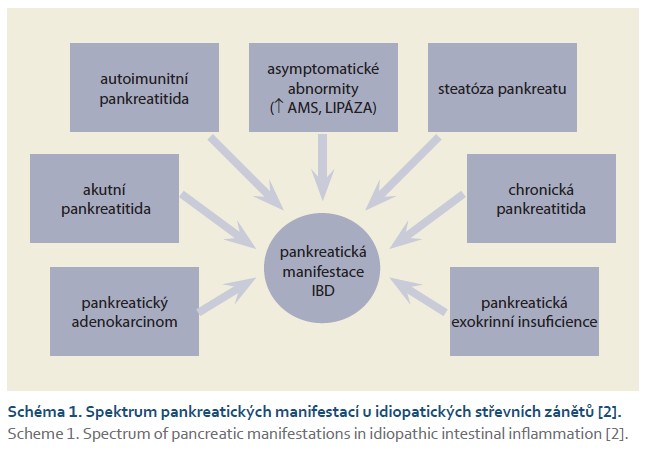
Postižení pankreatu u nemocných s idiopatickými střevními záněty není až tak vzácnou komplikací základního střevního onemocnění. Pankreatické abnormity se nachází až u 11–14 % případů nemocných s idiopatickým střevním zánětem. Asociace mezi idiopatickým střevním zánětem a autoimunitním postižením pankreatu je nejčastější u 2. typu autoimunitní pankreatitidy. Asociace byla rovněž popsána s chronickou nebo akutní pankreatitidou, v posledních letech je věnována pozornost vztahu idiopatického střevního zánětu s pankreatickým duktálním adenokarcinomem. Zvláštní skupinu tvoří tzv. asymptomatické anomálie, jakými jsou např. izolované hyperamylazemie nebo hyperlipazemie. V roce 2024 byla zveřejněna studie zabývající se vztahem mezi idiopatickými střevními záněty a nealkoholickou steatózou pankreatu. Tato práce nalezla ve 23 % u nemocných s idiopatickými střevními záněty steatózu pankreatu (schéma 1) [26].
Závěr
Autoimunitní pankreatitida, zejména její 2. typ, vykazuje významnou souvislost s idiopatickými střevními záněty, přičemž její prevalence u pacientů s idiopatickými střevními záněty je několikanásobně vyšší než v běžné populaci. Studie ukazují, že u těchto pacientů může být AIP buď prvním diagnostickým projevem, nebo se vyvíjí v průběhu aktivního střevního onemocnění. Přítomnost AIP u pacientů s idiopatickými střevními záněty může být spojena s agresivnějším průběhem kolitidy a vyšší nutností kolektomie, ačkoli některé práce tyto souvislosti nezaznamenaly jednoznačně. Přestože kortikosteroidní léčba vede k pozitivní odpovědi ve většině případů, vysoká míra relapsů, zejména u AIP 1. typu, zdůrazňuje potřebu dlouhodobého sledování a v některých případech eskalace terapie (azathioprim, rituximab). Rostoucí důkazy o pankreatických komplikacích u idiopatických střevních zánětů, včetně exokrinní pankreatické insuficience a možného rizika pankreatického adenokarcinomu, podtrhují význam včasného rozpoznání těchto stavů v klinické praxi. Je nezpochybnitelnou skutečností, že pankreatické komplikace u osob s idiopatickými střevními záněty jsou komplikacemi závažnými a ne vzácnými. Je proto třeba na možnost jejich existence u nemocných s idiopatickými střevními zánětem vždy pomýšlet.
ORCID autorů
D. Solil 0009-0004-3343-3424,
P. Dítě 0000-0002-0086-5421,
T. Kupka 0000-0001-5510-8498,
J. Dolina 0000-0002-9061-5273,
B. Kianička 0000-0003-0988-5928.
Doručeno/Submitted: 15. 3. 2025
Přijato/Accepted: 10. 4. 2025
Korespondenční autor
MUDr. David Solil
Interní gastroenterologická klinika
LF MU a FN Brno
Jihlavská 340/20
625 00 Brno
david.solil@seznam.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Shimosegawa T, Chari ST, Frulloni L et al. International consensus diagnostic criteria for autoimmune pancreatitis: guidelines of the Internal Association of Pancreatology. Pancreas 2011; 40(3): 352–358. doi: 10.1097/MPA.0b013e3182142fd2.
2. Massironi S, Fanatti I, Vigano C et al. Systematic review – pancreatic involvement in inflammatory bowel disease. Aliment Pharmacol Ther 2022; 55(12): 1478–1491. doi: 10.1111/apt.16949.
3. Fousekis FS, Theopistos VI, Katsamos KH et al. Pancreatic involvement in inflammatory bowel disease: a review. J Clin Med Res 2018; 10(10): 743–751. doi: 10.14740/jocmr3561w.
4. Spanier BW, Dijkgraaf MG, Bruno MJ. Epidemiology, aetiology and outcome of acute and chronic pancreatitis: an update. Best Pract Res Clin Gastroenterol 2008; 22(1): 45–63. doi: 10.1016/j.bpg.2007.10.007.
5. Majumder S, Takahashi N, Chari ST. Autoimmune pancreatitis. Dig Dis Sci 2017; 62(7): 1762–1769. doi: 10.1007/s10620-017-4541-y.
6. Ueki T, Kawamoto K, Otsuka Y et al. Prevalence and clinicopathological features of autoimmune pancreatitis in Japanese patients with inflammatory bowel disease. Pancreas 2015; 44(3): 434–440. doi: 10.1097/MPA.0000000000000261.
7. Park SH, Kim D, Ye BD et al. The characteristics of ulcerative colitis associated with autoimmune pancreatitis. J Clin Gastroenterol 2013; 47(6): 520–525. doi: 10.1097/MCG.0b013e31827fd4a2.
8. Uchida K, Okazaki K. Clinical and pathophysiological aspects of type 1 autoimmune pancreatitis. J Gastroenterol 2018; 53(4): 475–483. doi: 10.1007/s00535-018-1440-8.
9. Ravi K, Chari ST, Vege SS et al. Inflammatory bowel diasese in the setting of autoimmune pancreatitis. Inflamm Bowel Dis 2009; 15(9): 326–330. doi: 10.1002/ibd.20898.
10. Schneider A, Hirth M, Weiss C et al. Prevalence of inflammatory bowel disease in alcoholic, non-alcoholic and autoimmune pancreatitis. Z Gastroenterol 2018; 56(5): 469–478. doi: 10.1055/s-0043-123881.
11. Baresi L, Tacelli M, Grino SF et al. Multicentric Italian survey on daily practice for autoimmune pancreatitis: clinical data, diagnosis, treatment and evolution toward pancreatic insufficiency. United European Gastroenterol J 2020; 8(6): 705–715. doi: 10.1177/2050640620924302.
12. Almeida P, Almeida C, Gompertz M et al. Association between autoimmune pancreatitis and ulcerative colitis: report of 12 patients. Rev Esp Enferm Dif 2020; 112(9): 682–687. doi: 10.17235/reed.2020.6677/2019.
13. Lorenzo D, Maire F, Srefanescu C et al. Features of autoimmune pancreatitis associated with inflammatory bowel disease. Clin Gastroenterol Hepatol 2018; 16(1): 59–67. doi: 10.1016/j.cgh.2017.07.033.
14. Tsen A, Alishahi Y, Rosenkranz L. Autoimmune pancreatitis and inflammatory bowel disease: an update overview. J Clin Gastroenterol 2017; 51(3): 208–214. doi: 10.1097/MCG.00000 00000000737.
15. Sah RP, Chari ST, Pannala R et al. Differences in clinical profile and relapse rate of type 1 versus type 2 autoimmune pancreatitis. Gastroenterology 2010; 139(1): 140–148. doi: 10.1053/j.gastro.2010.03.054.
16. Overbeek KA, Poulsen JL, Lanzillotta M et al. Type 1 autoimmune pancreatitis in Europe: clinical profile and response to treatment. Clin Gastroenterol Hepatol 2024; 22(5): 994.e10–1004.e10. doi: 10.1016/j.cgh.2023.12.010.
17. Chiabrando F, Lanzillota M, Palumbo D et al. Treating type 2 autoimmune pancreatitis with colchicine: a case series. Ann Intern Med 2021; 174(12): 1775–1776. doi: 10.7326/L21-0281.
18. Lorenzo D, Vullierme MP, Rebours V. Antitumor necrosis factor therapy is effective for autoimmune pancreatitis type 2. Am J Gastroenterol 2020; 115(7): 1133–1134. doi: 10.14309/ajg.0000000000000668.
19. Singh VK, Haupt ME, Geller DE et al. Less common etiologies of exocrine pancreatic insufficiency. World J Gastroenterol 2017; 23(39): 7059–7076. doi: 10.3748/wjg.v23.i39.7059.
20. Maconi D, Dominici R, Molteni M et al. Prevalence of pancreatic insufficiency in inflammatory bowel disease. Dig Dis Sci 2008; 53(1): 262–270. doi: 10.1007/s10620-007-9852-y.
21. Lorenzo D, Vullierme MP, Rebours V. Antitumor necrosis factor therapy is effective in autoimmune pancreatitis type 2. Am J Gastroenterol 2020; 115(7): 1133–1144. doi: 10.14309/ajg.0000000000000668.
22. Angelini G, Cavallini G, Bovo P et al. Pancreatic function in inflammatory bowel disease. Int J Pancreatology 1988; 3(2–3): 185–193. doi: 10.1007/BF02798930.
23. Heikius B, Niemela S, Lehtola M et al. Pancreatic duct abnormalities and pancreatic function in patients with chronic inflammatory bowel disease. Scand J Gastroenterol 1996; 31(5): 517–523. doi: 10.3109/00365529609006775.
24. Hegenhoj J, Hansen CP, Rannem T et al. Pancreatic function in Crohn‘s disease. Gut 1990; 31(9): 1076–1079. doi: 10.1136/gut.31.9.1076.
25. Seibold F, Mork H, Tanza S et al. Pancreatic autoantibodies in Crohn‘s disease: a family study. Gut 1997; 40(4): 481–484. doi: 10.1136/ gut.40.4.481.
26. Hedström A, Steiner C, Valente R et al. Pancreatic exocrine insufficiency and Crohn‘s disease. Minerva Gastroenterol Dietol 2020; 66(1): 17–22. doi: 10.23736/S1121-421X.19.02636-9.
27. Buldukoglu OC, Alparslan AS, Koc LZ et al. Prevalence of pancreatic steatosis in inflammatory bowel disease patients. Sisli Etfal Hstan Tip Bul 2024; 58(4): 442–446. doi: 10.14744/SEMB.2024.43726.