Riziko jaterní fibrózy ve skupině pacientů operovaných pro zlomeniny proximálního femuru
Martin Sedlář1, Václav Šmíd Orcid.org 2, Šimon Dostál2, Radan Brůha Orcid.org 2, Petr Dytrych Orcid.org 1
+ Pracoviště
Souhrn
Úvod: Jaterní fibróza je průvodním jevem chronických jaterních chorob a často se vyvíjí po dlouhou dobu skrytě. Je rizikem i pro mimojaterní onemocnění včetně tzv. křehkosti. Cílem naší práce bylo určit riziko jaterní fibrózy u skupiny pacientů s traumatem proximálního femuru. Metodika: Pacienti operovaní pro zlomeninu proximálního femuru byli retrospektivně zhodnoceni pomocí neinvazivních indexů jaterní fibrózy (NAFLD fibrosis skóre, FIB-4 a APRI skóre). Kontrolní skupinu tvořili pacienti s diabetem. Výsledky: Bylo hodnoceno celkem 72 operovaných pacientů a 72 kontrol. Při využití nejvhodnějšího indexu (FIB-4 adjustovaného na věk) bylo hodnoceno 46 % pacientů bez jakéhokoli rizika jaterní fibrózy, 43 % pacientů se středním či neurčitým rizikem fibrózy a 11 % pacientů mělo s vysokou pravděpodobností dosud klinicky němou fibrózu. Zastoupení jednotlivých skupin se významně nelišilo od kontrol. Etiologicky se nejspíše jednalo o NAFLD či etylické postižení. Závěr: Významná jaterní fibróza může být přítomna u 1/10 pacientů operovaných pro trauma proximálního femuru. Detekce takových pacientů pomocí neinvazivních indexů je velmi jednoduchá a měla by být ke screeningu používána i v běžné praxi.
Klíčová slova
fibróza, nealkoholová tuková choroba jater, křehkost, zlomenina proximálního femuru
Úvod
Jaterní fibróza je obecná reakce jaterního parenchymu na chronické poškození způsobené různými etiologickými faktory a vedoucí ve svých důsledcích ke vzniku cirhózy [1]. Přítomnost a progrese jaterní fibrózy rozhoduje o prognóze pacienta s jakoukoli chronickou jaterní chorobou [2]. Tato skutečnost se týká pacientů s nejčastějšími chronickými jaterními chorobami v naší populaci, kterými jsou nealkoholová tuková choroba jater (NAFLD – non-alcoholic fatty liver disease), alkoholové poškození jater a chronická virová hepatitida C. U pacientů s NAFLD je navíc přítomnost i stupeň fibrózy nezávislým rizikovým faktorem pro vznik mimojaterních chorob, jako jsou kardiovaskulární onemocnění a mimojaterní malignity [3], i celkovou mortalitu [4,5]. Jaterní fibróza není vzácným stavem a postihuje podstatnou část populace. Ve studii na více než 1 000 zdravých jedincích ve věku > 45 let prováděné ve Francii byla prokázána přítomnost jaterní fibrózy různého stupně pomocí transientní elastografie u 7,5 % vyšetřených [6]. Při následném podrobném vyšetření byla u všech prokázána chronická jaterní choroba (v 55 % se jednalo o NAFLD, ve 22 % o alkoholovou chorobu), téměř polovina pacientů měla překvapivě zcela normální jaterní testy. Je zřejmé, že fibróza se může dlouho vyvíjet klinicky zcela němě a normální jaterní testy její přítomnost nevylučují. NAFLD jako nečastější příčina jaterní fibrózy zahrnuje široké spektrum patologických stavů od prosté jaterní steatózy přes zánětlivé změny jaterního parenchym (nealkoholová steatohepatitida – NASH), různý stupeň jaterní fibrózy až po jaterní cirhózu u jedinců, kteří nepožívají nadměrné množství alkoholu [7]. NAFLD souvisí s výskytem metabolického syndromu (spjatého s inzulinovou rezistencí) a jeho jednotlivými komponentami (centrální obezita, diabetes 2. typu – DM2, dyslipidemie a arteriální hypertenze) [8]. NAFLD je dnes celosvětově nejčastějším chronickým jaterním onemocněním [9], jeho prevalence se v dospělé evropské populaci se pohybuje kolem 25 % [10]. V rizikových skupinách (pacienti s těžkou obezitou či DM2) se NAFLD vyskytuje v 80–90 %. Prevalence ani incidence NAFLD/NASH v ČR není známa; k dispozici jsou jen omezená data popisující u pacientů s DM2 přítomnost NAFLD v 70–79 % a jaterní fibrózy ve 13–19 % [11].
Stupeň jaterní fibrózy se dříve hodnotil histologicky z biopsie (z té doby pochází i rozdělení na stupně fibrózy F0–F4 [12]), v dnešní době lze stupeň fibrózy poměrně dobře posoudit pomocí neinvazivních vyšetření. Standardem v hodnocení stupně fibrózy jsou dnes metody založené na měření elasticity jaterní tkáně (elastografie). Tato metoda se však nehodí k plošnému screeningu jaterní fibrózy, který je v poslední době doporučován především v rizikových skupinách [8]. Ideální metodou pro plošný screening jsou různé indexy, které zahrnují běžné klinické údaje a běžná laboratorní vyšetření a které mohou identifikovat pacienty, kteří pravděpodobně mají pokročilou fibrózu či naopak fibrózu téměř jistě nemají [13]. Mezi tyto jednoduché (a levné) indexy patří např. tzv. APRI index (AST, trombocyty), NAFLD fibrosis skóre – NFS (věk, BMI, přítomnost DM2, ALT, AST, albumin, trombocyty) či FIB-4 skóre (ALT, AST, věk, trombocyty), z nichž NFS a FIB-4 jsou doporučovány k rutinnímu použití v běžné praxi [8]. Asi nejvíce univerzálním indexem je FIB-4, u kterého se v rozsáhlé klinické studii z poslední doby navíc ukázalo, že koreluje s histologickým stupněm fibrózy i v průběhu léčby NAFLD [14]. Vzhledem k narůstající četnosti NAFLD i rozšiřujícím se znalostem o vlivu jaterní fibrózy na celkovou mortalitu se ukazuje, že screening fibrózy je vhodné zavést do běžné praxe přinejmenším v rizikových skupinách. První metodou by měl být jednoduchý a levný index a při pozitivním nálezu by pak mělo následovat podrobnější vyšetření včetně jaterní elastografie [15].
Mezi rizikové skupiny patří pacienti s obezitou, DM2, ale riziko jaterní fibrózy stoupá i s věkem. Podobné rizikové faktory vedou i k dalším onemocněním, které ve vyšším věku řadíme do tzv. syndromu křehkosti (frailty syndrom). Jeho typickými projevy jsou např. časté orgánové dekompenzace a infekce, psychická labilita spojená s úbytkem kognitivních funkcí či zejména zvýšený sklon k pádům a frakturám, jako jsou například zlomeniny horního konce stehenní kosti (proximálního femuru). Ty vznikají v 90 % v terénu osteoporózy většinou úrazovým mechanizmem, a označují se tedy jako patologické. Patologickými frakturami jsou postiženy především ženy v postmenopauze a ve věku > 70 let – tvoří více než 2/3 nemocných s osteoporotickou zlomeninou proximálního femuru. Incidence pak narůstá exponenciálně s věkem z důvodu progrese osteoporózy a přidružených komorbidit. Onemocnění CNS, kardiovaskulárního systému, metabolické choroby včetně obezity zvyšují riziko pádu, který bývá nejčastější příčinou zlomeniny. Podle lokalizace se zlomeniny proximálního femuru dělí na zlomeniny intrakapsulární a extrakapsulární. Lokalizace zlomeniny a vztah ke kloubu má význam pro výběr léčebného postupu. Ke konzervativní léčbě je indikována pouze úzká skupina impaktních intrakapsulárních zlomenin, jinak je většinou metodou volby neodkladné operační řešení. Operačním řešením je buď náhrada kloubu, nebo stabilní osteosyntéza. Základním přínosem obou metod je minimalizace zánětové odpovědi organizmu a délky imobilizačního syndromu. Přítomnost chronické jaterní choroby může jednak přispívat ke „křehkosti“ jedinců staršího věku vedoucí k riziku pádů s následným úrazem [16] a jednak může znamenat horší prognózu při různých operačních výkonech.
Cílem retrospektivní studie bylo posoudit pomocí doporučovaných screeningových metod možnou přítomnost jaterní fibrózy v unikátní skupině pacientů operovaných pro zlomeninu proximálního femuru na I. chirurgické klinice VFN a 1. LF UK v Praze.
Metodika
Do retrospektivního hodnocení byla zařazena skupina pacientů operovaných na I. chirurgické klinice VFN a 1. LF UK za rok 2019 pro zlomeninu proximálního femuru. Rok 2019 byl zvolen, neboť se jednalo o poslední období, které nebylo ovlivněno současnou pandemií covidu-19. Klinická data, antropometrické údaje, laboratorní hodnoty a ultrazvukové nálezy byly získány z Nemocničního informačního systému (NIS) a pro další zpracování byly anonymizovány. Práce splňovala etické podmínky dle aktuálně platných podmínek Helsinské deklarace.
Skupina operovaných pacientů byla dále rozdělena podle typu zlomeniny/výkonu na dva podsoubory:
a) pacienty s intrakapsulární zlomeninou řešenou artroplastikou (CEP);
b) pacienty s extrakapsulární zlomeninou řešenou osteoyntézou (PFN).
Kontrolní skupinu tvořila skupina pacientů s diabetem sledovaných na ambulancích IV. interní kliniky VFN a 1. LF UK, pro které byly k dispozici stejné antropometrické údaje jako u operovaných pacientů [11].
Skórovací indexy pro riziko jaterní fibrózy byly počítány dle následujících vzorců: APRI [17] bylo vypočteno jako AST (IU/L/horní hranice normy AST/počet trombocytů (×109/l) × 100; FIB-4 skóre [18] podle vzorce: věk × AST (IU/l) / počet trombocytů (×109/l) × ALT (IU/l) a NAFLD fibrosis skóre [19] podle vzorce: –1,675 + 0,037 × věk (roky) + 0,094 × BMI (kg/m2) + 1,13 × porušená glukózová tolerance nebo diabetes (ano = 1, ne = 0) + 0,099 × poměr AST/ALT – 0,013 × počet trombocytů (×109/l) – 0,66 × albumin (g/dl).
Riziko přítomnosti jaterní fibrózy bylo dle výsledků skórovacích systémů hodnoceno následovně: NAFLD fibrosis skóre:
- žádná či mírná fibróza < –1,455;
- střední riziko mezi –1,455 a 0,675;
- riziko významné fibrózy či cirhózy > 0,675;
APRI skóre:
- žádná či mírná fibróza ≤ 0,5;
- střední riziko mezi 0,5 a 1,5;
- vysoké riziko cirhózy ≥ 1,5;
FIB-4 skóre:
- žádná či mírná fibróza < 1,45;
- střední riziko či neurčitý výsledek mezi 1,45 a 3,25;
- riziko významné fibrózy či cirhózy > 3,25.
Dle těchto hodnot byli pacienti rozděleni do skupin:
1. s minimální pravděpodobností přítomnosti fibrózy;
2. se středním rizikem či s neurčitým výsledkem;
3. s vysokou pravděpodobností přítomnosti významné jaterní fibrózy.
Statistické metody
Výsledky jsou vyjádřeny jako průměr ± standardní odchylka (SD), případně medián s rozsahem hodnot. Ke srovnání skupin byl použit t-test, ke srovnání četností v jednotlivých skupinách X2 test. Ke statistickému zpracování byl použit program STATISTICA 12 Cz (TIBCO Software Inc., USA).
Výsledky
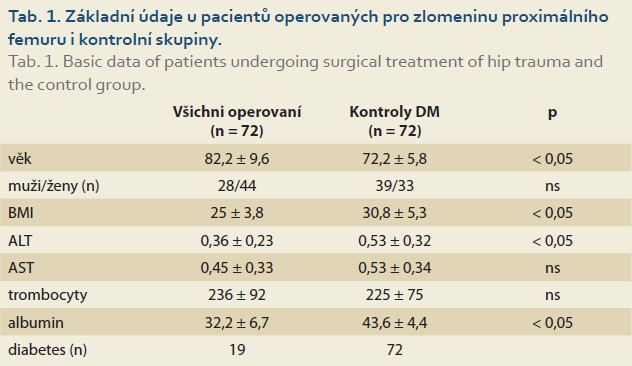
V retrospektivní analýze bylo hodnoceno celkem 72 pacientů operovaných v roce 2019 pro zlomeninu proximálního femuru na I. chirurgické klinice VFN a 1. LF UK. Operaci CEP prodělalo 30 pacientů a operaci PFN 42 pacientů. V kontrolní skupině bylo hodnoceno 72 pacientů s DM2. Základní klinická, antropometrická a laboratorní data jsou uvedena v tab. 1. Pacienti s diabetem se od operované skupiny lišili nižším věkovým průměrem, vyšší hodnotou BMI, vyšší aktivitou ALT a vyšší koncentrací sérového albuminu.
Výsledky jednotlivých indexů ukazujících na riziko přítomnosti jaterní fibrózy u pacientů operovaných pro zlomeninu proximálního femuru jsou uvedeny v tab. 2.
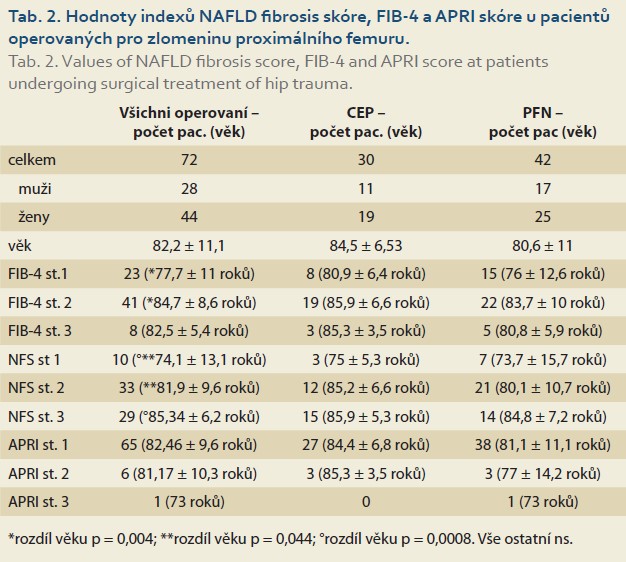
Pacienti s vysokým rizikem jaterní fibrózy (stupně 2 a 3) dle NAFLD fibrosis skóre i FIB-4 skóre byli významně starší oproti pacientům s nízkým rizikem fibrózy (st. 1). Tento rozdíl se týkal celé skupiny pacientů i skupin dle jednotlivých operací.
Srovnání počtu pacientů v riziku jaterní fibrózy mezi operovanými pacienty a kontrolní skupinou je uvedeno v tab. 3.
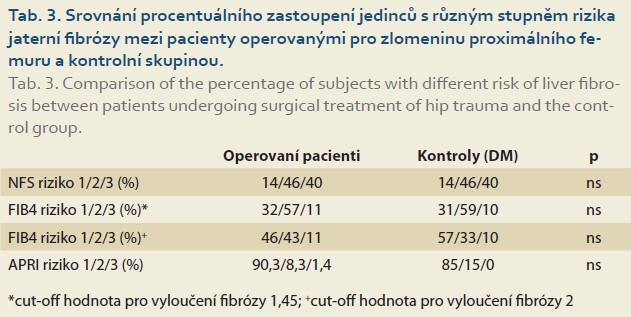
Ve skupině 72 operovaných pacientů mělo vysoké riziko přítomnosti jaterní fibrózy dle NAFLD fibrosis skóre celkem 29 pacientů a dle FIB-4 skóre celkem 8 pacientů. Srovnání mezi těmito dvěma skupinami ukázalo, že se z 87,5 % překrývají (tj. sedm z osmi pacientů hodnocených dle FIB-4 skóre s vysokým rizikem fibrózy bylo stejně hodnoceno i dle NAFLD fibrosis skóre).
Ultrazvukové vyšetření jater bylo k dispozici u 48 pacientů operovaných pro zlomeninu proximálního femuru. Jednalo se o náhodné vyšetření, které bylo zaznamenáno v intervalu ± 1 roku od operačního výkonu a nebylo primárně cíleno k ověření případné jaterní choroby. U 37 pacientů bylo ultrazvukové vyšetření jater hodnoceno jako normální, u 10 pacientů byla popsána jaterní steatóza a u 1 pacienta jaterní fibróza (u tohoto pacienta bylo NAFLD fibrosis skóre i FIB-4 skóre v pásmu rizika fibrózy stupně 2).
V kontrolní skupině pacientů s DM2 bylo ultrazvukové vyšetření jater k dispozici u 52 pacientů. Tato vyšetření byla primárně cílena na posouzení případné jaterní léze. U 30 pacientů byla popsána jaterní steatóza a u 7 pacientů těžká fibróza či cirhóza. Jaterní elastografie nebyla ve vyšetřovaných skupinách prováděna.
Diskuze
Naše studie si dala za cíl upozornit na skutečnost, že po přítomnosti jaterní fibrózy bychom měli pátrat nejen u pacientů, kteří přijdou k vyšetření pro známky jaterní léze (např. náhodně zjištěná patologie v jaterních testech), ale i mezi jedinci s diagnózami zdánlivě nesouvisejícími s jaterní chorobou. Naše závěry potvrzují skutečnost, že mezi jedinci, kteří nemají žádnou anamnézu jaterní choroby, je určité procento těch, kteří mohou mít „klinicky němou“ jaterní fibrózu [6].
Nabízí se otázka validity jednotlivých neinvazivních indexů ve starších věkových skupinách i využití v populaci, která nebyla původně pro použití těchto testů studována. Objevují se však práce, které se podobnou problematikou zabývají a využití neinvazivních testů v jednotlivých kohortách testují [20]. V retrospektivní studii provedené v USA na více než 27 000 subjektech ve věku > 60 let bylo stejnými neinvazivními indexy, jako jsme použili my, diagnostikováno 6,1 % pacientů s podezřením na pokročilou fibrózu. Toto riziko fibrózy bylo dokonce spjato s anamnézou mozkové příhody [21]. Stejně tak byl neinvazivní test FIB-4 využit ve studii na subjektech starších 60 let, v které bylo nalezeno 5 % pacientů s vysokým rizikem jaterní fibrózy a přítomnost fibrózy byla nezávislým rizikovým faktorem pro kognitivní postižení [22]. Se vzrůstajícím věkem klesá senzitivita i specificita indexů a v literatuře nepanuje úplná shoda na využití testů u starších pacientů. Například u indexu FIB-4 bylo navrženo ve věkové skupině > 65 let využít jinou hodnotu cut-off pro vyloučení významné fibrózy (namísto hodnoty FIB-4 < 1,45 použít hodnotu < 2) [23]. V naší práci uvádíme výsledky s oběma hodnotami – poměr pacientů s různým stupněm rizika jaterní fibrózy se ani tak významně nemění mezi vyšetřovanou skupinou a kontrolami. Není jasné, jak změnit případnou další cut-off hranici znamenající naopak existenci vysokého rizika přítomnosti významné fibrózy. Proto jsme použili hodnotu z původní práce popisující FIB-4 index < 3,25.
NAFLD fibrosis skóre zahrnuje též hodnotu albuminu, která může být u pacientů s traumatem snížena v důsledku systémové zánětlivé reakce a ne jaterní choroby. Stejně tak může být hodnota albuminu u starších pacientů snížena v důsledku chronických onemocnění a malnutrice. U našich pacientů byla hodnota albuminu skutečně významně nižší než u kontrolní skupiny. NAFLD fibrosis skóre tak pravděpodobně není vhodným nástrojem k detekci případné jaterní fibrózy u pacientů ve vyšším věku s dalšími zdravotními komplikacemi. Naproti tomu index FIB-4 pracuje s parametry, které jsou zdravotními komplikacemi ovlivněny méně, a i při zahrnutí věku je pravděpodobně pro tuto skupinu pacientů vhodnější. Index APRI má dle literárních údajů nejnižší senzitivitu i specificitu pro záchyt případné jaterní fibrózy a pro starší pacienty s mnoha přidruženými chorobami není validován vůbec a pravděpodobně není vhodný. FIB-4 je navíc považován za prediktor nejen mortality z jaterních příčin a hepatocelulárního karcinomu, ale i kardiovaskulárních onemocnění, chronického ledvinného postižení a mimojaterních malignit.
Studie má několik limitací. Jednalo se o retrospektivní studii využívající neinvazivní indexy rizika jaterní fibrózy. Limitací je i skutečnost, že neinvazivní indexy nebyly primárně vyvinuty ke screeningu v nízkorizikové populaci. Srovnání se skupinou z pohledu jaterní fibrózy rizikovou (pacienti s diabetem) však ukazuje, že procentuální zastoupení jednotlivých skupin je téměř totožné. Při využití FIB-4 skóre jsme v operované skupině nalezli 11 % pacientů s vysokým rizikem jaterní fibrózy (mezi kontrolní skupinou diabetiků to bylo 10 %). V jiných pracích, které screeningově využívaly neinvazivní parametry k nalezení pacientů s jaterní fibrózou, jsou častěji uváděny o něco nižší hodnoty – mezi 5 a 7 % populace má klinicky němou jaterní fibrózu. Naše výsledky mohou souviset s věkem pacientů, který byl v naší skupině vyšší než v jiných studovaných populacích, ale stejně tak to může být dáno složením pacientů, kteří prodělají úraz proximálního femuru. Bylo například publikováno, že jaterní fibróza je spjata s tzv. křehkostí seniorů [24]. Na tuto otázku by mohl dát odpověď následný dlouhodobý follow-up vyšetřované skupiny.
Absence následného follow-up je tedy další limitací naší studie, navíc pacienti by měli být vyšetření metodou jaterní elastografie k ověření přítomnosti jaterní fibrózy.
V naší skupině není také detailně hodnocena etiologie suspektní jaterní fibrózy. V dostupné dokumentaci v NIS nebyla zaznamenána případná pozitivita sérologie hepatitidy B či C, etiologicky se tak nejspíše jednalo o souvislost s NAFLD, abúzem alkoholu či o kombinaci obou faktorů. V době operace nebyl žádný pacient hodnocen jako těžký aktivní abúzer alkoholu.
Závěr
Závěrem lze konstatovat, že přítomnost klinicky němé jaterní fibrózy je vysoce pravděpodobná až u 1/10 pacientů operovaných pro frakturu proximálního femuru. Využití jednoduchých a levných indexů umožní tyto rizikové pacienty odhalit a indikovat k podrobnému vyšetření případného pokročilého chronického jaterního onemocnění.
ORCID autorů
M. Sedlář ORCID 0000-0003-1231-3752,
V. Šmíd ORCID 0000-0002-8664-7918,
R. Brůha ORCID 0000-0001-9924-4301,
P. Dytrych ORCID 0000-0003-2124-6766.
Doručeno/Submitted: 16. 3. 2022
Přijato/Accepted: 29. 3. 2022
MUDr. Martin Sedlář, Ph.D.
I. chirurgická klinika
1. LF UK a VFN v Praze
U Nemocnice 2
128 08 Praha 2
martin.sedlar@vfn.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Guo J, Friedman SL. Hepatic fibrogenesis. Semin Liver Dis 2007; 27(4): 413–426. doi: 10.1055/s-2007-991517.
2. Rosselli M, MacNaughtan J, Jalan R et al. Beyond scoring: a modern interpretation of disease progression in chronic liver disease. Gut 2013; 62(9): 1234–1241. doi: 10.1136/gutjnl-2012- 302826.
3. Hagström H, Kechagias S, Ekstedt M. Risk for hepatic and extra-hepatic outcomes in nonalcoholic fatty liver disease. J Intern Med 2021. doi: 10.1111/joim.13343.
4. Dulai PS, Singh S, Patel J et al. Increased risk of mortality by fibrosis stage in nonalcoholic fatty liver disease: systematic review and meta-analysis. Hepatology 2017; 65(5): 1557–1565. doi: 10.1002/hep.29085.
5. Younossi ZM, Stepanova M, Rafiq N et al. Nonalcoholic steatofibrosis independently predicts mortality in nonalcoholic fatty liver disease. Hepatol Commun 2017; 1(5): 421–428. doi: 10.1002/hep4.1054.
6. Roulot D, Costes JL, Buyck JF et al. Transient elastography as a screening tool for liver fibrosis and cirrhosis in a community-based population aged over 45 years. Gut 2011; 60(7): 977–984. doi: 10.1136/gut.2010.221382.
7. European Association for the Study of the Liver, European Association for the Study of Diabetes, European Association for the Study of Obesity. EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J Hepatol 2016; 64(6): 1388–1402. doi: 10.1016/j.jhep.2015.11.004.
8. Chalasani N, Younossi Z, Lavine JE et al. The diagnosis and management of nonalcoholic fatty liver disease: practice guidance from the American Association for the Study of Liver Diseases. Hepatology 2018; 67(1): 328–357. doi: 10.1002/hep.29367.
9. Vernon G, Baranova A, Younossi ZM. Systematic review: the epidemiology and natural history of non-alcoholic fatty liver disease and non-alcoholic steatohepatitis in adults. Aliment Pharmacol Ther 2011; 34(3): 274–285. doi: 10.1111/j.1365-2036.2011.04724.x.
10. Younossi ZM, Koenig AB, Abdelatif D et al. Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence, incidence, and outcomes. Hepatology 2016; 64(1): 73–84. doi: 10.1002/hep.28431.
11. Dvorak K, Hainer R, Petrtyl J et al. The prevalence of nonalcoholic liver steatosis in patients with type 2 diabetes mellitus in the Czech Republic. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2015; 159(3): 442–448. doi: 10.5507/bp.2014.033.
12. Kleiner DE, Brunt EM, Van Natta M et al. Design and validation of a histological scoring system for nonalcoholic fatty liver disease. Hepatology 2005; 41(6): 1313–1321. doi: 10.1002/hep.20701.
13. Vilar-Gomez E, Chalasani N. Non-invasive assessment of non-alcoholic fatty liver disease: clinical prediction rules and blood-based biomarkers. J Hepatol 2018; 68(2): 305–315. doi: 10.1016/j.jhep.2017.11.013.
14. Chalasani N, Abdelmalek MF, Loomba R et al. Relationship between three commonly used non-invasive fibrosis biomarkers and improvement in fibrosis stage in patients with non-alcoholic steatohepatitis. Liver Int 2019; 39(5): 924–932. doi: 10.1111/liv.13974.
15. Sumida Y, Yoneda M, Tokushige K et al. FIB-4 first in the diagnostic algorithm of metabolic-dysfunction-associated fatty liver disease in the era of the global metabodemic. Life (Basel) 2021; 11(2): 143. doi: 10.3390/life11020143.
16. Loosen SH, Roderburg C, Demir M et al. Non-alcoholic fatty liver disease (NAFLD) is associated with an increased incidence of osteoporosis and bone fractures. Z Gastroenterol 2021. doi: 10.1055/a-1482-9236.
17. Wai CT, Greenson JK, Fontana RJ et al. A simple noninvasive index can predict both significant fibrosis and cirrhosis in patients with chronic hepatitis C. Hepatology 2003; 38(2): 518–526. doi: 10.1053/jhep.2003.50346.
18. Vallet-Pichard A, Mallet V, Nalpas B et al. FIB-4: an inexpensive and accurate marker of fibrosis in HCV infection. Comparison with liver biopsy and fibrotest. Hepatology 2007; 46(1): 32–36. doi: 10.1002/hep.21669.
19. Angulo P, Hui JM, Marchesini G et al. The NAFLD fibrosis score: a noninvasive system that identifies liver fibrosis in patients with NAFLD. Hepatology 2007; 45(4): 846–854. doi: 10.1002/hep.21496.
20. Xiao G, Zhu S, Xiao X et al. Comparison of laboratory tests, ultrasound, or magnetic resonance elastography to detect fibrosis in patients with nonalcoholic fatty liver disease: a meta-analysis. Hepatology 2017; 66(5): 1486–1501. doi: 10.1002/hep.29302.
21. Parikh NS, VanWagner LB, Elkind MSV et al. Association between nonalcoholic fatty liver disease with advanced fibrosis and stroke. J Neurol Sci 2019; 407: 116524. doi: 10.1016/j.jns.2019.116524.
22. Parikh NS, Kumar S, Rosenblatt R et al. Association between liver fibrosis and cognition in a nationally representative sample of older adults. Eur J Neurol 2020; 27(10): 1895–1903. doi: 10.1111/ene.14384.
23. McPherson S, Hardy T, Dufour JF et al. Age as a confounding factor for the accurate non-invasive diagnosis of advanced NAFLD fibrosis. Am J Gastroenterol 2017; 112(5): 740–751. doi: 10.1038/ajg.2016.453.
24. Zupo R, Castellana F, Donghia R et al. Liver frailty and all-cause mortality in the older participants of the Salus in Apulia Study. Geroscience 2021. doi: 10.1007/s11357-021-004 34-x.