Poškození žlučových cest kadaverózních dárců před odběrem jater - jakou roli hraje smrt mozku dárce?
Miloslav Adamec, Štefan Vítko Orcid.org , Pavel Trunečka1, Vladimír Teplan Orcid.org 2,3,4, František Šmíd, Jaroslava Šmídová, Zdeněk Mareček Orcid.org , Eva Pokorná Orcid.org , Olga Marečková5
+ Pracoviště
Souhrn
Úvod: Důležitou roli při vzniku intrahepatálních biliárních komplikací po ortotopické transplantaci jater (OTJ) z kadaverózních dárcù hraje poškození žluèových cest před OTJ.
Cíl studie: Cílem bylo zjistit, zda poškození epitelu žlučových cest je přítomné již při odběru jater z kadaverózního dárce.
Materiál a metodika: U 37 kadaverózních dárců byly vzorky žlučových cest vyšetřeny imunohistochemicky a stanovena aminopeptidáza M (APM).
Výsledky: Poškození žlučových cest spojené s uvolněním APM z buněk epitelu bylo prokázáno u 25 dárců, zachovaný epitel s lokalizací APM intracelulárně u 12 dárců. Při porovnání obou skupin kadaverózních dárců byl statistický významný rozdíl v délce pobytu na jednotce intenzivní péče (JIP): 4, 36 ± 1,92 dnů u dárců s poškozením žlučových cest a 2,83 ± 1,27 dnů u dárců bez poškození žlučových cest, p < 0,02. Významným zjištěním byla skutečnost, že u živých příjemců jater imunohisto chemické vyšetření žlučových cest prokázalo nepoškozený epitel žlučových cest s AMP uloženou jen intracelulárně.
Závěr: Poškození žlučových cest bylo prokazatelné u dvou třetin kadaverózních dárců již v době odběru dárcovských jater. U těchto nemocných byl delší pobyt na JIP v předoperačním období. Nepřítomnost poškození žlučových cest u živých příjemců jater prokázalo, že hlavní roli hrála smrt mozku dárce.
Klíčová slova: biliární leze - kadaverózní dárce - smrt mozku - transplantace jater.
Úvod
Již Starzl označil po prvních úspěšných ortotopických transplantacích jater (OTJ) žlučové cesty za Achillovu patu OTJ. I když se od té doby hodně změnilo, výskyt biliárních komplikací po OTJ se pohybuje mezi stále mezi 5-19%(1,2). Důležitou roli při vzniku těchto komplikací hraje poškození žlučových cest před OTJ. V literatuře jsou popsány změny na žlučových cestách dárců vznikající v období konzervace a reperfuze jater(3,4). Tyto změny mohou být ovlivněny i stavem dárce(5-7). Cílem předkládané práce je zjistit, zda poškození žlučových cest je u některých kadaverózních dárců přítomno již při odběru orgánu, které faktory ze strany dárce se mohou uplatňovat při jeho vzniku a jakou roli hraje smrt mozku dárce.
Materiál a metodika
Soubor kadaverózních dárců jater
Soubor tvořilo 37 dárců, průměrný věk 27,2 roků (8-45 roků), 22 mužů, 15 žen. Příčinou smrti bylo poranění hlavy u 25 dárců, ruptura mozkového aneuryzmatu u 6 dárců, spontánní mozkové krvácení u 4 dárců, jiné příčiny u 2 dárců. Odběr vzorků žlučových cest se prováděl peroperačně při odběru jater pro OTJ.
Kontrolní skupinu tvořilo 30 živých příjemců jater, průměrný věk 29, 5 roků (19-50), 19 mužů all žen. Odběr vzorků žlučových cest se prováděl peroperačně, při vynětí selhaných jater.
Odběr vzorkù žluèových cest
Odběr se prováděl peroperačně. Vzorky na imunohistochemické vyšetření byly odebrány ze 3 míst žlučových cest - fundus a tělo žlučníku a z ductus cysticus. Vzorky byly ihned zmrazený dále uvedeným způsobem.
Imunohistochemické vyšetøení vzorkù žluèových cest
Vzorky odebrané peroperačně se ihned zmrazují petroléterem ochlazeným směsí suchého ledu a acetonu. Histochemická detekce aktivity aminopeptidázy M se provádí metodou dle Lojdy(8) na nativních kryostatových řezech ze vzorků zmrazené tkáně.
Abychom zjistili, zda je enzym skutečně vyplavován z poškozené tkáně, nebo pouze inaktivován, bylo vyšetření doplněno imunohistochemickým stanovením aminopeptidázy M, které se provádí za použití sekundární protilátky proti myší IgG konjugované s alkalickou fosfatázou (Sigma) a myší monoklonální protilátky anti-CD13 IgGl (Serotec, UK). Tato protilátka rozpoznává glykoprotein o molekulové váze 150 kDa, mající aktivitu APM a reaguje i s APM v epitelu žlučových cest. K závěrečné barevné reakci byl použit jako substrát Fast Red TR/naphtol AS-MX fosfát (Sigma). Po provedené reakci se preparáty dobarvují hematoxylinem. Preparáty jsou hodnoceny dle jednotných kritérií. Je posuzována: a) zachovalost sliznice (zachovalý slizniční relief, různý stupeň jeho atrofie), b) stupeň poškození buněk epitelu (procento povrchu zachovalého epitelu), c) aktivita enzymů v typických úsecích zachovalého epitelu - obnažených řas, recesů řas, Rokitanskiho sinusů, d) aktivita enzymů v proprii pod epitelem - v leukocytech, T-lymfocytech a e) aktivita enzymů ve žluči, která ulpěla v preparátu nad sliznicí.
Dle těchto kritérií jsou nálezy rozděleny do 3 stupňů:
Těžké poškození epitelu: Slizniční reliéf je silně poškozen, plocha nepoškozeného epitelu je méně než 10 %, v buňkách epitelu je prakticky nulová enzymová aktivita. Pouze v Rokitanského sinusech nacházíme stopy enzymové aktivity v epitelu a zánětlivý infiltrát s aktivitou APM v leukocytech a makrofázích. Jsou zde i aktivované leukocyty a T-lymfocyty. V proprii je chronický zánět se silně aktivovanými T-lymfocyty.
Středně těžké poškození epitelu: Slizniční reliéf je nepravidelný, řasy jsou nízké, se sklonem k atrofii. Procento plochy nepoškozeného epitelu je mezi 10-50 %. Enzymová aktivita v buňkách epitelu je zachována především v recesech, a to 30-70 % aktivity, a v Rokitanského sinusech, kde je 80-100% zachované aktivity. Aktivní leukocyty jsou mírně zmnoženy v povrchovém epitelu.
Zachovalý nebo mírně poškozený epitel: Slizniční reliéf je jen místy nepravidelný, procento plochy zachovaného epitelu je 50-100 %. Enzymová aktivita je zachována i v odkrytém epitelu, nejvíce je jí však v recesech a v Rokitanského sinusech - až 100 %.
Faktory, které se mohou podílet na poškození žluèových cest dárce
U dárců jater byl hodnocen vliv těchto faktorů: věk, pohlaví, tělesná hmotnost, příčina smrti, doba pobytu na JIP, hypotenze, kardiopulmonální resuscitace, doba umělé ventilace, doba totální parenterální výživy, podání léků s vazokonstrikčním účinkem a abúzus alkoholu (dle anamnestických údajů).
Statistické metody
Data byla zpracována v statistickém programu Medcalc a Microsoft Excel. Výsledky jsou vyjádřeny jako průměr ± SD. Pro hodnocení rozdílů mezi skupinami byl použit dvouvýběrový t-test, chi-kvadrát test, Fisherův přesný test a mnohorozměrná logistická regrese. Výsledky jsou považovány za statisticky významné při p < 0,05.
Výsledky
Skupina kadaverózních dárcù
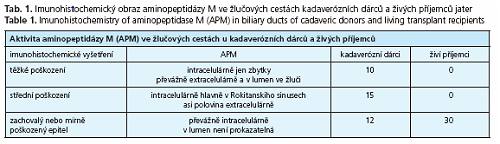
Histochemické vyšetření vzorků žlučových cest prokazuje rozdílný stupeň poškození epitelu. Na základě hodnocení dle výše uvedených kritérií lze nálezy u dárců rozdělit do tří skupin: 1. skupina (10 dárců) těžké poškození epitelu žlučových cest; 2. skupina (15 dárců) - středně těžké poškození; 3. skupina (12 dárců) - zachovalý nebo mírně poškozený epitel žlučových cest
Kontrolní skupina živých pøíjemcù jater
Histochemické vyšetření vzorků žlučových cest prokazuje zachovalý nebo mírně poškozený epitel žlučových cest u všech 30 živých příjemců jater.
Porovnání APM u obou skupin
Lokalizace APM zjištěná imunohistochemicky odpovídala u obou skupin vcelku lokalizaci její aktivity zjištěné histochemicky dle Lojdy. Reagovala apikální zóna (membrána epitelu) a o něco slaběji bazální membrána. V proprii reagovaly neutrofilní leukocyty.
Ve skupině kadaverózních dárců se však ukázaly rozdíly v množství konečného produktu. Největší rozdíly mezi enzymovou aktivitou APM stanovenou histochemicky dle Lojdy a imunohistochemickým stanovením APM byly na povrchu poškozeného epitelu žlučových cest. To svědčí o ztrátě enzymové aktivity APM v buňách poškozeného epitelu a uvolňováním APM do žluče.
Naproti tomu u kontrolní skupiny živých příjemců jater jsme neprokázali rozdíly mezi enzymovou aktivitou APM stanovenou histochemicky a APM stanovenou imunohisto chemicky. To svědčí o tom, že na rozdíl od kadaverózních dárců epitel u živých příjemců není poškozen a APM není uvolňována do žluče. Z výsledků dále vyplývá, že APM je citlivým indikátorem poškozeníepitelu žlučových cest kadaverózního dárce.
Výsledky vyšetření APM u obou vyšetřovaných skupin jsou přehledně shrnuty v tabulce 1.
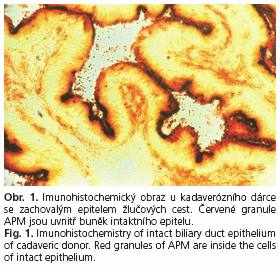
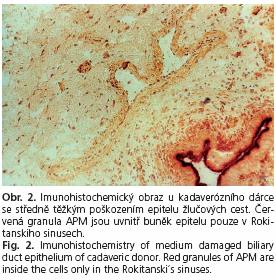
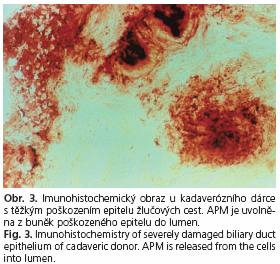
Příklady imunohisto chemického obrazu epitelu žlučových cest jsou na následujících obrázcích. Obrázek 1 ukazuje obraz u kadaverózního dárce se zachovalým epitelem. Červená granula aminopeptidázy M jsou uvnitř buněk intaktního epitelu. U tohoto dárce nebyly prokázány významné rozdíly mezi enzymovou aktivitou APM stanovenou histochemicky a APM stanovenou imunohistochemicky. Obrázek 2 znázorňuje imunohistochemicky nález na žlučových cestách u kadaverózního dárce se středně těžkým poškozením epitelu. Červená granula aminopeptidázy M jsou intracelulárně pouze v zachovaném epitelu v Rokitanskiho sinusu. Těžké poškození epitelu žlučových cest u kadaverózního dárce je na obrázku 3.
Aminopeptidáza M je uvolněná z poškozených buněk epitelu do lumen. U dárců na obrázku 2 a 3 byly významné rozdíly mezi enzymovou aktivitou APM stanovenou histochemicky a APM stanovenou imunohistochemicky.
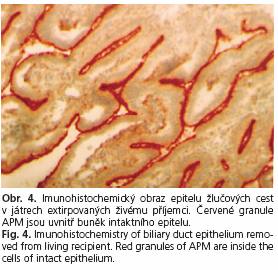
Příklad imunohistochemického obrazu epitelu žlučových cest u živého příjemce jater je na obrázku 4. Červená granula aminopeptidázy M jsou v celém epitelu lokalizována intracelulárně. Aminopeptidáza M se u kontrolní skpiny živých příjemců jater z buněk epitelu do lumen neuvolňovala.
Možné rizikové faktory pro poškození epitelu žluèových cest u kadaverózních dárcù
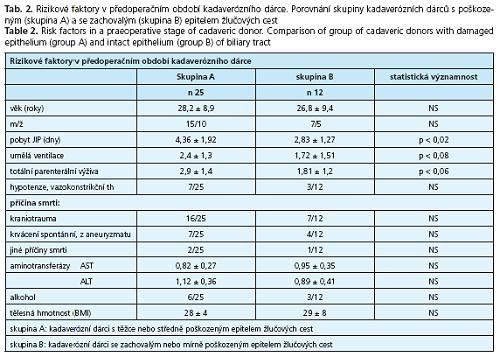
Dárci byli rozdělení na 2 skupiny: skupina A - s poškozením žlučových cest (25 dárců), skupina B - se zachovalým epitelem žlučových cest (12 dárců) a obě skupiny byly srovnávány zda se liší v některém z těchto faktorů: věk, pohlaví, hypotenze a resuscitace, doba pobytu na jednotce intenzivní péče (JIP), průměrný počet dní na umělé ventilaci a totální parenterální výživě (TPV), laboratorní výsledky: jaterní aminotransferázy v séru a natrium v séru, příčina smrti, abúzus alkoholu, tělesná hmotnost. Výsledky jsou uvedeny v tabuce 2.
Jediným faktorem, ve kterém se obě skupiny kadaverózních dárců významně liší, je délka pobytu na JIP. Při hodnocení jsme použili i mnohorozměrnou logistickou regresi. Nebyl prokázán statisticky významný vliv žádné ze sledovaných veličin.
Diskuze
Žlučové cesty jsou velice zranitelné a riziko jejich poškození je po OTJ i v předtransplantačním období. Výskyt biliárních komplikací po OTJ se pohybuje mezi 11-19 % a významně se podílí na morbiditě a mortalitě nemocných po OTJ(1,2,9,10).
Intrahepatální biliární leze, které se vyznačují neanastomotickými stenózami (NAS-non-anastomotic strictures) a dilatacemi ve štěpu, vznikají někdy časně po operaci, v 1.- 4. měsíci po OTJ(1). Mohou se však vyskytnout i 6-9 měsíců po OTJ(2). Osud transplantovaných nemocných, především závažnost biliárních komplikací ve vztahu k poškození žlučových cest kadaverózních dárců v naší studii dále sledujeme a zhodnotíme po uplynutí 1 roku, zatím je doba sledování krátká.
V literatuře je několik prací, které prokazují, že na vzniku intrahepatálních biliárních lézí se podílí i období před OTJ, především protrahováná studená ischémie a reperfuzní poškození(1,2,9,10).
Jen ojediněle se však objevují práce prokazující, že důležitou roli hraje i předoperačním období dárce - před odběrem orgánu. Rull et al. prokázali u nemocných s neanastomotickými strikturami žlučových cest po OTJ významně delší dobu pobytu dárců na JIP(6). To by znamenalo, že žlučové cesty by mohly být postiženy již před odběrem jater, tedy v předoperačním období dárců. O průkazu tohoto poškození jsme nezjistili v dostupné literatuře žádné údaje. Naše výsledky jsou v tomto smyslu prioritní a přinášejí do celé problematiky nový pohled, protože prokazují poškození žlučových cest již při odběru dárcovských jater. Tato skutečnost by znamenala, že prevence těchto změn by měla být u kadaverózního dárce již před odběrem orgánu.
Pokud se v literatuře zmiňují rizikové faktory, které se uplatňují v předoperačním období dárce (před odběrem orgánu), jsou hodnoceny ve vztahu k rozvoji funkce jater, ne ve vztahu k poškození žlučových cest. V tomto smyslu jsou jako rizikové uváděny především doba pobytu na JIP, doba řízené ventilace a totální parenterální výživy. Vliv totální parenterální výživy na složení žluče a porušenou evakuaci žlučníku s následnou stázou žluče dokumentuje řada prací. Jako řešení je zvažována podpůrná enterální výživa a stimulace sekrece žluče a evakuace žlučníku(11-13). Jiné východisko ukazují práce Hertla et al, kteří prokázali, že podání tauroursodeoxycholové kyseliny (TUDCA) intravenózně dárci při odběru orgánu a příjemci při transplantaci zmírňuje reperfuzní poškození v experimentu, a to jak poškození jaterních buněk, tak i epitelu choledochu(12).
Otázka vlivu smrti mozku je dalším závažným faktorem, který se může podílet na poškození všech dárcovských orgánů, tedy i jater a žlučových cest. Smrt mozku dárce je provázena významnými změnami hemodynamiky, endokrinního systému a morfologickými změnami, s následnou aktivací cytokinů. Pravděpodobnou příčinou cytokinové aktivace je hypoperfuze orgánů vyvolaná autonomní bouří - vyplavením velkého množství endogenních katecholaminů(14). Ischémii je připisováno i uvolnění cytokinů a volných radikálův dárcovském orgánu během studené ischémie a reperfuzního poškození, v souvislosti s tím uvažují někteří autoři o ochranném účinku antioxidačně působících látek(15).
Kladli jsme si otázku, zda obdobné změny, jaké jsme nalezli na žlučových cestách kadaverózních dárců, budou prokazatelné i na žlučových cestách živých osob. Skutečnost, že ve skupině živých příjemců jater se obdobné změny na žlučových cestách extirpovaných jater nepodařilo prokázat, potvrzuje naši hypotézu, že se jedná o změny typické pro kadaverózní dárce a smrt mozku hraje zřejmě významnější roli než všechny ostatní rizikové faktory v předoperačním období dárce, ze kterých jsme jako významný prokázali pouze délku pobytu na JIP.
Tyto výsledky, ukazující na dominantní vliv smrti mozku na poškození žlučových cest dárce již před odběrem orgánu, mění i celý přístup k možným ochranným opatřením, která by se měla provádět v období před odběrem jater z kadaverózních dárců. Je prokázán příznivý účinek steroidů podaných kadaveróznímu dárci s prokázanou smrtí mozku před vynětím orgánu. Léčba dárce steroidy vedla k potlačení exprese prozánětlivých cytokinů na hodnoty nalézané u živých dárců(16). Kortikoidy snižují nejen prozánětlivý stav štěpu, ale i jeho imunogenicitu, a tím přispívají ke zlepšení jeho kvality a funkce(17). Vysokou citlivost žlučových cest na ischemické poškození potvrzuje i zvýšený výskyt biliárních komplikací a ischemické cholangiopathie po OTJ ve štěpech odebraných dárcům se srdeční zástavou - non-heart beating donors(18,19).
Závěr
Při imunohistochemickém vyšetření žlučových cest kadaverózních dárců jsme zjistili poškození žlučových cest u dvou třetin dárců již v době odběru jater. Typickou změnou bylo uvolnění APM z poškozených buněk epitelu. Při zhodnocení možných rizikových faktorů v předoperačním období byla u skupiny dárců s poškozením žlučových cest významně delší doba pobytu na JIP než u skupiny bez poškození žlučových cest. Nepřítomnost poškození žlučových cest spojeného s uvolněním intracelulárně uložené APM u živých příjemců jater ukázalo, že změny nalezené při odběru jater u kadaverózních dárců jsou typické pro kadaverózní dárce a smrt mozku hraje při jejich vzniku zřejmě významnější roli než všechny ostatní rizikové faktory v předoperačním období dárce.
Literatura
- 1. Rull R, Valdecasas JCG, Grande L, et al. Intrahepatic biliary lesions after orthotopic liver transplantation. Transpl Int 2001; 14: 129-134.
- 2. Guichelaar MMJ, Benson JT, Malinchoc M, et al.Risk Factors for Clinical Course of Non-Anastomotic Biliary Strictures after Liver Transplantation. Am J Transplantation 2003; 3: 885-890.
- 3. Busquets J, Fugueras J, Serrano T, et al. Postreperfusion biopsy changes predict biliary complications after liver transplantation. Trnaplantation Proceedings 2002; 34: 229-230.
- 4. Kang KJ. Mechanism of Hepatic Ischemia/Reperfusion Injury and Protection against Reperfusion Injury. Transplant Proc 2002; 34: 2659-2661.
- 5. Briceno J, Marchal T, Padillo J, et al. Influence of Marginal Donors on liver preservation injury. Transplantation 2002; 74: 522-526.
- 6. Rull R, Valdecasas JCG, Momblan D, et al. Evaluation of potenciál liver donors: expanding donor criteria? Transplantation Proceedings 2002; 34: 229-230.
- 7. Marečková O, Pokorná E, Ryska M, et al. Vliv předoperačního období na poškození žlučových cest kadaverózních dárců jater. Bulletin HPB 2004; 12: 10-13.
- 8. Lojda Z, Gossrau G, Steward PJ. Proteases. In: Histochemistry, theoretical and applied. IVth edition Steward PJ and Pease AGE, eds. Edinburgh-London-New York: Churchil and Livingstone 1991; 281-335.
- 9. Sanchez-Urdazpal L, Gorez G, Ward E. Ischemic-type biliary complications after orthotopic liver transplantation. Hepatology 1992; 16: 49-53.
- 10. Fisher A, Miller C. Ischemic-type biliary strictures in liver allografts: the achilles heel revisited? Hepatology 1995;21:589-591.
- 11. Beau P, Labat-Labourdette J, Ingrand P, Beauchant M. Is ursodeoxycholic acid an effective therapy for total parenteral nutrition-related disease? J Hepatol 1994; 20: 240-244.
- 12. Hertl M, Hertl MC, Kunkel P, et al. Tauroursodeoxycholate ameliorates reperfusion injury after pig liver transplantation. Transpl Int 1999; 12: 454-462.
- 13. Falasca L, Tisone G, Palmieri G, et al. Protective role oftauroursodeoxycholate during harvesting and cold storage of human liver:a pilot study in transplant recipients. Transplantation 2001; 71: 1205-1209.
- 14. Gerlach J, Jorres A, Nohr R, et al. Local liberation of cytokines during liver preservation. Transpl Int 1999; 12: 261-265.
- 15. Chavez-Cartaya R, Jamieson NV, Ramirez P, et al. Free radical scavengers to prevent reperfusion injury following experimental warm liver ischemia. Is there a real physiological benefit? Transpl Int 1999; 12: 213-221.
- 16. Kuecuek O, Mantouvalou L, Klemz R, et al. Significant reduction of proinflammatory cytokines by treatment of the brain-dead donor. Transplantation Proceedings 2005; 37: 387-388.
- 17. Pratsche J, Neuhaus P, Tullius SG. What can be learned from brain-death models? Transplant Int 2005; 18: 15-21.
- 18. Cameron AM, Busuttil RW Ischemic cholangiopathy after liver transplantation. Hepatobiliary Pancreatic Diseases Int 2005; 4: 495-501
- 19. Abt P, Crawford M, Desai N, Markmann J. Liver transplantation from controlled non-heart-beating donors: an increased incidence of biliary complications. Transplantation 2003; 75: 1659-1663.
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené