Porucha signalizácie dráhy IL-10 a nešpecifické črevné zápalové ochorenie s veľmi včasným nástupom
Renata Szépeová Orcid.org 1, Zuzana Havlíčeková Orcid.org 2, Peter Lietava3, Peter Bánovčin Orcid.org 4, Miloš Jeseňák Orcid.org 1
+ Pracoviště
Souhrn
Medzi pacientmi s nešpecifickými črevnými zápalovými ochoreniami majú špecifické postavenie jedinci s nástupom príznakov pred druhým rokom života. Jedná sa o heterogénnu skupinu ochorení, ktoré majú často odlišnú etiopatogenézu, fenotyp, odpoveď na liečbu aj prognózu v porovnaní s ochoreniami, ktoré vzniknú v staršom detskom veku alebo dospelosti. V tejto vekovej skupine je potrebné vylúčiť predovšetkým ochorenia, ktoré môžu svojimi klinickými prejavmi imitovať nešpecifické črevné zápalové ochorenia, ako aj primárne imunodeficiencie. Autori prezentujú kazuistiku pacientky s veľmi včasným nástupom IBD nereagujúcej na konvenčnú liečbu, u ktorej bola potvrdená mutácia génu pre podjednotku receptora pre IL-10 (IL-10R).
Klíčová slova
dítě, idiopatické střevní záněty, interleukin-1, interleukin-10 receptorÚvod
Autori prezentujú kazuistiku pacientky s veľmi včasným nástupom Crohnovej choroby (CN; strikturujúcej a penetrujúcej formy s perianálnym postihnutím) nereagujúcej na konvenčnú liečbu, ktorá bola na našom pracovisku sledovaná od prvého roku života.
Kazuistika
Dieťa kaukazskej rasy pochádzalo z konsangvinného manželstva a jeho dvaja starší súrodenci na prelome 80.–90. rokov 20. storočia exitovali pred prvým rokom života na komplikácie bližšie neurčeného nešpecifického črevného zápalového ochorenia (IBD – inflammatory bowel disease), ďalší dvaja súrodenci aj rodičia sú zdraví. Pre enterorágiu a pozitívnu rodinnú anamnézu na IBD bolo v druhom mesiaci realizované kolonoskopické vyšetrenie, na základe ktorého vyslovené podozrenie na CN. Klinický priebeh komplikovaný vznikom secernujúcich fistúl (rektolabiálne, rektovaginálna). Do prvého roka mala v liečbe 5-ASA, systémové kortikosteroidy, azatioprin, antibiotiká, vo výžive aminokyselinovú formulu. Pre sérologicky potvrdenú cytomegalovirovú infekciu bola ordinovaná virostatická liečba.
Vo veku 13. mesiacov bola po prvýkrát vyšetrená na našom pracovisku v roku 2006. Pri prijatí bola hmotnostne tesne nad 10. percentilom, pri vyšetrení dominovali secernujúce rektolabiálne fistuly, fyziologický objektívny nález na bruchu, afebrilná. Vo vstupných laboratórnych vyšetreniach boli zaznamenané mierne zvýšené nešpecifické zápalové parametre (FW 24/58, mukoproteíny 512 mmol/l, aj keď CRP bolo vo fyziologickom rozmedzí 0,9 mg/l), v krvnom obraze leukocytóza s neutrofíliou (leukocytóza 18,31 × 109/l), anémia mierneho stupňa (Hb 113 g/l), trombocytóza (920 × 109/l), základné biochemické parametre boli až na miernu hypercholesterolémiu (5,51 mmol/l) vo fyziologickom rozmedzí. Vzhľadom k včasnému nástupu ochorenia boli vyšetrené aj základné imunologické parametre s nálezom mierne znížených IgA (0,15 g/l), fagocytárnej aktivity (11 %) pri normálnom indexe avidity, znížený počet NK buniek, pričom ostatné základné parametre špecifickej bunkovej imunity boli fyziologické. Výsledky ostatných doplňujúcich laboratórnych vyšetrení boli negatívne (ANA, p-ANCA, protilátky proti tkanivovej transglutamináze IgA, IgG, celkové a špecifické potravinové IgE). Realizované bolo kontrolné kolonoskopické vyšetrenie s nálezom perianálnych pseudokondylómov a ústí fistúl (perianálne, perirektálne, anovestibulárna a rektovaginálna) s vytekajúcim hnisom, s postihnutím rekta, colon descendens a transverzum (lineárne ulcerácie až hlboké plazivé vredy). Endoskopický aj histologický nález na terminálnom ileu aj na hornom gastrointestinálnom trakte až do duodena (D3) bol fyziologický. Histologickým vyšetrením bola potvrdená CN v aktívnom štádiu, tiež periadnexálna kondylomatózna lézia so známkami prítomnosti HPV. Bolo pokračované v liečbe mesalazínom (50 mg/kg/deň), pri postupnej detrakcii kortikosteroidov – prednizón 0,5 mg/kg/deň a navýšený azatioprin (2 mg/kg/deň), pridaná imunomodulačná liečba lyofilizovaným dialyzátom leukocytov. Vzhľadom k slabším hmotnostným prírastkom bola zahájená nutričná podpora hyperkalorickou enterálnou výživou. Vzhľadom k tomu, že na konzervatívnej liečbe nedošlo k zlepšeniu lokálneho nálezu na konečníku, bola vo veku 19. mesiacov vyvedená sigmostómia. V pooperačnom priebehu bez komplikácií postupne došlo k zlepšeniu klinického stavu. V 25. mesiaci bolo zrealizované kontrolné rektoskopické vyšetrenie s nálezom cirkulárnej (vs. pozápalovej) stenózy rekta v hĺbke 4 cm, sliznica krehká, na dotyk krvácajúca, perianálne fistuly, resp. abscesy neprítomné. Zrealizovaná dilatácia rekta a excízia troch stopkatých kožných výrastkov cca 3–8 mm veľkých, histologicky verifikovaný fibroepitelový polyp. V 26. mesiaci pri druhej dilatácii rekta nález dvoch fistúl ústiacich do vestibulum vagíny, pretrvávala cirkulárna stenóza v hĺbke 4–5 cm, v dostupnej časti sliznica krehká, zápalovo zmenená s polypoidnými výrastkami, na dotyk krvácajúca. Pre prítomnosť aktívneho zápalu rektálnej sliznice bolo upustené od série ďalších dilatácií.
Vzhľadom k neúspešnosti doposiaľ podávanej medikamentóznej, nutričnej a chirurgickej liečby strikturujúcej a penetrujúcej formy CN s perianálnym postihnutím bola po nevyhnutných vyšetreniach v 28. mesiaci zahájená biologická liečba (BL) monoklonálnou protilátkou anti TNF-α – infliximabom v dávke 10 mg/kg. Pred zahájením liečby bol Pediatrický index aktivity CN (PCDAI) 50. Po tretích podaniach infliximabu PCDAI poklesol na 25.
Ochorenie bolo následne na BL prechodne čiastočne kontrolované, došlo k uzatvoreniu perianálnych fistúl. U pacientky pretrvávala vyššia chorobnosť – infekcie horných dýchacích ciest, vrátane herpetiformných stomatitíd, opakovane artralgie kĺbov dolných končatín (bez prejavov akútnej artitídy), intermitetne prejavy folikulitídy na tvári a hrudníku.
V piatom roku života bola opätovne rehospitalizovaná pre intermitené bolesti brucha v periumbilikálnej oblasti. V laboratórnych parametroch bola zaznamenaná elevácia nešpecifickej zápalovej aktivity (FW 60/108, CRP 30,6 mg/l), v krvnom obraze prejavy leukocytózy (20,7 × 109/l), sideropenickej anémie (Htc 0,31, FeS 1,3 mmol/l) a trombocytózy (716 × 109/l), ostatné základné biochemické parametre boli vo fyziologickom rozmedzí. Bolo realizované kontrolné kolonoskopické vyšetrenie s nálezom zhojených a uzatvorených ústí fistúl v perianálnej oblasti, sliznica až po stómiu ružová, bez ulcerácií, v oblasti ampuly prítomné malé prominencie sliznice vs. zhojené vnútorné ústia fistúl. Pri pokračovaní endoskopického vyšetrenia cez stómiu orálne boli do 20 cm prítomné hlboké ulcerácie, ďalej pre vysoké riziko perforácie nebolo vo vyšetrení pokračované. CT vyšetrením potvrdená kolická forma CN s postihnutím hrubého čreva od lienálnej flexúry po kolostomiu, postihnutá bola aj stena rekta. Neboli detegované abscesy ani fistuly. Do liečby boli opätovne pridané systémové kortikosteroidy.
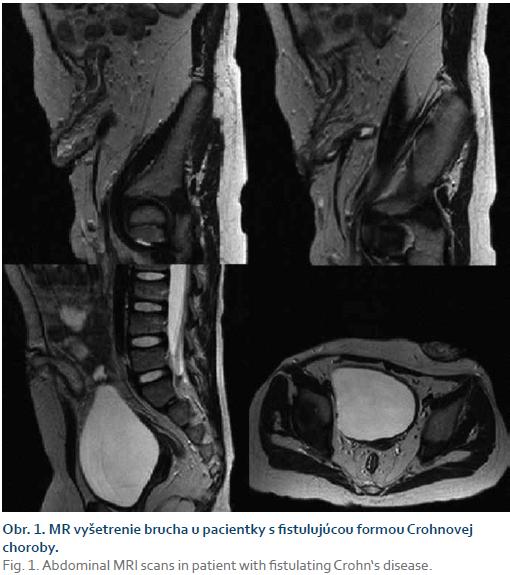
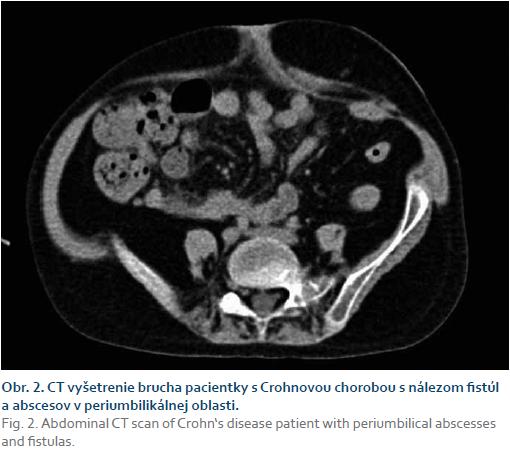
Po pol roku (5,5 roka) bola opätovne rehospitalizovaná pre inflamáciu v oblasti umbilika a febrílie, ktoré sa objavili po detrakcii kortikosteroidov. Hneď prvý deň hospitalizácie došlo k spontánnímu vyprázdneniu periumbilikálneho abscesu. Laboratórne vysoká zápalová aktivita (CRP 84,5 mg/l), v krvnom obraze leukocytóza (29,3 × 109/l) a trombocytóza (807 × 109/l), anémia mierneho stupňa (Hb 106 g/l, Htc 0,32). Bolo zrealizované natívne a postkontrastné MR vyšetrenie, ktoré bolo modifikované podaním zriedeného roztoku manitolu cez stomický otvor, pričom kontrastná látka orálne dobre vyplnila aj kľučky ilea. Kontrastnú látku nebolo možné podať perorálne vzhľadom k nutnosti realizácie vyšetrenia v celkovej anestéze. Vyšetrenie potvrdilo kolickú formu CN. Verifikované boli fistulácie do perikolického tuku v oblasti colon descendens až sigmy, tiež veľká fistula odstupujúca zo stómie a ústiaca na povrchu kože periumbilikálne, bez abscesových ložísk (obr. 1). Bola zahájená totálna parenterálna výživa, cielená antibiotická liečba, pridaný prednizon a tiež bola zmenená BL z infliximabu na adalimumab. Po troch podaniach adalimumabu nedošlo k zlepšeniu klinického stavu, pretrvávali febrílie, bola pozorovaná progresia zápalu periumbilikálne, hnisavá produkcia a secernácia z fistúl v oblasti perinea. Laboratórne pretrvávala elevácia zápalovej aktivity (CRP 41,5 mg/l) a leukocytóza (25,8 × 109/l). V brušnej stene došlo k vytvoreniu abscesu, ktorý bol potvrdený CT vyšetrením (obr. 2). BL bola preto následne prerušená. Napriek kombinovanej antibiotickej liečbe, lokálnemu ošetrovaniu a drenáži abscesu dochádza k rozvoju multiorgánového zlyhania a úmrtiu pacientky.
Počas zhoršenia klinického stavu bola zrealizovaná kontrola imunologických parametrov s nálezom zvýšenej hodnoty IL-10 (21 pg/ml, fyziologická hodnota do 10 pg/ml). Vzhľadom ku klinickému priebehu ochorenia bola preto suponovaná porucha IL-10 receptora, ktorá bola, aj vzhľadom k dostupnosti vyšetrenia a narastajúcim poznatkom o ochorení, potvrdená až neskôr, po úmrtí pacientky. V spolupráci s Centrom pre chronické imunodeficiencie (CCI –Center for chronic immunodeficiency), University Medical Center, Freiburg, Nemecko bola potvrdená bodová mutácia génu IL-10RB v homozygotnej forme v oblasti intrónu 5 (IVS5 + 2T>C), vs. patogénna mutácia.
Diskusia
CN je multifaktoriálne podmienené nešpecifické črevné zápalové ochorenie s komplexnou etiológiou, na ktorej sa podieľa interakcia genetických a environmentálnych faktorov. Špecifické postavenie majú pacienti s rozvojom klinických príznakov pred druhým rokom života (tzv. infantilný typ ochorenia). Jedná sa o heterogénnu skupinu ochorení, ktoré majú často odlišnú etiopatogenézu, fenotyp, odpoveď na liečbu aj prognózu v porovnaní s ochoreniami, ktoré vzniknú v staršom detskom veku alebo dospelosti. V tejto vekovej skupine je potrebné vylúčiť predovšetkým ochorenia, ktoré môžu svojimi klinickými prejavmi imitovať nešpecifické črevné zápalové ochorenia (IBD-like). V diferenciálnej diagnostike je treba u jedincov s nástupom ochorenia v dojčenskom veku vylúčiť infekčné kolitídy, potravinové alergie, metabolické ochorenia a primárne imunodeficiencie (chronická granulomatózna choroba, Wiskott-Aldrichov syndróm, spoločná variabilná imunodeficiencia, ťažká kombinovaná imunodeficiencia, IPEX syndróm). U jedincov s včasným nástupom ochorenia je genetická predispozícia obzvlášť významná. Doposiaľ bolo popísaných okolo 50 monogénnych defektov s IBD-like klinickými prejavmi. Génové polymorfizmy sa podieľajú predovšetkým na dysregulácii imunitného systému, intestinálnej epiteliálnej bariéry, črevnej mikroflóry či metabolických funkcií [1–3].
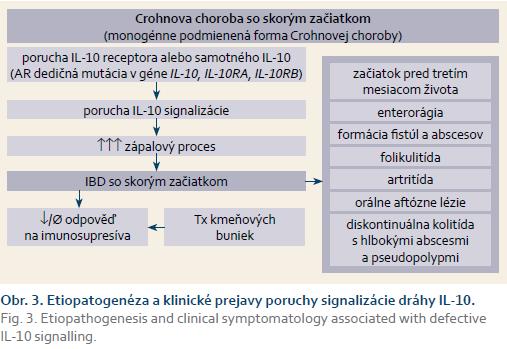
Štúdie posledných rokov poukazujúce význam geneticky podmienených defektov v IL-10 signalizácii priniesli nový pohľad na etiopatogenézu nešpecifických ochorení so včasným nástupom [4,5]. Porucha môže byť podmienená dysfunkciou regulačného cytokínu IL-10 alebo jeho receptora (IL-10RA, IL-10RB). IL-10 je pleiotropný imunoregulačný cytokín s významnou antiinflamatórnou úlohou. Gén pre IL-10 je lokalizovaný na 1q31–32 chromozóme a obsahuje štyri intróny a päť exónov. Sú popisované viaceré génové polymorfizmy. IL-10 je produkovaný spektrom imunokompetentných buniek, ale aj keratinocytov a epiteliánych buniek. Významne ovplyvňuje aktivitu viacerých mechanizmov vrodenej aj získanej imunity, slizničnú homeostázu. Počas IL-10 signalizácie sa heterodimér IL-10 viaže na tetramerický komplex receptora (IL-10R), ktorý sa skladá z dvoch molekúl IL-10R α-reťazca (IL-10R1) a dvoch molekúl IL-10R β-reťazca (IL-10R2). Po naviazaní dochádza k aktivácii Janusovej kinázy 1 (JAK1) a tyrozínkinázy 2 (TRK2), ktorých samofosforylácia vedie k naviazaniu a fosforylácii STAT3 (signal transducer and activator of transcription 3). STAT 3 dimerizuje a translokuje do jadra, kde pôsobí ako transkripčný faktor cieľových génov s antiinflamatórnym efektom, ktoré vedie k down-regulácii TNF-α, IL-1, IL-6, IL-8 a IL-12 [6].
Štúdie potvrdili, že niektoré polymorfizmy IL-10 a IL-10R génu pre IL-10 a jeho receptor zohrávajú významnú úlohu v etiopatogenéze viacerých ochorení (bronchiálna astma, systémový lupus erythematosus, psoriáza, nešpecifické črevné zápalové ochorenia, tuberkulóza a niektoré nádorové ochorenia). Defekty v IL-10 signalizácii majú klasický Mendelovský spôsob dedičnosti s kompletnou penetráciou. V etiopatogenéze nešpecifických črevných zápalových ochorení má kľúčovú úlohu defektná protizápalová odpoveď. Už pred viac ako 20 rokmi štúdie so zvieracími modelmi poukázali na to, že u IL-10 deficientných myší bolo vysoké riziko rastovej retardácie a chronickej enterokolitídy [7]. IL-10R2 je okrem receptora pre IL-10 komponentom aj ďalších receptorov pre IL-22, 26, 28 a 29, čo je spojené s viacerými extraintestinálnymi prejavmi. Signalizácia mediovaná IL-22 a 26 reguluje imunitu kože a jej porucha môže viesť k rozvoju chronickej folikulitídy. IL-22 sa tiež podieľa na udržiavaní epiteliálnej bariérovej funkcie [8,9]. IL-28 a 29 sú súčasťou obranných mechanizmov proti vírusom, ale vzhľadom k prítomnosti ďalších významnejších faktorov ich význam v etiopatogenéze tejto poruchy zatiaľ ostáva neobjasnený. Aktuálne výsledky však naznačujú podobný fenotyp u pacientov s mutáciou IL-10R1 a IL-10R2, čo naznačuje na kľúčový význam poruchy IL-10 signalizácie v etiopatogenéze [4].
Glocker et al potvrdili u 4 z 9 pediatrických pacientov s včasným nástupom enterokolitídy spojenej s extraintestinálnymi prejavmi tri polymorfizmy génu subjednotkových proteínov receptora pre IL-10, ako aj funkčný deficit spojený so sledovanými polymorfizmami [4]. Následne boli publikované ďalšie štúdie potvrdzujúce asociáciu medzi včasným nástupom nešpecifických črevných zápalových ochorení a poruchou IL-10 signalizácie. Kotlarz et al sledovali heterogenitu medzi pacientami s veľmi včasným nástupom IBD so zameraním sa na poruchu IL-10 signalizácie a postavenie alogénnej transplantácie kmeňových buniek v manažmente ochorenia. Do štúdie bolo zaradených 66 pacientov s nástupom ochorenia pred piatym rokom života. Analyzovaná bola prítomnosť polymorfizmov génov IL-10, IL-10R1 a IL-10R2. IL-10R deficit bol potvrdený funkčným testom použitím pacientových polymorfonukleárnych leukocytov. Identifikovaných bolo 16 pacientov s poruchou IL-10 signalizácie (mutácia génu IL-10 tri pacienti, IL-10R1 päť pacientov, IL-10R2 osem pacientov). Väčšina pacientov mala rodičov v konsagvinnom vzťahu. U všetkých pacientov došlo k rozvoju refraktérnej kolitídy počas prvých troch mesiacov života a bola asociovaná s perianálnym postihnutím, tvorbou fistúl a abscesov [10]. Výskyt ochorenia je však stále raritný, doposiaľ bolo kaziusticky opísaných okolo 30 prípadov [5,10–12].
Pri poruche IL-10 signalizácie je typický rozvoj prejavov enterokolitídy už v prvých mesiacoch života. V klinickom obraze dominujú prejavy závažnej kolitídy s perianálnym postihnutím (abscesy alebo fistuly), ktoré boli prítomné aj u prezentovanej pacientky [4,5,10]. Typické sú aj extraintestinálne (folikulitída, rekurentné febrílie a infekcie, aftózne stomatitídy, artritída) a recidivujúce prejavy (obr. 3) [4,5,10]. Podobne u našej pacientky boli intermitentne prítomné prejavy folikulitídy na tvári a hrudníku, recidivujúce infekcie horných dýchacích ciest, vrátane aftóznych stomatitíd, artralgie kolenného kĺbu, ale bez jednoznačných prejavov aktívnej artritídy.
Záver
V kazuistike je opísaný prípad pacientky s včasným nástupom CN (strikturujúcej a penetrujúcej formy s perianálnym postihnutím) nereagujúcej na konvenčnú liečbu. Konvenčná imunosupresívna liečba u nej v súlade s aktuálnymi literárnymi údajmi nebola účinná, podobne mala BL len prechodný čiastočný efekt [4,10]. Vyvedenie sigmostómie viedlo len k čiastočnému prechodnému zlepšeniu lokálneho perianálneho nálezu [4,13]. Ochorenie bolo diagnostikované pred 10 rokmi a aj preto sa terapeutický management pacientky čiastočne odlišuje od aktuálne platných odporúčaní. Vzhľadom k neúspešnosti konvenčnej liečby sa skúšajú rôzne nové liečebné stratégie. Prvým logickým krokom sa zdalo byť parenterálne podávanie IL-10. Podľa aktuálnej metaanalýzy Cochrane central register of controlled trials sa však liečba nezdá byť efektívnou v liečbe aktívnej CN a navyše je spojená s nežiaducimi účinkami [14]. Alogénna transplantácia kmeňových buniek je aktuálne jedinou potenciálne kuratívnou liečebnou modalitou vedúcou k reštitúcii IL-10 signalizácie a remisii ochorenia [4,10,15].
Prezentovaná pacientka s včasným nástupom CN (strikturujúcej a penetrujúcej formy s perianálnym postihnutím) nereagujúcej na konvenčnú liečbu je prvým zdokumentovaným pacientom v Slovenskej republike. Vzhľadom v predpokladanému vyššiemu výskytu poruchy IL-10 signalizácie by malo byť toto ochorenie v diferenciálnej diagnostike zvážené u všetkých pacientov s včasným nástupom enterokolitídy, predovšetkým pri refraktérnosti na konvenčnú liečbu a perianálnom postihnutí.
Práca bola podporená projektom BioMed Martin (ITMS: 26220220187) a grantom VEGA 1/0252/14.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Lebenthal EA, Branski DA, Walker-Smith JA. Early-onset inflammatory bowel disease: infant, toddler, and pre-school. In: Walker-Smith JA, Lebenthal E, Branski D (eds). Pediatric and inflammatory bowel disease: perspective and consequences. Pediatr Adolesc Med. Basel: Karger 2009: 67–75.
2. Ledder O, Catto-Smith AG, Oliver MR et al. Clinical patterns and outcome of early-onset inflammatory bowel disease. J Pediatr Gastroenterol Nutr 2014; 59 (5): 562–564. doi: 10.1097/MPG.0000000000000465.
3. Uhlig HH, Schwerd T, Koletzko S et al. The diagnostic approach to monogenic very early onset inflammatory bowel disease. Gastroenterology 2014; 147 (5): 990–1007. doi: 10.1053/j.gastro.2014.07.023.
4. Glocker EO, Kotlarz D, Boztug K et al. Inflammatory bowel disease and mutations affecting the interleukin-10 receptor. N Engl J Med 2009; 361 (21): 2033–2045. doi: 10.1056/NEJMoa0907206.
5. Begue B, Verdier J, Rieux-Laucat F et al. Defective IL10 signaling defining a subgroup of patients with inflammatory bowel disease. Am J Gastroenterol 2011; 106 (8): 1544–1555. doi: 10.1038/ajg.2011.112.
6. Glocker EO, Kotlarz D, Klein C et al. IL-10 and IL-10 receptor defects in humans. Ann N Y Acad Sci 2011; 1246: 102–107. doi: 10.1111/j.1749-6632.2011.06339.x.
7. Kühn R, Löhler J, Rennick D et al. Interleukin-10-deficient mice develop chronic enterocolitis. Cell 1993; 75 (2): 263–274.
8. Wolk K, Kunz S, Witte E et al. IL-22 increases the innate immunity of tissues. Immunity 2004; 21 (2): 241–254.
9. Zheng Y, Valdez PA, Danilenko DM et al. Interleukin-22 mediates early host defense against attaching and effacing bacterial pathogens. Nat Med 2008; 14 (3): 282–289. doi: 10.1038/nm1720.
10. Kotlarz D, Beier R, Murugan D et al. Loss of interleukin-10 signaling and infantile inflammatory bowel disease: implications for diagnosis and therapy. Gastroenterology 2012; 143 (2): 347–355. doi: 10.1053/j.gastro.2012.04.045.
11. Moran CJ, Walters TD, Guo CH et al. IL-10R polymorphisms are associated with very-early-onset ulcerative colitis. Inflamm Bowel Dis 2013; 19 (1): 115–123. doi: 10.1002/ibd.22974.
12. Beser OF, Conde CD, Serwas NK et al. Clinical features of interleukin 10 receptor gene mutations in children with very early-onset inflammatory bowel disease. J Pediatr Gastroenterol Nutr 2015; 60 (3): 332–338. doi: 10.1097/MPG.0000000000000621.
13. Lee CH, Hsu P, Nanan B et al. Novel de novo mutations of the interleukin-10 re- ceptor gene lead to infantile onset inflam- matory bowel disease. J Crohns Colitis 2014; 8 (11): 1551–1556. doi: 10.1016/j.crohns. 2014.04.004.
14. Buruiana FE, Solà I, Alonso-Coello P. Recombinant human interleukin 10 for induction of remission in Crohn’s disease. Cochrane Database Syst Rev 2010; 11: CD005109. doi: 10.1002/14651858.CD005109.pub3.
15. Engelhardt KR, Shah N, Faizura-Yeop I et al. Clinical outcome in IL-10- and IL-10 receptor-deficient patients with or without hematopoietic stem cell transplantation. J Allergy Clin Immunol 2013; 131 (3): 825–830. doi: 10.1016/j.jaci.2012.09.025.