Neuroendokrinní tumory tenkého střeva - jejuna a ilea
Oldřich Louthan1
+ Pracoviště
Souhrn
Neuroendokrinní tumory tenkého střeva tvoří čtvrtinu všech gastrointestinálních endokrinních nádorů. Starší nomenklatura je označuje jako midgut karcinoidy. Větší část z nich jsou dobře diferencované nádory a nevyvolávají žádné klinicky zjistitelné, endokrinně podmíněné příznaky (nefunkční tumory), ale zhruba pětina tumorů se manifestuje klasickým karcinoidovým syndromem (funkční tumory). Odpady 5-hydroxyindoloctové kyseliny bývají u tumorů této lokalizace významně zvýšené, zejména u funkčních forem. Validním markerem pro diagnostiku funkčních i nefunkčních tumorů je sérový chromogranin A. Octreoscan je nezbytnou metodou pro staging. U funkčních nádorů je v době diagnózy u 20 % nemocných zjištěna karcinoidová srdeční nemoc, zejména trikuspidální insuficience. Závažnou komplikaci onemocnění je karcinoidová krize. Jedinou radikální metodou je chirurgické odstranění nádoru, u malých neoplazií postačuje endoskopické snesení. Paliativní léčba zahrnuje analoga somatostatinu s antisekretorickými a tumoristatickými účinky účinně potlačující projevy karcinoidového syndromu. Mohou docílit prodloužení přežití bez progrese jak u funkčních, tak i u nefunkčních forem nádoru. Dále se v paliativní léčbě používá interferon alfa v kombinaci s analogy somatostatinu, slibné jsou inhibitory mTOR (mammalian target of rapamycin) a antiangiogenetické léky. Z invazivních metod cytoredukce se provádí resekce jaterních metastáz, radiofrekvenční ablace a (chemo)embolizace. Další slibnou paliativní metodou je peptidová receptorová radionuklidová terapie.
Klíčová slova: neuroendokrinní tumor tenkého střeva, karcinoidový syndrom, chromogranin A, karcinoidová krize, somatostatinová analoga, inhibitory mTOR.
ÚVOD
Neuroendokrinní tumory jejuna a ilea představují kolem 25 % všech neuroendokrinních tumorů (NET) zažívacího traktu a jejich roční incidence je 2-8 osob na 1 000 000 obyvatel. Většina těchto nádorů je dobře diferencovaných a jejich průběh je víceméně indolentní. V době diagnózy je většina tumorů již v pokročilé fázi. Podle registru SEER (Surveillance, Epidemiology, and End Results) z let 1979-1999 postihují tyto NET muže stejně často jako ženy, nejčastěji v 6. a 7. životní dekádě. Nádory jsou až ve 30 % případů multicentrické a v 15-25 % případů jsou asociovány s jinými tumory(1,2). Podle starší klasifikace patří NET této lokalizace k tzv. midgut karcinoidům. Termín midgut odkazuje na fakt, že tenké střevo a proximální úsek tlustého střeva mají původ v embryonálním středním střevě. Termín karcinoid se v dnešní době ponechává pro NET tenkého střeva a opouští se pro NET z jiných lokalizací zažívacího traktu. Typický karcinoidový syndrom se vyskytuje právě u části NET tenkého střeva. Podle WHO klasifikace se dělí NET tenkého střeva, podobně jako ostatní NET na tři skupiny (tab. 1).
NET tenkého střeva jsou 6-8× častější v ileu nežli v duodenu a jejunu a jejich frekvence vzrůstá aborálním směrem.

KLINICKÉ PROJEVY
Nefunkční tumory
V době diagnózy jsou primární tumory obvykle větší než 2 cm, invadují do muscularis propria a nezřídka zakládají metastázy do regionálních lymfatických uzlin.
Asymptomatické NET v distální části tenkého střeva bývají v praxi často diagnostikovány tak, že jsou nejprve objeveny metastázy do jater, biopticky je verifikován neuroendokrinní tumor a primární ložisko v tenkém střevě je pak lokalizováno až následně. V jiných případech jde o víceméně náhodný průkaz tumoru v terminálním ileu při endoskopickém vyšetření indikovaném z různých důvodů. Jindy se tyto NET manifestují obecnými onkologickými příznaky - krvácením ze zažívacího traktu, hubnutím při generalizaci onemocnění a podobně. Subjektivní obtíže mohou být velmi necharakteristické a trvat i řadu let. V důsledku fibrotických procesů vyvolaných serotoninem produkovaným nádorem může docházet v okolí nádorových ložisek na peritoneu či mezenteriu k poruchám střevní pasáže se strangulací střevních kliček nebo cévního zásobení s projevy ischemické ileitidy. Tyto desmoplastické změny mohou být natolik rozsáhlé, že vedou k fixaci kliček tenkého a někdy i tlustého střeva k peritoneu(3). Mimo poruchy střevní pasáže může vniknout i hydronefróza. U některých nemocných může dojít k průjmům vlivem bakteriálního přerůstání, ty ovšem nejsou projevem endokrinní aktivity nádorů.
Funkční tumory
U necelých 20 % pacientů s NET tenkého střeva dochází ke vzniku karcinoidového syndromu. Ten může být v úvodní fázi onemocnění méně nápadný, a proto pokud se nepomyslí v rámci diferenciální diagnózy na karcinoid, může být stanovení diagnózy obtížnější. Klinické projevy tzv. typického karcinoidového syndromu zahrnují především průjmy a flush - červené zbarvení postihující obličej, krk a trup. Flush je zpočátku prchavý, později permanentní. Podle některých literárních zdrojů je flush častější nežli průjmy, ale naše klinické zkušenosti ukazují, že průjmy se vyskytují častěji nežli flush(4). Dále se v rámci karcinoidového syndromu sporadicky popisují tachykardie a záchvaty exspirační dušnosti podmíněné bronchokonstrikcí. Pro srovnání: atypický karcinoidový syndrom způsobený nejčastěji plicními NET bývá provázen navíc otoky obličeje a očních víček či slzením v důsledku nadprodukce histaminu, který u NET tenkého střeva nenacházíme.
Karcinoidový syndrom je v 95 % případů podmíněn přítomností jaterních metastáz, asi u 5 % případů je vznik syndromu možný bez jaterních metastáz při derivaci biologicky aktivních substancí z retroperitoneálních ložisek cestou vena cava inferior do krevního oběhu.
Komplikace
A. Komplikací je postižení srdečních chlopní v rámci karcinoidové srdeční nemoci.
Vyskytuje se typicky u NET této lokalizace. Jde většinou o trikuspidální regurgitaci vlivem fibrotizace chlopně s následnou retrakcí, méně často je postižena chlopeň plicnice. Jak ukázal Gustaffson v experimentu, faktorem vyvolávajícím fibroprodukci na chlopni je serotonin(5). Pátrání po karcinoidové srdeční nemoci proto patří k základnímu vyšetření v době detekce nádoru a dále v průběhu sledování pacienta(6). Je nutné provádět echokardiografické vyšetření a vyšetření peptidu BNP (brain natriuretic peptide)(7-9). Karcinoidová srdeční nemoc se popisovala u necelé poloviny pacientů s tímto onemocněním, v poslední době je zaznamenán pokles incidence - snad díky léčbě somatostatinovými analogy a jejich antisekretorickému účinku potlačujícímu produkci serotoninu nádorem. Srdeční selhání v těžké formě zhoršuje kvalitu života více nežli vlastní malignita(8). K srdečnímu selhání jako příčině smrti dochází u 30-50 % pacientů s karcinoidovou srdeční nemocí. Proto pokud je pacient z onkologického hlediska perspektivní, je nutné usilovat o implantaci chlopenní náhrady.
B. Karcinoidová krize je obávanou, by» relativně vzácnou komplikací. Ke krizi může dojít spontánně, při mechanické manipulaci s nádorem při chirurgickém výkonu anebo při vedení anestezie. Při karcinoidové krizi dochází ke zhoršení stávajících příznaků, tedy flushe, průjmů, ale zejména k hemodynamické nestabilitě se závažnou hypotenzí v důsledku vazodilatace způsobené vazoaktivními substancemi, například bradykininem a kallikreiny. Objevují se srdeční arytmie či generalizovaná bronchokonstrikce při vyplavení histaminu.
C. Málo známou komplikací je pellagra-like syndrom, vyvolaný nadměrnou spotřebou tryptofanu nádorem, což vede k depleci niacinu, který je metabolitem tryptofanu, s následným vznikem syndromu. Ten se manifestuje dermatitidou (červenohnědý erytém), průjmem a psychickou alterací (3D syndrom: dermatitis, diarrhoe, "demence"). Na syndrom se často nepomýšlí, navíc se jeho symptomatologie zčásti překrývá s projevy karcinoidového syndromu, což ztěžuje diagnostiku. Neléčený pellagra-like syndrom má závažné metabolické důsledky.
PROGNÓZA
Prognóza NET tenkého střeva je relativně nepříznivá, nebo» tyto nádory mají tendenci k lymfogennímu šíření a tvorbě metastáz v játrech. Proliferační index Ki-67 je užitečným prognostickým faktorem, nebo» přežití u nemocných s dobře diferencovanými NET s nižším proliferačním indexem Ki-67 je delší v porovnání s nemocnými s vyšším proliferačním indexem Ki-67.
Podle literatury jen u 25 % pacientů, kteří prodělali radikální chirurgický výkon, nedošlo k recidivě onemocnění v průběhu následujících 25 let.
Podle SEER pětileté přežití u lokalizovaných NET tenkého střeva činí v 65-75 %, u regionálního postižení je v 64-73 %, kdežto u jaterních metastáz je přežití jen u 18-32 %. U kombinace všech forem činí pětileté přežití 60,5 %(2).
K odhadu přežití je nutno vzít v úvahu i další faktory. Podle některých autorů je přítomnost karcinoidového syndromu nepříznivým faktorem, ovšem je nutné uvážit, že karcinoidový syndrom se vyskytuje v naprosté většině u metastazujících forem. Pětileté přežití je u těchto nemocných 21%, medián přežití je 38 měsíců od první epizody flushe a 23 měsíců od doby zvýšení 5-hydroxyindoloctové kyseliny (5-HIO) v moči.
Prevalence karcinoidové srdeční nemoci u těchto pacientů je 40-50 %(10). Karcinoidová srdeční nemoc je přítomna asi u 20 % osob s karcinoidovým syndromem v době diagnózy onemocnění(8). Pravostranné srdeční selhání v důsledku poškození srdečních chlopní v pravém srdci bylo příčinou smrti u 30-65 % před zavedením analogů somatostatinu do léčby, v posledních letech je toto procento nižší. Podle Westberga et al.(11) je nejvýznamnějším prediktorem úmrtí insuficience trojcípé chlopně spolu s věkem a elevací 5-HIO v moči. Významným nástrojem v odhadu prognózy je nově zaváděná TNM klasifikace pro endokrinní tumory tenkého střeva(1).
DIAGNÓZA
V praxi se správná diagnóza NET tenkého střeva opožďuje až o 5 let, protože primární NET tenkého střeva bývají malé, zpočátku asymptomatické, anebo jsou jejich příznaky interpretovány běžnějšími příčinami, jako jsou alergie anebo střevními záněty(9). Jak je uvedeno výše, často bývají zjištěny nejprve jaterní metastázy, které jsou mnohem větší než primární nádor, a proto se lépe detekují.
Patologie a genetika
Karcinoidy se vyskytují v průběhu celého tenkého střeva, ale nejčastěji v terminálním ileu. V 98 % jde o dobře diferencované nádory z enterochromonafinních (EC) buněk(12). Izolované primární tumory se v této lokalizaci vyskytují v 75 %, mnohočetné nádory v 25 %. Multifokální ložiska v tenkém střevě jsou vlastně lokální metastázy. Velikost primárního nádoru nekoresponduje s metastatickým potenciálem, nebo» i několikamilimetrové primární nádory mohou založit velké, několikacentimetrové jaterní metastázy. Pro diagnostiku NET je nutný imunohistochemický průkaz chromograninu A a synaptofyzinu(1,13). Pro rozhodování o léčebné taktice a k odhadu prognózy je nutné vyšetření proliferačního indexu Ki-67 a mitotického indexu. Tumor na základě těchto údajů lze klasifikovat podle WHO kritérií, přičemž NET tenkého střeva spadají většinou do 2. skupiny, tj. mezi dobře diferencované neuroendokrinní karcinomy. Ki-67 index je hodnocen s použitím monoklonální protilátky MIB1 jako procento z 2000 buněk v oblastech s nejvyšším nukleárním značením.
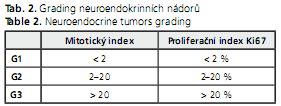
Návrh gradingu není z hlediska kritérií užívajících mitotický index/proliferační index zcela koherentní, nebo» tumory gradingu G3 mohou patřit buď do klasifikace podle WHO 2000 do skupiny 2, jakožto dobře diferencované neuroendokrinní karcinomy, anebo do skupiny 3, jakožto málo diferencované endokrinní karcinomy s Ki67 > 30 %.
Minimální patologickoanatomická diagnostická kritéria NET zahrnují údaje o proliferačním indexu, pozitivitě imunohistochemie na chromogranin A a synaptofyzin, dále údaj o velikosti tumoru a případné přítomnosti invaze.
Genetické změny
Genetické změny nejsou u NET tenkého střeva jasně definovány a genetické vyšetření se rutinně neprovádí.
Zobrazovací metody
Standardní zobrazovací procedury zahrnují ultrazvukové vyšetření, kontrastní CT a magnetickou rezonanci (MRI). V praxi bývá ultrazvukové vyšetření jedno z prvních, které upozorní na přítomnost NET průkazem jaterních metastáz(14). Sonografie a CT slouží též k vizuální kontrole při provedení jaterní biopsie. K dalším metodám patří endoskopické vyšetření(15), kapslová enteroskopie(16), echokardiografie při suspekci na karcinoidovou srdeční nemoc.
Jak bylo zmíněno, primární tumory tenkého střeva bývají malé a jejich detekce může být obtížná, což překvapivě kontrastuje s jejich jaterními metastázami, které mívají velké rozměry a dají se detekovat vcelku snadno. Kolonoskopie identifikuje tumor v oblasti ileocékální chlopně a distální části ilea. Nutno mít na paměti, že enteroklýza či CT enteroklýza nezřídka poskytuje falešně negativní nebo obtížně hodnotitelný nález. Výhodná je kapslová enteroskopie(16), která ovšem nenabízí možnost histologické verifikace nálezu, a dále balonková enteroskopie.
Po histologickém potvrzení diagnózy je nezbytnou součástí stagingu SRS (somatostatinová receptorová scintigrafie (octreoscan) se SPECT(17). SRS je pozitivní u 80-90 % malých NET tenkého střeva. Limity diagnostických možností SRS je velikost nádoru < 1 cm a chybění exprese somatostatinových receptorů SSTR2 a SSTR5. Nověji je zaváděna alternativní metoda používající 68-Gadolinium navázané na somatostatinový analog.
K detekci jaterních metastáz, zjištění velikosti ložisek a k hodnocení vývoje onemocnění a hodnocení response je vhodné trifázické CT a kontrastní MRI, které mají podobnou senzitivitu a lze je považovat za komplementární. Lze detekovat i vztah k cévám a hodnotit desmoplastickou reakci okolních mesenterických lymfatik.
Kostní metastázy lze prokázat pomocí octreoscanu, v případě jeho negativity a trvajícím podezření na NET se doporučuje provedení kostního scanu.
PET používající 18F-deoxyglukózu není v diagnostice NET tenkého střeva příliš spolehlivé vyšetření vzhledem k nízké senzitivitě v důsledku nižšího metabolického obratu nádorové tkáně. Validnější je vyšetření PET používající jako tracer 11C-5-hydroxytryptofan anebo 18F-dihydroxyfenylalanin (DOPA), které u dobře diferencovaných NET tenkého střeva dosahují senzitivitu až 90 % a jsou vhodné k detekci malých primárních nádorů a k detekci metastáz do lymfatických uzlin. Je-li přítomen karcinoidový syndrom, je nutné provést echokadiografické vyšetření k vyloučení karcinoidové srdeční nemoci.
Endoskopické ultrazvukové vyšetření nemá v této lokalizaci žádný přínos.
Laboratorní vyšetření
Sérový chromogranin A (S-CgA) je senzitivní marker pro funkční i nefunkční NET, jeho specificita pro NET tenkého střeva je poněkud nižší(18). Senzitivita pro NET tenkého střeva je 87%. Je prokázána korelace mezi hladinou S-CgA a prognózou onemocnění. Marker může včas signalizovat recidivu onemocnění. K falešnému zvýšení hodnot S-CgA dochází při užívání inhibitorů protonové pumpy, u atrofické gastritidy, idiopatických střevních zánětech a zejména u renálního selhání(19).
Endokrinní tumory této lokalizace produkují serotonin a jeho metabolit kyselinu 5-hydroxyindoloctovou (5-HIO). U NET tenkého střeva senzitivita 5-HIO je 73% a 100% specificita(20,21). Hodnotí se koncentrace v moči a zejména odpad ve 24hodinovém sběru, norma činí na našem pracovišti 50 μg/ den, může se však lišit podle laboratoří. Odpady 5-HIO bývají u NET tenkého střeva vysoké, nezřídka dosahují i hodnot tisíců mikromolů. Vyšetření je třeba provádět po dietním omezení s vyloučením poživatin mající vyšší obsah serotoninu.
Minimálním požadavkem na laboratorní testy je provedení S-CgA a 5-HIO při úvodním vyšetření a později při pravidelných kontrolách.
NÁVRH TNM KLASIFIKACE
TNM klasifikace existuje v návrhu a jeho zavedení do klinické praxe je reálné. T1-4 označuje velikost nádorů, kdy T2 např. popisuje nádor > 1 cm. Stadium I zahrnuje tumory o velikosti T1 s limitovaným růstem. T2 je pro tumory > 1 cm. Stadium II zahrnuje tumory velikosti T2 a T3, větší a rostoucí invazivně. Stadium IIIa označuje tumory invadující okolní struktury a IIIb zahrnuje tumory T4 či s metastázami do regionálních lymfatických uzlin. Stadium IV je určeno pro případy se vzdálenými metastázami.
TERAPIE
Chirurgická léčba
A. Radikální chirurgické odstranění lokalizovaného nádoru představuje kurativní léčbu. Vzhledem k tendenci těchto NET šířit se do regionálních uzlin, je nutná revize uzlin a jejich případné odstranění(22). Za kurativní chirurgický výkon je též možno považovat odstranění primárního nádoru, regionálních lymfatických uzlin a resekovatelné jaterní metastázy, což je schůdné až u pětiny pacientů.
B. Operační výkony s kurativním záměrem při metastatickém postižení jater zahrnují enukleaci metastatického ložiska, segmentální resekci, hemihepatektomii. Dle možnosti se provádí intraoperační sonografické vyšetření k přesnější lokalizaci jaterních metastáz. Pětileté přežití u tohoto typu výkonu je přes 60 %.
C. Paliativní chirurgický výkon: Cytoredukční operační výkon je možno uvážit u pacientů, u nichž je možno předpokládat bezpečné odstranění až 90 % nádorové masy(23). Chirurgická intervence se může týkat resekce primárního nádoru a lokoregionálních metastáz nebo debulkingu nitrobřišních nádorových mas, resekce samotné jaterní metastázy, nebo synchronní resekce primárního ložiska a jaterních metastáz(24). Je nutné uvážit, že v porovnání s endokrinně nefunkčními midgut NET, je přežití nemocných s karcinoidovým syndromem kratší. Vždy je třeba uvážit operační řešení jaterních metastáz, nebo» novější zprávy uvádějí pětileté přežití u midgut NET s resekcí jaterních metastáz asi v 30 % a mediánem přežití 3-4 roky(23).
I když jde o výkon v rámci paliativní chirurgie, většinou se doporučuje odstranění primárního nádoru, i když jde jinak o pokročilé onemocnění. Snahou je zabránit obstrukci tenkého střeva nádorem nebo zabránit vzniku ischemických komplikací díky desmoplastické reakci na mezenteriu či v důsledku komprese mezenterických cév nádorovou masou. Vzhledem k tomu, že intenzita symptomů je nezřídka spjata s velikostí nádorové masy, může chirurgická cytoredukce docílit symptomatickou úlevu u 70-100 % pacientů. Některé zprávy ukazují, že intraabdominální cytoredukce může prodloužit přežití ze 70 na 130 měsíců.
Podle minimálního konsenzu podle ENETS chirurgický výkon musí být individualizován podle konkrétní situace(1).
Farmakoterapie
Bioterapie zahrnuje analoga somatostatinu a interferon alfa. Jde o léky tlumící hormonální hypersekreci a/nebo nádorový růst pomocí látek vyskytujících se přirozeně v organismu anebo pomocí jejich analogů(25,26). V současné době probíhají nebo skončily poměrně validní studie, na jejichž závěrech lze v souladu s principy medicíny založené na důkazech založit léčebnou taktiku.
Analoga somatostatinu
V praxi se používá octreotid, lanreotid a nově pasireotid (SOM230)(27). Jejich účinek je podmíněn vazbou na somatostatinové receptory se subtypy 2 a 5 (octreotid), u lanreotidu jde o subtypy 2, 3 a 5, u pasireotidu o subtypy 1, 2, 3 a 5(28,29). Účinek analogů je přímý anebo nepřímý(30). Z klinického hlediska jde o účinek a) antisekretorický a b) tumoristatický.
Antisekretorický efekt představuje zmírnění nebo potlačení karcinoidového syndromu u 70 až 80 % léčených osob(1,31-34) a biochemickou odpověď se snížením hodnot 5-HIO a S-chromograninu A o 50 % a více procent výchozích hodnot.
Antiproliferativní efekt byl potvrzen v preklinické fázi a nově i v některých klinických studiích, a to u funkčních i nefunkčních tumorů - studie PROMID(35). Většinou je dosaženo stabilizace nemoci podle RECIST kriterií u 25 - 60 % nemocných, u kterých byla před léčbou prokázána progrese nádoru. Analoga jsou tedy indikována k potlačení endokrinních projevů, karcinoidového syndromu, kde je efekt ve většině případů velmi dobrý(36).
Používané léky: Octreotid (Sandostatin LAR) 20-30 mg intramuskulárně po 28-31 dnech. Při nedostatečné odpovědi lze intervaly aplikace zkrátit, výjimečně až na 10 dní. Dále se používá lanreotid (Somatuline Autogel 90-120 mg) subkutánně obvykle po 28 dnech. Intervaly lze zkrátit, ale dle response naopak prodloužit až na 56 dní(37). Nově je zaváděn do praxe pasireotid, zatím na úrovni klinických studií fáze III. Zkouší se též alternativně střídat octreotid s lanreotid v tříměsíčních cyklech s cílem omezit vznik rezistence na léčbu(38).
Analoga se též používají k prevenci a léčbě karcinoidové krize a k prevenci karcinoidové srdeční nemoci. K léčbě karcinoidové krize se používá krátkodobý octreotid v i.v. infuzi. Soudí se, že analoga brání nebo zpomalují vznik karcinomové srdeční nemoci díky potlačení produkce serotoninu, který je odpovědný za fibrotické změny na srdečních chlopních.
U pacientů s pozitivitou octreoscanu je účinnost analogů lepší než u osob s negativním nálezem. Nelze však paušálně říci, že u pacientů s negativním octreoscanem je aplikace analogů somatostatinu vyloučena.
Vedlejší účinky analogů nebývají závažné, jde nejčastěji o břišní dyskomfort, nadýmání, někdy steatorrheu. Steatorrheu lze potlačit pankreatickými enzymy. Zhruba u poloviny léčených osob dojde většinou po několika měsících ke vzniku cholelitiázy. Ta je většinou asymptomatická(26).
Sekreční průjmy lze též zmírnit loperamidem nebo deriváty morfinu. Je třeba uvážit i další příčiny průjmu, jako jsou ztráty žlučových kyselin, bakteriální přerůstání, syndrom krátkého střeva v případě dřívější resekce, a uvážit adekvátní léčbu (cholestyramin, antibiotika).
Interferon alfa
Doporučuje se jako lék u funkčních tumorů tenkého střeva v rámci druhé linie po analogu somatostatinu(39,40). Po interferonu alfa lze docílit subjektivního zlepšení a biochemické response asi u poloviny léčených(41,42). Tumoristatický efekt v podobě parciální remise nastává jen u 10-15 % nemocných. Výhodný je antidesmoplastický efekt, potlačení tvorby vaziva v nitrobřišní dutině(43). Aplikuje se 3-5 milionů jednotek subkutánně 3× týdně. V úvodu léčby se dostavují chřipkové obtíže (flu-like syndrom), při delší léčbě únavnost, deprese, hubnutí. Teploty v úvodu lze potlačit paracetamolem, během několika dní teploty vymizí. V praxi většinou přidáváme interferon alfa do kombinace s analogy při nedostatečně odpovědi na analoga, i když názory na možnost zvýšení efektivity léčby při této dvojkombinaci nejsou zcela konzistentní(43,44). Léčba může probíhat i několik let, pokud trvá response.
Chemoterapie
Výsledky systémové terapie jsou u dobře diferencovaných NET neuspokojivé a» v monoterapii, či v kombinaci. Kombinuje se streptozotocin + 5-fluorouracil či streptozotocin + doxorubicin. Response je pod 15 %(9,45). Chemoterapie je proto indikována jen u špatně diferencovaných forem, s vyšším proliferačním indexem Ki-67.
Peptidová receptorová radionuklidová terapie (PRRT)
Efektivita léčby je podmíněna vazbou nosiče, jímž je octerotid nebo příbuzný analog octreotate, na somatostatinové receptory SSTR 5. a zejména 2. sub- typu(28). Na nosiči je navázán beta-zářič 90Yttrium anebo 177Lutetium(46,47). Požadavkem pro zahájení léčby je pozitivita octreoscanu. Léčba je indikována u symptomatických pacientů refrakterních na bioterapii. Parciální response bývá podle různých dat dosažena v 12-35 % a stabilizace nemoci v 28-56 %. Novější údaje(1) uvádějí dosažení kompletní a parciální remise u 28 % léčených s mediánem doby do progrese nejméně 36 měsíců.
Cílená radioterapie 90Yttriem formou mikrokapslí (SIR - Spheres)
Spočívá v aplikaci mikrokapslí s navázaným beta zářičem 90Yttriem do větví arteria hepatica zásobující jaterní metastázy. Pozitivita octreoscanu není podmínkou k zahájení léčby.
ZÁVĚR
Neuroendokrinní tumory tenkého střeva představují původní klasickou formu karcinoidů. Část z nich se manifestuje jako typický karcinoidový syndrom. V posledních letech probíhá řada klinických studií fáze II a III zabývající se léčbou NET. Přinášejí zajímavé výsledky týkající se efektivity analogů somatostatinu včetně novějšího pasireotidu, v paliativní léčbě pokročilých forem nádorů, dále bevacizumabu(48), sunitinibu a inhibitoru mTOR (mamalian target of rapamycin) RAD001 (everolimus). Koncem roku 2009 by měly být k dispozici první výsledky z dvojitě slepé studie RADIANT 2, zahrnující pacienty s pokročilými NET s progresí na předchozí léčbě, léčené ve studii kombinací octreotid LAR + everolimus vs. placebo. Terapeut zabývající se léčbou NET bude moci léčebnou taktiku budovat na medicíně založené na důkazech, nikoli pouze na kazuistických či osobních zkušenostech, jak tomu bylo donedávna vzhledem k nízké incidenci NET.
Článek byl vytvořen v rámci výzkumného záměru MSMT 00216200808. Autor článku deklaruje nepřítomnost střetu zájmů.
LITERATURA
- 1. Eriksson B, Klöppel G, Krenning E, et al. Consensus Guidelines for the Management of Patients with Digestive Neuroendocrine Tumours-Well-Differentiated Jejunal-Ileal Tumor/Carcinoma. Neuroendocrinology 2008; 87: 8-19.
- 2. Modlin IM, Lye KD, Kidd M. A 5-decade analysis of 13,715 carcinoid tumors. Cancer, 2003; 97: 934-959.
- 3. Druce MR, Bharwani N, Akker SA, et al. Intraab dominal fibrosis in a modern cohort of patients with mid-gut carcinoid tumors - a cross-sectional survey from one centre. Abstract, 6th Annual ENETS Conference, 5-7 March 2009, Granada, Španělsko.
- 4. Louthan O. Neuroendokrinní nádory. Klinické pohledy. Praha: Grada 2006; 344 s.
- 5. Gustafsson BI, Tommeras K, Nordrum I, et al. Long- term serotonin administration induces heart valve disease in rats. Circulation 2005; 111: 1517-1522.
- 6. Mac Lennan A. Serotonin, Chemotherapy Tied to Carcinoid Heart Disease Progression. New England Journal of Medicine 2003; 348: 1005-1015.
- 7. Zuetenhorst JM, Korse CM, Bonfrer JM, Bakker RH, Taal BG. Role of natriuretic peptides in the diagnosis and treatment of patients with carcinoid heart disease. British Journal of Cancer 2004; 90: 2073-2079.
- 8. Bhattacharyya S, Davar J, Dreyfus G, Caplin ME. Carcinoid Heart Disease. Circulation 2007; 116: 2860-2865.
- 9. Gustafsson BI, Kidd M, Modlin IM. Small Intestinal Neuroendocrine Tumors. A Century of Advances in Neuroendocrine Tumor Biology and Treatment: 100-111. Editors: Modlin I., Öberg K. Pulished be Felsenstein C.C.C.P. 2007; 464.
- 10. Zuetenhorst JM, Bonfrer GM, Korse CM, Bakker R, van Tinteren H, Taal BG. Carcinoid Heart Disease: the role of urinary 5-hydroxyindoleacetic acid excretion and plasma levels of atrial natriuretic peptide, transforming growth factor-β and fibroblast growth factor. Cancer 2003; 97: 1609-1615.
- 11. Westberg G, Wangberg B, Ahkman H, Bergh CH, Beckman-Suurkula M, Caidahl K. Prediction of prognosis by echocardiography in patients with midgut carcinoid syndrome. British Journal of Surgery 2001; 88: 865-872.
- 12. Nilsson O. Pathology of Intestinal Carcinoids. A Century of Advances in Neuroendocrine Tumor Biologyand Treatment: 268-274. Editors: Modlin I., Öberg K. Published by Felsenstein C.C.C.P. 2007: 464.
- 13. Burke AP, Thomas RM, Elsayed AM, Sobin LH. Carcinoids of the jejunum and ileum: an immunohistochemical and clinicopathologic study of 167 cases. Cancer 1997; 79: 1086-1093.
- 14. Ricke J, Klose, K-J. Imaging Procedures in Neuroendocrine Tumours. Digestion 2000; 62 (Suppl 1): 39-44.
- 15. Zimmer T, Scherübl H, Faiss S, Stölzel U, Riecken E-O, Wiedenmann B. Endoscopic Ultrasonography of Neuroendocrine Tumours. Digestion 2000; 62(Suppl 1): 45-50.
- 16. Voderholzer WA, Ortner M, Rogalla P, Beinholzl J, Lochs H. Diagnostic yield of wireless capsule enteroscopy in comparison with computed tomography enteroclysis. Endoscopy 2003; 35. 1009-1014.
- 17. Modlin IM, Tang LH. Approaches to the diagnoses of gut neuroendocrine tumours: the last word (today). Gastroenterology 1999; 112: 583-590.
- 18. Uhrová J, Louthan O, Zima T. Relationship of chromogranin - A to selected tumour markers and markers of inflammation. Clinical Chemistry and Laboratory Medicine (Abstracts) 2002; 40 (Suppl): S267.
- 19. Giovanella LC. Chromogranin A, a circulating neuroendocrine marker. Biological background, analytical methods and clinical applications. Monograph, Schering 2000; 39 s.
- 20. Nuttall KL, Pingree SS. The incidence of elevations in urine 5-hydroxyindoleacetic acid. Annals of Clinical and Laboratory Science 1998; 28: 167-174.
- 21. Ardill JE, Erikkson B. The importance of the measurement of circulating markers in patients with neuroendocrine tumours of the pancreas and gut. Endocrine Related Cancer 2003; 10: 459-462.
- 22. Loftus JP, van Heerden JA. Surgical management of gastrointestinal carcinoid tumors. Adv Surg 1995; 28: 317-336.
- 23. Chamberlain RS, Canes D, Brown KT, et al. Hepatic neuroendocrine metastases: does intervention alter outcomes? Journal of the American College of Surgeons 2000; 190: 432-445.
- 24. Ahlman H, Wängberg B, Jansson S, Friman S, Olausson M, Tylén U, Nilsson O. Interventional Treatment of Gastrointestinal Neuroendocrine Tumours Digestion 2000; 62 (Suppl1): 59-68.
- 25. Scarpignato, C. Somatostatin Analogs in Cancer Management. Basel: S. Karger AG 2001.
- 26. Tomassetti P, Migliori M, Corinaldesi R, Gullo, L. Treatment of gastroenteropancreatic neuroendocrine tumours with octreotide LAR. Alimentary pharmacology and therapeutics 2000; 14: 557-560.
- 27. Lamberts SWJ, van der Lely AJ, Holland LJ. New somatostatin analogs: will they fulfil old promises? European Journal of Endocrinology 2002; 146: 701-705.
- 28. Ren S, Taylor JE, Culler MD, Melmed S. Functional association of sstr2 and sstr5 in suppression of growth hormone secretion. Proceedings of the Endocrine Society. Denver, 2000; 339 (Abstract).
- 29. Herder WW, Hofland LJ., van der Lely AJ, Lamberts SW. Somatostatin receptors in gastroenteropancreatic neuroendocrine tumours. Endocrine-Related Cancer 2003; 10: 451-458.
- 30. Arnold R, Trautmann ME, Creutzfeldt W, Benning R, Benning M, Neuhaus C. Jurgensen R, Stein K, Schaeffer H, Bruns C, Dennler H-N. Somatostatin analogue octreotide and inhibition of tumour growth in metastatic endocrine gastroenteropancreatic tumours. Gut 1996; 38: 430-438.
- 31. Eriksson B, Öberg K. Summing up 15 years of somatostatin analog therapy in neuroendocrine tumors: future outlook. Annals of Oncology 1999; 10 (Suppl 2): 31-38.
- 32. Kulke HH, Mayer RJ. Carcinoid tumors. New England Journal of Medicine 1999; 340: 858-868.
- 33. Öberg, K. Carcinoid Tumors: Current Concepts in Diagnosis and Treatment. The Oncologist 1998; 3: 339-345.
- 34. Öberg K. Established Clinical Use of Octreotide and Lanreotide in Oncology. Chemotherapy 2001;47: 40-53.
- 35. Arnold R, Rinke A, Müller H-H, et al. Placebo- controlled, double blind, prospective randomized study on the effect of Octreotide LAR in the control of tumor growth in patients with metastatic neuroendocrine midgut tumors: a report from the PROMID Study Group. Presented at: ASCO GI Cancers Symposium, January 2009, San Francisco, USA.
- 36. Arnold R, Simon B, Wied M. Treatment of Neuroendocrine GEP Tumours with Somatostatin Analogues. Digestion 2000; 62 (Suppl 1): 84-91.
- 37. O’Toole D, Ducreux M, Bommelaer G, Wemeau JL, Bouche O, Blumberg J, Ruszniewski P. Treatment of carcinoid syndrome: a prospective crossover evaluation of lanreotide versus octreotide in terms of efficacy patient acceptability and tolerance. Cancer 2000; 88: 770-776.
- 38. Koussis H, Scola A, Cirillo F, Basso U, Ziampiri S, Casara D, Pelizzo MR, Rebustello F, Behboo R, Jirillo A. Alternating lanreotide and octreotide in the treatment of metastatic neuroendocrine tumors (NETs). 44th Annual Meeting, May 30-June 3, 2008, Chicago, USA.
- 39. Frank M, Klose KJ, Ishaque N, Schade-Brittinger C. Combination therapy with octreotide and alpha- interferon: tumour growth in metastatic endocrine gastroenteropancreatic tumours. American Journal of Gastroenterology 1999; 94: 1381-1387.
- 40. Völter V, Peschel C. Is Lanreotide and/or Interferon Alfa an Adequate Therapy for Neuroendocrine Tumors? Journal of Clinical Oncology 2004; 22: 573.
- 41. Öberg K, Eriksson B, Janson ET. The clinical use of interferons in the management of neuroendocrine gastroenteropancreatic tumors. Molecular and Cell Biological Aspects of Gastroenteropancreatic Neuroendocrine Tumor Disease. Annals of the New York Academy of Sciences 1994; 733: 471-478.
- 42. Klby L, Persson G, Franzen S, et al. Randomized clinical trial of the effect of interferon alpha on survival in patients with disseminated midgut carcinoid tumours. British Journal of Surgery 2003; 90: 687-693.
- 43. Öberg K. Interferon in the Management of Neuroendocrine GEP-Tumors Digestion 2000; 62 (Suppl 1): 92-97.
- 44. Faiss S, Pape U-F, Böhmig M, Dörffel Y, Mansmann U, Golder W, Riecken EO, Wiedenmann B. Prospective, Randomized Multicenter Trial on the Proliferative Effect of Lanreotide, Interferon Alfa, and Their Combination for Therapy of Metastatic Neuroendocrine Gastropancreatic Tumors - The International Lanreotide and Interferon Alfa Study Group. Journal of Clinical Oncology 2003; 21: 2689-2696.
- 45. Rougier P, Mitry E. Chemotherapy in the treatment of neuroendocrine malignant tumors. Digestion 2000; 62 (Suppl 1): 73-78.
- 46. Otte A, Mueller-Brand J, Dellas S, Nitsche EU, Herrmann R, Maecke HR. Yttrium-90-labelled somatostatin analogue for cancer treatment. The Lancet 1998; 351: 417-418.
- 47. Lewington WJ. Targeted radionuclide therapy for neuroendocrine tumour. Endocrine-Related Cancer 2003; 10: 497-501.
- 48. Yao JC, Phan A, Hoff PM, Chen HX, Charnsangavej Ch, Yeung S-CJ, Hess K, Chaan N, Abbruzzese JL, Ajani JA. Targeting Vascular Endothelial Growth Factor in Advanced Carcinoid Tumor: A Random Assignment Phase II Study of Depot Octreotide With Bevacizumab and Pegylated Interferon Alfa-2b; Journal of Clinical Oncology 2008; 26: 1316-1323.
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené