Imunohistochemická analýza exprese cyklooxygenázy-2 v premaligních a maligních duktálních pankreatických lezích
Markéta Hermanová Orcid.org 1, Jan Trna Orcid.org 2, Rudolf Nenutil Orcid.org 3, Arona Adamcová Orcid.org , Petr Dítě Orcid.org 4,5
+ Pracoviště
Souhrn
Cíl studie: Cyklooxygenáza-2 (COX-2) je enzymem, který hraje klíčovou roli v procesech zánětu a karcinogeneze. Je molekulou úzce spjatou s onkogenezí pankreatického duktálního adenokarcinomu, která je mnohostupňovým procesem charakterizovaným progresí z normálního duktálního epitelu přes spektrum neinvazivních pankreatických intraepiteliálních neoplazií (PanIN) ve struktury invazivního adenokarcinomu.
Materiál a metodika: Byla provedena imunohistochemická analýza exprese COX-2 v 95 resekátech pankreatu s verifikovaným duktálním adenokarcinomem. Bylo vyšetřeno 95 adenokarcinomů, 155 PanIN lézí a 70 normálních duktů.
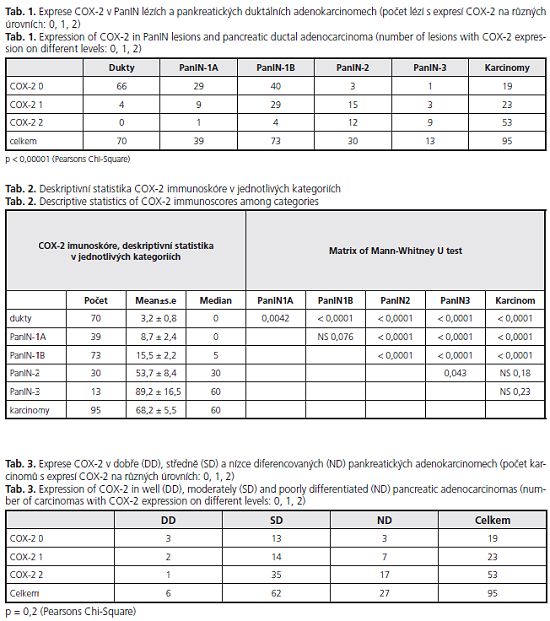
Výsledky: Signifikantní exprese COX-2 byla prokázána u PanIN lézí (52,9 %) a v 76 adenokarcinomech (80 %). Exprese COX-2 narůstala progresivně se závažností duktální léze (p < 0,00001). Byly prokázány statisticky signifikantní rozdíly v expresi COX-2 mezi normálními dukty a low PanIN lézemi (p = 0,0042) i mezi low a high PanIN lézemi (p < 0,0001). Nebyla zjištěna statisticky signifikantní korelace mezi stupněm diferenciace adenokarcinomu a úrovní exprese COX-2 (p = 0,2).
Závěr: Výsledky prezentované podpořily koncept modelu pankreatického duktálního adenokarcinomu a role COX-2 v onkogenezi pankreatického . COX-2 představuje možný terapeutický cíl pro potenciální chemoprevenci pankreatického duktálního adenokarcinomu selektivními inhibitory COX-2.
Klíčová slova: COX-2 - chemoprevence - karcinom pankreatu - PanIN.
ÚVOD
Onkogeneze pankreatického duktálního adenokarcinomu je mnohostupňový proces charakterizovaný progresí z normálního duktálního epitelu přes spektrum neinvazivních intraduktálních lézí označovaných pankreatické duktální intraepiteliální neoplazie (PanIN) struktury invazivního duktálního adenokarcinomu. PanIN léze reprezentují nejčastější, morfologicky definované, prekurzory duktálního adenokarcinomu pankreatu(1,2). Na základě stupně cytonukleárních atypií a architektoniky duktálních lézí jsou definovány jejich jednotlivé typy. PanIN-A a IB reprezentují low grade PanIN léze, PanIN-2 a PanIN-3 definovány jako high grade intraepiteální neoplazie. V PanIN lézích lze identifikovat celou řadu definovaných genetických alterací(3,4). Vyšší grade PanlN léze je asociován s akumulací těchto genetických změn. Progrese z normálního duktálního epitelu přes mírnou a těžkou dysplazii ve struktury invazivního karcinomu je charakterizována sekvencí genetických změn, které mimo jiné zahrnují aktivující bodové mutace K-ras, HER-2/neu, tumor supresorových genů p16, p53, Smad4/DPC4 a BRCA2(5-7).
Přestože neinvazivní prekurzory invazivního duktálního adenokarcinomu, tj. PanlN léze, jsou morfologicky geneticky validně definovány, etiologie karcinomu pankreatu není zcela objasněna. Kromě genetických faktorů hrají roli faktory životního stylu a prostředí, jako je kouření, obezita, dieta s vysokým obsahem tuku a nízká fyzická aktivita. Alkohol sám o sobě zdá se nezvyšuje riziko vzniku pankreatického karcinomu, ale indukuje rozvoj chronické pankreatitidy a diabetes mellitus, u nichž je vztah ke zvýšenému riziku rozvoje karcinomu znám(8). Hereditární i sporadická forma chronické pankreatitidy reprezentují zánětlivá onemocnění se zvýšeným rizikem rozvoje pankreatického karcinomu(9-11). Pankreatický zánět je asociován se zvýšenou produkcí reaktivních oxidativních substancí, cytokinů a prozánětlivých transkripčních faktorů. Mediatory zánětu jsou schopny indukovat genetické poškození, buněčnou proliferaci, inhibovat apoptózu a jejich možná role v karcinogenezi se nabízí(12-14).
Prostaglandin H2 syntáza - cyklooxygenáza (COX) je enzymem, který je zodpovědný za konverzi arachidonové kyseliny na prostaglandiny. Dosud byly identifikovány 2 izoformy, COX-1 a COX-2. COX-1 je konstitučně exprimován v tkáních a uplatňuje se v syntéze prostaglandinů za fyziologických podmínek. Druhá izoforma, COX-2, není až na výjimky za fyziologických podmínek exprimována, ale její exprese je indukována celou řadou signálů. Růstové faktory, cytokiny, mediatory zánětu, oxidanty nebo DNA poškozující agens reprezentují známé induktory exprese COX-2. Za fyziologických podmínek je exprese COX-2 prokazatelná v buňkách endokrinního pankreatu. Recentní práce prokázaly, že intracelulární degradace inzulínu, která je nutná pro udržení optimálního obsahu inzulínu v buňkách, je závislá na aktivitě COX-2(15). Několik prací demonstrovalo roli COX-2 ve vztahu ke karcinogenezi. Zvýšená exprese COX-2 byla popsána v karcinomech tlustého střeva, plic, prsu, jícnu, močového měchýře či prostaty(16). Recentní práce opakovaně prokázaly zvýšenou expresi COX-2 v karcinomech pankreatu. Zvýšená exprese COX-2 byla demonstrována v 56-90 % pankreatických adenokarcinomu(17). Mechanismus, kterým COX-2 stimuluje růst nádorových buněk, není zcela objasněn. Některé studie navrhly roli COX-2 v regulaci nádorové angiogeneze. V buněčných liniích karcinomu pankreatu byla prokázána schopnost COX-2 inhibovat apoptózu, zvyšovat proliferační aktivitu buněk a indukovat expresi vaskulárního endoteliálního růstového faktoru(18-21). Tyto nálezy podpořily hypotézu o roli COX-2 v karcinogenezi pankreatického duktálního adenokarcinomu a navrhly COX-2 jako možný cíl chemoprevence pankreatického duktálního adenokarcinomu selektivními inhibitory COX-2.
Cílem prezentované studie bylo imunohistochemické vyšetření exprese COX-2 nejen ve strukturách invazivního duktálního adenokarcinomu pankreatu, ale i v neinvazivních prekurzorech - PanIN lezích.
MATERIÁL A METODIKA
V rámci studie byly vyšetřeny tkáně resekátů pankreatu s histologický verifikovaným invazivním duktálním adenokarcinomem pacientů, kteří podstoupili v letech 2000-2006 hemipankreato-duodenektomii ve Fakultní nemocnici Brno nebo v Masarykově onkologickém ústavu v Brně. Jiné typy invazivních karcinomů pankreatu nebyly do studie zařazeny. Celkem bylo vyšetřeno 95 resekátů pankreatu. Soubor pacientů zahrnoval 45 mužů a 50 žen průměrného věku 64 let (rozpětí 39-85 let). Šest karcinomů (6,3 %) souboru bylo dobře diferencovaných, šedesát dva (65,3 %) středně diferencovaných a dvacet sedm (28,4 %) nízce diferencovaných. Tkáně resekátů byly fixovány v 10% pufrovaném formalínu 24 hodin. Ve formalínu fixované v parafínu zalité tkáňové bloky byly standardně histologický zpracovány. Tkáňové řezy obarvené hematoxylinem-eosinem byly vyšetřeny za účelem identifikace struktur normálních duktů a/nebo PanIN lézí a/nebo invazivního adenokarcinomu a tyto byly selektovány pro imunohistochemickou analýzu. Grading lézí byl proveden podle standardizovaných kritérií(3). PanIN leze byly identifikovány v 51 z 95 resekátů s pankreatu. Celkem bylo zachyceno a vyšetřeno 39 PanIN-1A lézí, 73 PanIN- IB lézí, 30 PanIN-2 lézí a 13 PanIN-3 lézí. Imunohistochemická analýza exprese COX-2 byla rovněž provedena na 70 normálních duktech.
Pro imunohistochemickou analýzu exprese COX-2 byly 4 um silné tkáňové řezy selektovaných tkáňových bloků deparafinizovány a rehydratovány. Pro imunohistochemickou detekci byla použita polyklonální králičí protilátka proti COX-2 (Santa Cruz Biotechnology, Inc.) ředění 1 : 50. Retrieval antigénu proveden v mikrovlnném histoprocesoru (Milestone) zahříváním v citrátovém pufru (pH 6,0) po dobu 20 minut při teplotě 98 °C. Tkáňové řezy byly inkubovány přes noc s primární protilátkou při teplotě 4 °C. Detekční systém streptavidin-biotin-peroxidáza (rabbit Vectastain Elite kit, Vector Laboratories) aplikován podle pokynů výrobce a 3,3 '-diaminobenzidin (Fluca) a byl použit jako substrát pro vizualizaci pozitivní hnědé imunohistochemické reakce. Tkáňové řezy byly dobarveny Gillovým hemaxylinem. V každém běhu imunohistochemických reakcí byla jako pozitivní kontrola použit COX-2 pozitivní vzorek adenokarcinomu tlustého střeva (imunoskóre 2, viz níže). Jako vnitřní pozitivní kontrola sloužila imunore-aktivita COX-2 v buňkách ostrůvků endokrinního pankreatu(15,22). Jako negativní kontrola sloužily vzorky s vynecháním kroku, při němž je aplikována primární protilátka.
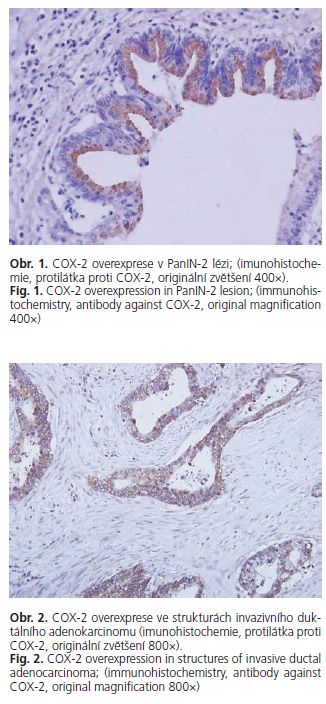
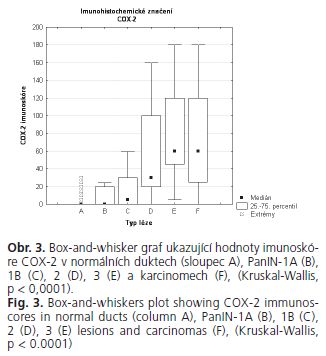
Pro každou hodnocenou PanIN lézi a normální dukty byla imunoreaktivita hodnocena buď ve všech buňkách leze, nebo nejméně ve 200 buňkách. U karcinomů byly hodnoceny nejméně 3 různá reprezentativní zorná pole při vysokém zvětšení 400x.
U každé ze studovaných lézí bylo hodnoceno procento pozitivních buněk a intenzita imunoreakce ve 3 kategoriích: skóre 0, žádná imunopozitivita; skóre 1, slabá intenzita imunoreakce; skóre 2, středně silná až silná intenzita imunoreakce. Konečná hodnota imunoskóre byla určena jako součin procenta pozitivních buněk a skóre intenzity imunoreakce. Podle hodnot byly zařazeny jednotlivé leze do 3 úrovní exprese COX-2: úroveň 0 (imunoskóre < 20); úroveň 1 (imunoskóre 20-49); úroveň 2 (imunoskóre 50-200). U lézí s heterogenní expresí COX-2 bylo počítáno průměrné imunoskóre.
Korelace mezi úrovní exprese COX-2 a typem duktální leze, resp. stupněm diferenciace karcinomu byla hodnocena pomocí kontingenčních tabulek statisticky analyzovaných Pearsonovým Χ2. Pro deskriptívni hodnot imunoskóre mezi jednotlivými kategoriemi a komparaci statistické významnosti rozdílů exprese mezi jednotlivými typy lézí byl využit Mann-Whitneův U test a Kruskal-Wallisova jednocestná analýza. Použit byl SYSTAT statistický programový paket (SPSS Inc., ) a hodnota p < 0,05 byla považována za hladinu statistické významnosti.
VÝSLEDKY
Exprese COX-2 na úrovni 1 či 2 byla prokázána u PanIN lézí (52,9 %) a v 76 karcinomech (80 %) vyšetřovaného souboru (obr. 1, 2). Imunohistochemická analýza exprese COX-2 prokázala statisticky signifikantní korelaci mezi úrovní exprese COX-2 a závažností duktální leze (p < 0,00001), (tab. 1, obr. 3). Po rozdělení duktálních lézí do jednotlivých kategorií byl zjištěn statisticky signifikantní nárůst exprese mezi normálními dukty a low PanIN lézemi (p = 0,0042 pro normální dukty versus PanIN-1 A; p < 0,0001 pro normální dukty versus PanIN-IB) mezi low a high PanIN lézemi (p < 0,0001 pro low PanIN leze versus PanIN-2 i PanIN-3 leze) (tab. 2). Statisticky signifikantní nárůst exprese COX-2 nebyl prokázán mezi high PanIN lézemi a karcinomy. V high PanIN lezích dvou resekátů pankreatu byla exprese COX-2 vyšší než v adenokarcinomu příslušného resekátů. Korelace mezi stupněm diferenciace adenokarcinomu a úrovní exprese COX-2 nedosáhla statistické významnosti (p = 0,2) (tab. 3).
DISKUSE
Vztah mezi chronickým zánětem a rozvojem karcinomu je známý dlouhou dobu a byl pozorován v celé řadě malignit gastrointestinálního traktu. Vztah kolorektálního karcinomu a idiopatických střevních zánětů, chronické B gastritídy karcinomu žaludku, chronické virové hepatitídy hepatocelulárního karcinomu, ezofagitidy a ezofageálního karcinomu a jiných je dobře znám. Opakovaně bylo prokázáno i zvýšené riziko vzniku karcinomu pankreatu v terénu chronické pankreatitidy(9-11). Recentní studie prokázaly, že obdobné spektrum mediátorů chronických zánětlivých procesů je přítomno ve tkáni chronické pankreatitidy i pankreatického karcinomu. Bylo prokázáno, že mediatory zánětu (např. COX-2, jaderný faktor kB, 5-lipo-oxygenáza, interleukin-8) hrají v procesu karcinogeneze pankreatického důležitou spojovací roli mezi chronickým zánětem a karcinomem.
Frekvence výskytu PanIN lézí je výrazně vyšší u pacientů s pankreatitidou(23,24)a PanIN leze pravděpodobně představují morfologickou mezi chronickým zánětem a karcinomem. Předpokládá se, že kouření cigaret přispívá k pankreatické nogenezi cestou aktivace zánětlivé odpovědi(25).
Pouze dvě dosud publikované studie se extenzivně zabývaly vyšetřením exprese COX-2 v premaligních PanIN lezích v pankreatických resekátech(22,26). Maitra et al. studoval expresi COX-2 ve strukturách adenokarcinomů, PanIN lezích i normálních duktech. Práce prokázala signifikantní rozdíly mezi úrovněmi exprese COX-2 v adenokarcinomech i PanIN lezích ve vztahu k normálním duktům. Statisticky signifikantní rozdíly v úrovních exprese COX-2 byly prokázány mezi low a high PanIN lézemi(22). Albazaz et al. prezentoval zvýšenou expresi COX-2 v PanIN lezích, signifikantněji v high PanIN lezích, ve srovnání s normálním epitelem duktů. Současně demonstroval kontinuální nárůst exprese COX-2 v závislosti na stupni závažnosti intraepiteliální neoplastické léze(26). Obě studie navrhly, že COX-2 exprimovaná v signifikantním počtu PanIN lézí by mohla představovat potenciální terapeutický cíl pro chemoprevenci pankreatického v neinvazivním stadiu onkogeneze pankreatického karcinomu (22,26). Naše studie podpořila tyto závěry a prokázala signifikantní vyšší expresi COX-2 v adenokarcinomech a u lézí ve srovnání s normálními dukty. Obecně platí, že exprese COX-2 narůstá směrem od normálních duktů přes low a high PanIN leze až po struktury invazivního karcinomu. Exprese COX-2 na úrovni 1 či 2 byla prokázána u PanIN lézí (52,9 %) a v 76 adenokarcinomech (80,0 %). Byly zastiženy izolované PanIN leze, v nichž byla exprese COX-2 vyšší než ve strukturách invazivního adenokarcinomů příslušného resekátu pankreatu. Podobné nálezy byly rovněž publikovány(22,26) . Alabzaz et al. ve shodě s prací neprokázali statisticky signifikantní nárůst exprese mezi high PanIN lézemi a karcinomy a prokázali vyšší expresi COX-2 v některých high PanIN lezích ve srovnání s asociovaným adenokarcinomem(26). Maitra et al. odhalil vyšší expresi COX-2 v některých PanIN lezích v pankreatickém parenchymu mimo struktury invazivního karcinomu ve 40 % případů(22). Tyto údaje podporují tvrzení, že PanIN leze může reprezentovat nezávislý intraepiteliální neoplastický klon s divergentními molekulárně genetickými aberacemi v individuálních PanIN lezích a adenokarcinomech téhož pankreatu(4).
ZÁVĚR
Získané výsledky podpořily všeobecně akceptovaný koncept modelu progrese pankreatického duktálního adenokarcinomu z normálního duktálního epitelu přes spektrum PanIN lézí ve struktury invazivního karcinomu. COX-2 současně reprezentuje potenciální cíl pro chemoprevenci selektivními inhibitory COX-2 v neinvazivních stadiích pankreatické karcinogeneze.
LITERATURA
- 1. Maitra A, Fukushima N, Takaori K, Hruban RH. Precursors to invasive pancreatic cancer. Adv Anat Pathol 2005; 12: 81-91.
- 2. Biankin AV, Kench JG, Dijkman FP, Biankin SA, Henshall SM. Molecular pathogenesis of precursor lesions of pancreatic ductal adenocarcinoma. Pathology 2003; 35: 14-24.
- 3. Hruban RH, Adsay NV, Albores-Saavedra J, Compton C, Garrett ES, Goodman SN, et al. Pancreatic intraepithelial neoplasia: a new nomenclature and classification system for pancreatic duct lesions. Am J Surg Path 2001; 25: 579-586.
- 4. Hruban RH, Wilentz RE, Kern SE. Genetic progression in the pancreatic ducts. Am J Pathol 2000; 156: 1821-1825.
- 5. Hruban RH, van Mansfeld AD, Offerhaus GJ, van Weering DH, Allison DC, Goodman SN, et al. K-ras Oncogene Activation in Adenocarcinoma of the Human Pancreas. Am J Pathol 1993; 143: 545-554.
- 6. Rozenblum E, Schutte M, Goggins M, Hahn SA, Panzer S, Zahurak M, et al. Tumor-suppressive pathways in pancreatic carcinoma. Cancer Res 1997; 57: 1731-1734.
- 7. Kloppel G, Luttges J. The pathology of ductal type pancreatic carcinomas and pancreatic intraepithelial neoplasia: insights for clinicians. Curr Gatroenterol Rep 2004; 6: 111-118.
- 8. Welsch T, Kleeff J, Seitz HK, Buchler P, Friess H, Buchler MW. Update on pancreatic cancer and alcohol-associated risk J Gastroenterol Hepatol 2006; 21: 69-75.
- 9. Malka D, Hammel P, Maire F, Rufat P, Madeira I, Pessione F, et al. Risk of pancreatic adenocarcinoma in chronic pancreatitis. Gut 2002; 51: 849-852.
- 10. Lowenfels AB, Maisonneuve P, Cavallini G, Ammann RW, Lankisch PG, Andersen JR, et al. Pancreatitis and the risk of pancreatic cancer. N Engl J Med 1993; 328: 1433-1437.
- 11. Howes N, Neoptolemos JP. Risk of pancreatic ductal adenocarcinoma in chronic pancreatitis. Gut 2002; 51: 765-766.
- 12. Farrow B, Sugiyama Y, Chen A, Uffort E, Nealon W, Evers BM. Inflammatory mechanisms contributing to pancreatic cancer development. Ann Surg 2004; 239: 763-771.
- 13. Garcea G, Dennison AR, Steward WP, Berry DP. Role of the inflammation in pancreatic carcinogenesis and the implications for future therapy. Pancreatology 2005; 5: 514-529.
- 14. Farrow B, Evers BM. Inflammation andthe development of pancreatic cancer. Surg Oncol 2002; 10:153-169.
- 15. Sandberg M, Borg LA. Intracellular degradation of insulin and crinophagy are maintained by nitric oxide and cyclo-oxygenase 2 activity in isolated pancreatic islets. Biol Cell 2006; 98: 307-315.
- 16. Dannenberg AJ, Altorki NK, Boyle JO, Dang C, Howe LR, Weksler BB, et al. Cyclo-oxygenase 2: A pharmacological target for the prevention of cancer. Lancet Oncol 2001; 2: 544-551.
- 17. Kokawa A, Kondo H, Gotoda T, Ono H, Saito D, Nakadaira S, et al. Increased expression of cyclooxy-genase-2 in human pancreatic neoplasms and potential chemoprevention by cyclooxygenase inhibitors. Cancer 2001; 91: 333-338.
- 18. Chu J, Lloyd FL, Trifan OC, Knapp B, Rizzo MT. Potential involvement of cyclooxygenase-2 pathway in the regulation of tumor associated angiogenesis and growth in pancreatic cancer. Mol Cancer Ther 2003; 2: 1-7.
- 19. Kong G, Kim EK, Kim WS, Lee KT, Lee YW, Lee JK, et al. Role of cyclooxygenase-2 and inducible nitric oxide synthase in pancreatic cancer. J Gastroenterol Hepatol 2002; 17:914-921.
- 20. Ding XZ, Tong WG, Adrian TE. Blockade of cyclooxygenase-2 inhibits proliferation and induces apoptosis in human pancreatic cancer cells. Anticancer Res 2000; 20: 2625-2631.
- 21. Eibl G, Bruemmer D, Okada Y, Duffy JP, Law RE, Reber HA, et al. PGE (2) is generated by specific COX-2 activity and increases VEGF production in COX-2 expressing human pancreatic cancer cells. Biochem Biophys Res Commun 2003; 306: 887-897.
- 22. Maitra A, Ashfaq R, Gunn CR, Rahman A, Yeo CJ, Sohn TA, et al. Cyclooxygenase 2 expression in pancreatic adenocarcinoma and pancreatic intraepithelial neoplasia. Am J Clin Pathol 2002; 118: 194-201.
- 23. Volkholz H, Stolte M, Becker V. Epithelial dysplasias in chronic pancreatitis. Virchows Arch A Pathol Anat Histol, 1982, 396, 331-349.
- 24. Tannapfel A, Witzigmann H, Wittekind C. Pancreatic intraepithelial neoplasia in chronic pancreatitis. Zentralbl Chir 2001, 126, 879-883.
- 25. Malfertheiner P, Schutte K. Smoking - a trigger for chronic inflammation and cancer development in the pancreas. Am J Gastroenterol 2006; 101: 160-162.
- 26. Albazaz R, Verbeke CS, Rahman SH, McMahon MJ. Cyclooxygenase-2 expression associated with severity of PanIN lesions: a possible link between chronic pancreatitis and pancreatic cancer. Pancreatology 2005; 5: 361-369.
Práce byla uskutečněna s podporou grantu IGA MZ č. 9295-3.
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené