Genové polymorfismy jako predispoziční faktor IBD - jejich vztah ke klinické manifestaci a farmakoterapii onemocnění
Ladislava Bartošová Orcid.org 1, Michal Kolorz Orcid.org , Jan Hošek Orcid.org , Dana Dvořáčková Orcid.org , Peter Loučka Orcid.org , Vladimír Zbořil Orcid.org 2, Marián Bátovský Orcid.org 3, Petr Dítě Orcid.org 4,5, Milan Bartoš Orcid.org
+ Pracoviště
Souhrn
Cíl. Sledovali jsme výskyt nestandardních alel v genech NOD2/CARD15, ICAM-1 a CCR5 u pacientů s IBD a u zdravých dobrovolníků. Přítomnost nestandardních alel jsme statisticky hodnotili jak z hlediska výskytu obou forem onemocnění (CD a UC), tak z hlediska jejich možného vztahu ke klinickým charakteristikám onemocnění. Dále jsme sledovali gen kódující enzym TPMT a analyzovali asociaci zjištěných polymorfismů s výskytem leukopenie - závažného nežádoucího účinku terapie azathioprinem.
Materiál a metodika. DNA byla izolována z periferní krve. Ke genotypizaci byla použita metoda PCR a její modifikace PCR-REA, multiplex PCR a Real-Time PCR. Pro statistické vyhodnocení výsledků byl použit χ2-test. Celkem jsme sledovali přítomnost nestandardních alel u osmi polymorfismů ve čtyřech různých genech.
Výsledky. Potvrdili jsme statisticky významné rozdíly v četnosti výskytu některých genových polymorfismů mezi skupinami zdravých osob a mezi pacienty s CD resp. UC. Leukopenie, jako nežádoucí účinek léčby azathioprinem se vysoce signifikantně častěji vyskytovala u pacientů, kteří měli v genotypu některou ze čtyř nestandardních alel v genu pro enzym TPMT.
Závěr. Existují genové polymorfismy, které se signifikantně častěji vyskytují u pacientů s CD než u zdravých jedinců, resp. nemocných s UC. Stanovení genotypu TPMT u pacienta před terapií azathioprinem má své opodstatnění a může zabránit výskytu závažné leukopenie.
Klíčová slova: CCR5, Crohnova choroba, genové polymorfismy, ICAM-1, NOD2/CARD15, TPMT, ulcerózní kolitida.
ÚVOD
Nespecifické střevní záněty (IBD) jsou chronická zánětlivá onemocnění trávicího traktu. Tento pojem zahrnuje dvě samostatné klinické jednotky - Crohnovu chorobu (CD) a ulcerózní kolitidu (UC), které se vzájemně liší anatomickou lokalizací, intenzitou a rozsahem postižení střevní sliznice. Etiologie obou onemocnění je doposud neznámá. Řada studií potvrzuje multifaktoriální etiologii těchto onemocnění - na jejich vzniku se podílejí faktory zevního prostředí společně s genetickou predispozicí(1). Riziko onemocnění Crohnovou chorobou je 3-5× vyšší v příbuzenstvu prvního stupně a familiární výskyt byl zjištěn u 15-20 % případů onemocnění. V této souvislosti se hovoří se o tzv. "kandidátních genech", tj. genech, jejichž produkty nějakým způsobem ovlivňují průběh zánětlivé reakce. Mezi kandidátní geny patří například geny NOD2/CARD15, ICAM-1, CCR5 , MDR1, TLR4 a další. V současnosti existuje dostatek článků popisujících jejich vztah k rozvoji Crohnovy choroby (2-4), proto se stručně zmíním pouze o genových polymorfismech, kterým jsme se v naší práci věnovali experimentálně.
Gen NOD2/CARD15 obsahuje minimálně tři nukleotidové polymorfismy spojené s CD označované Arg702Trp (R702W), Gly908Arg (G908R) a 3020insC (Leu1007fs insC) (5). Mutace Leu1007fs insC je spojena se sníženou aktivací NF-.B(1,6), rovněž dvě další mutace Arg702Trp a Gly708Arg vedou ke snížení aktivity NF-.B, ale v menším rozsahu(6). U pacientů s CD s mutacemi v genu CARD15/NOD2 byla zaznamenána rovněž snížená exprese defenzinů(7). Mutace tak mohou predisponovat k CD nejen přímo, ale i nepřímo, tj. omezením přirozené antimikrobiální imunity zprostředkované defenziny.
V posledních letech je rovněž intenzivně zkoumána asociace mezi IBD a genem ICAM-1. Tento gen kóduje intracelulární adhezivní molekulu ICAM-1, která má v organismu četné fyziologické funkce. Řídí migraci zánětlivých elementů, podílí se na prezentaci antigenu, a jelikož je exprimována různými typy buněk, je zapojena do celé řady signálních kaskád organismu(8). Bylo zjištěno, že při zánětlivých střevních onemocněních je jeho exprese ve střevní mukóze významně zvýšena. V genu ICAM-1 bylo identifikováno nejméně dvacet jednonukleotidových polymorfismů. S nespecifickými střevními záněty bývá spojován SNP nesoucí označení Lys469Glu (K469E)(9). Substituční změna nukleotidů vede k záměně aminokyseliny na páté imunoglobulinové doméně ICAM-1, která je důležitá pro adhezi B-buněk a dendritických buněk(10). Změna funkce proteinu ICAM-1 pak potenciálně přispívá ke genetickým predispozicím k zánětlivým a imunitním onemocněním. Prevalence Lys469Glu polymorfismu se dává do souvislosti také s roztroušenou sklerózou(11), Behcetovou chorobou(12), psoriatickou artritidou a revmatoidní artritidou(13) a dalšími chronickými zánětlivými onemocněními(14).
Dalším genem, který zasahuje do reakcí imunitního systému, je gen kódující receptor CCR5, jehož ligandem jsou CC chemokiny. Mezi endogenní funkce tohoto receptoru patří mobilizace příslušných buněk imunitního systému a směřování jejich chemotaxe do místa zánětu. Jeho regulační úloha spočívá v preferenci Th1 imunitní odpovědi, a naopak supresi Th2 imunitní cesty. Podílí se například na imunitní obraně proti infekci Mycobacterium tuberculosis(15).
V poslední dekádě minulého století bylo zjištěno, že se gen pro tento receptor vyskytuje v populaci v různých alelických formách. Studována je především delece 32 párů bází v genu CCR5, jež vede k expresi zkráceného, a tudíž nefunkčního receptoru na membráně buněk a následné poruše v komunikaci mezi buňkami imunitního systému. S touto deleční mutací je spojován vznik patologických zánětlivých stavů, jako jsou sarkoidóza(16), revmatoidní artritida(17) nebo periodontitida(18). Porucha buněčné imunity v důsledku nefunkčnosti receptoru CCR5 by mohla sehrát svou roli i v rozvoji IBD.
Crohnova choroba je v současnosti nemocí nevyléčitelnou, neexistuje kauzální farmakoterapeutické řešení, avšak pomocí moderních preparátů ji lze často úspěšně ovládat. Léčba je přísně individuální podle stupně a rozsahu postižení. Léčivy první volby jsou protizánětlivě působící aminosalicyláty. Podle intenzity onemocnění jsou doplňovány glukokortikoidy nebo imunosupresivy. Z důvodu dlouhodobého podávání těchto léčiv se klade důraz na bezpečnost a maximální efektivitu farmakoterapie. Jsou proto sledovány také polymorfismy v tzv. "terapeutických genech". Přítomnost nestandardních alel v těchto genech může vést k dysfunkci proteinu (enzymu, receptoru, signální molekuly aj.), který se podílí na metabolismu nebo účinnosti léčiva. V této práci jsme se věnovali třem polymorfismům genu kódujícího enzym thiopurin S-methyl transferázu (TPMT)(19), u nichž je prokázán vliv na snížení aktivity enzymu. V případě snížení aktivity enzymu a následném zpomalení eliminace léčiva azathioprinu může dojít i při standardním dávkování k akumulaci metabolitu 6-merkaptopurinu(19,20) a výskytu výrazných nežádoucích účinků léčiva. Z toho vyplývá, že pacienti, u kterých se v genu nachází jedna z hledaných nestandardních alel, mohou být po podání běžné terapeutické dávky azathioprinu vystaveni fatální myelosupresi a v jejím důsledku leukopenii častěji než pacienti se standardní formou tohoto genového polymorfismu.
CÍL PRÁCE
Cílem první části naší studie (experimentální část A a B) bylo stanovit u pacientů s klinicky prokázanou Crohnovou chorobou, ulcerózní kolitidou a u zdravých dobrovolníků frekvenci výskytu nestandardních alel polymorfismu Lys469Glu v genu ICAM-1, dvou SNP-polymorfismů (Arg702Trp, Gly908Arg) a jedné posunové mutace (Leu1007fsinsC) v genu NOD2/CARD15 a deleční mutace o velikosti 32 bp v genu CCR5. Výskyt nestandardních alel v těchto genech poté statisticky vyhodnotit jak z hlediska výskytu obou onemocnění (CD a UC) obecně, tak i ve vztahu k jednotlivým klinickým charakteristikám onemocnění. Cílem druhé části studie (experimentální část C) bylo určit vztah mezi přítomností nestandardních alel tří polymorfismů (G238C, G460A, A719G) v genu TPMT a výskytem leukopenie u pacientů užívajících azathioprin.
MATERIÁL A METODIKA
K určení všech sledovaných polymorfismů (části práce A až C) jsme využili metodu PCR, PCR doplněnou o restrikční štěpení (PCR-REA), real-time PCR nebo multiplex PCR. Všechny metodiky pro detekci jednotlivých polymorfismů byly převzaty z literárních zdrojů a optimalizovány. DNA byla izolována z periferní krve pomocí komerčních souprav. Podrobnější metodika je uvedena v našem předchozím článku(21).
Statistická analýza
Asociace přítomnosti nestandardních alel (s CD či UC) s výskytem choroby, jejími klinickými projevy a výskytem nežádoucích účinků terapie byla statisticky vyhodnocena χ2-testem dvou četností (software Unistat 5.1). Poměr šancí (odds ratio, OR) a 95% interval spolehlivosti (95% CI, confidence interval) byly vypočítány pomocí internetového kalkulátoru http://www.hutchon.net/ConfidOR.htm.
Část A. Genové polymorfismy jako predispoziční faktor výskytu IBD onemocnění
Soubor, který jsme testovali, byl složen ze 101 pacientů s diagnostikovanou CD, 35 pacientů UC a 78 nepříbuzných zdravých dobrovolníků. Ve všech třech testovaných skupinách jsme sledovali četnost výskytu nestandardních alel v genech NOD2/CARD15, ICAM-1 a CCR5.
Část B. Genové polymorfismy a jejich vztah ke klinickým projevům IBD onemocnění
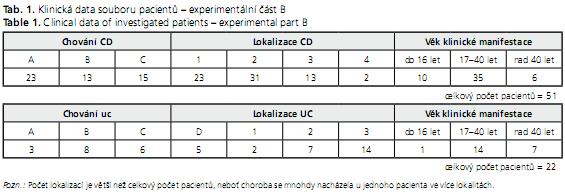
Kompletní klinická data jsme měli k dispozici od 73 pacientů (51 pacientů s CD a 22 pacientů s UC) navštěvujících gastroenterologická pracoviště v Brně- Bohunicích (54 %), v Bratislavě (43 %) a Trenčíně (3 %). Průměrný věk pacientů s CD byl 35,7 let. Ženy tvořily 40 %, muži 60 %. U pacientů s UC byl průměrný věk 43,1 let, žen bylo 54 % a mužů 46 %.
Pro charakterizaci onemocnění jsme využili prvky Vídeňské a Montrealské klasifikace a vypracovali zjednodušený systém klasifikace (viz níže), ve kterém jsme sledovali věk, kdy došlo k první klinické manifestaci onemocnění, anatomickou lokalizaci onemocnění a aktivitu zánětu. Monitorovali jsme také nikotinismus, nebo» podle literárních údajů působí kouření v případě CD jako rizikový faktor, u UC jsou naopak předpokládány protektivní účinky. Klinické údaje jsme získávali z dotazníku a lékařské dokumentace, souhrn základních klinických dat genotypizovaných pacientů je uveden v tabulce 1.
U všech pacientů byla provedena genotypizace v genech NOD2/CARD15, ICAM-1 a CCR5 (viz experimentální část A).
Hodnocené parametry
Pacienty s CD, resp. UC jsme rozčlenili podle lokalizace a chování do následujících skupin:
Lokalizace CD:
1 = terminální ileum
2 = colon
3 = ileocolon
4 = horní část GIT
Chování CD:
A = peforující - agresivní
B = stenózující - indolentní
C = nestenozující a neperforující
Lokalizace UC:
1 = distální tvar
2 = levostranný tvar
3 = extenzivní tvar
Chování (aktivita) UC:
A = bez aktivity
B = nízká aktivita
C = střední aktivita
D = vysoká aktivita
Podle věku prvotní klinické manifestace byli pacienti CD i UC rozčleněni podle kritérií Montrealské konference do tří věkových skupin - do 16 let, 17-40 let a nad 40 let.
Část C. Genové polymorfismy a jejich vztah k výskytu nežádoucích účinků farmakoterapie
Genotypizovaný soubor byl tvořen 83 pacienty s IBD (64 s CD a 19 s UC), kteří byli léčeni azathioprinem. 63 z nich vykazovalo normální reakci na léčbu, 20 z nich bylo k léčbě intolerantních. Sledovány byly tři polymorfismy charakteru jednonukleotidové substituce v genu TPMT. Jejich vzájemnou kombinací jsou dány čtyři typy nestandardních alel označované TPMT*2, TPMT*3A, TPMT*3B, TPMT*3C.
VÝSLEDKY
Část A. Genové polymorfismy jako predispoziční faktor výskytu IBD onemocnění
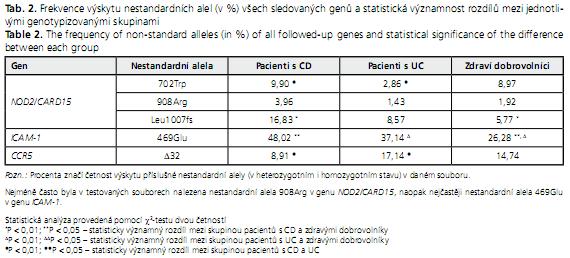
Četnosti výskytu nestandardních alel sledovaných polymorfismů ve skupině pacientů s CD, UC a ve skupině zdravých dobrovolníků jsou shrnuty v tabulce 2. Provedli jsme statistickou analýzu ke zjištění asociace mezi přítomností nestandardních alel jednotlivých polymorfismů a výskytem obou forem IBD. Z našich výsledků vyplývá, že mutace Arg702Trp genu NOD2/CARD15 se vyskytuje statisticky méně často (P < 0,05) u pacientů s ulcerózní kolitidou v porovnání s pacienty trpícími Crohnovou chorobou. Posunová mutace 1000fs v tomtéž genu se vyskytuje signifikantně častěji (P < 0,05) u pacientů s diagnostikovanou CD v porovnání se skupinou kontrolní. V souboru pacientů s CD se statisticky vysoce významně (P < 0,01) častěji než v kontrolní skupině vyskytuje rovněž nestandardní alela polymorfismu Lys469Glu v genu ICAM-1. Výskyt této nestandardní alely je i ve skupině pacientů s UC statisticky významně (P < 0, 05) vyšší než ve skupině kontrolní. Deleční alela δ32 genu pro CCR5 je statisticky méně častá (P < 0,05) u pacientů s CD oproti pacientům trpícím ulcerózní kolitidou.
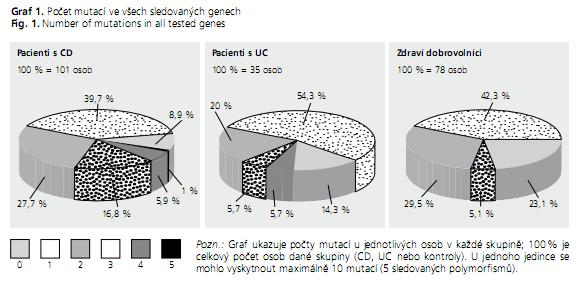
U všech osob jsme spočítali celkový počet mutací všech pěti námi sledovaných polymorfismů (graf 1). Mezi souborem pacientů s Crohnovou chorobou a kontrolou jsme nalezli statisticky vysoce významný rozdíl (P = 0,0019) v počtu mutací. Znamená to tedy, že zdraví dobrovolníci mají signifikantně méně mutací ve sledovaných polymorfismech v porovnání s pacienty s CD. Statistická významnost nebyla potvrzena mezi skupinou pacientů s ulcerózní kolitidou a skupinou zdravých dobrovolníků.
Pro každou skupinu (CD, UC, kontrola) byl rovněž stanoven celkový počet mutací v genu NOD2/CARD15 (sledovali jsme celkem tři nezávislé polymorfismy) připadající na jednu osobu. Statistická analýza potvrdila, že průměrný počet mutací v genu NOD2/CARD15 je ve skupině pacientů s CD (0,61) statisticky významně (P < 0,05) větší než je tomu u pacientů s UC (0,26), resp. u zdravých dobrovolníků (0,33).
Část B. Genové polymorfismy a jejich vztah ke klinickým projevům IBD onemocnění
Všechny hodnocené klinické parametry byly statisticky vyhodnoceny z hlediska jejich možné asociace s výskytem každé z pěti nestandardních alel jednotlivě i s celkovým množstvím těchto nestandardních alel. Sledován byl i vztah k počtu mutací v genu NOD2/CARD15. Uvedeny jsou zde však pouze výsledky statisticky významné, či se statistické významnosti blížící.
1. Vliv genotypu na věk klinické manifestace CD
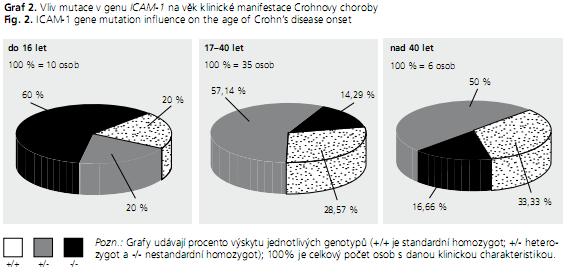
Pacienti, u nichž propukla CD před 16. rokem života, se statisticky vysoce významně (P < 0,01) liší genotypem v genu ICAM-1 od pacientů, u nichž propukla mezi 17. až 40. rokem (graf 2).
2. Vliv genotypu na lokalizaci onemocnění CD
Statistickou asociaci mezi lokalizací Crohnovy choroby a počtem nestandardních alel v genu NOD2/CARD15 jsme nenalezli, statistické významnosti se však blížily analýzy, v nichž jsme sledovali zastoupení nestandardních alel v genu NOD2/CARD15 u pacientů CD. Až zpracování kompletních klinických dat ukáže, zda mezi lokalizací onemocnění a výskytem těchto alel, co do počtu i co do typu, je nebo není statisticky významná asociace.
3. Vliv genotypu na chování onemocnění CD
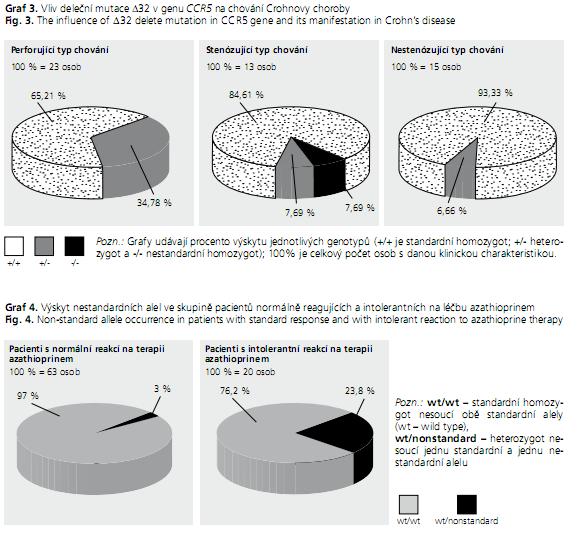
U pacientů s CD, kteří mají v genomu deleční alelu δ32 v genu CCR5 se signifikantně (P < 0,05) častěji vyskytuje perforující forma onemocnění v porovnání s nestenózující formou onemocnění (graf 3).
4. Vliv kouření na CD a UC
V obou skupinách pacientů výrazně převažovali nekuřáci. Mezi pacienty s CD bylo 76,5 % nekuřáků a mezi UC dokonce 95,5 % nekuřáků. Při srovnání poměru kuřáků a nekuřáků v obou skupinách jsme nalezli statistickou významnost (P < 0,05) v tomto poměru. Mezi pacienty s CD se vyskytovali kuřáci signifikantně častěji než mezi pacienty s UC.
Část C. Genové polymorfismy a jejich vztah k výskytu nežádoucích účinků farmakoterapie
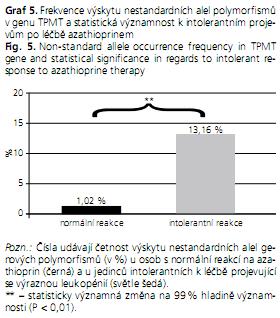
Ve skupině pacientů reagujících na terapii azathioprinem standardně byly pouze 3 % osob nesoucích alespoň jednu nestandardní alelu, zatímco ve skupině pacientů, u nichž byla po podání běžné dávky azathioprinu potvrzena leukopenie, neslo alespoň jednu nestandardní alelu 23,8 % osob. Frekvence výskytu nestandardních alel genu TPMT dosahovala tedy ve skupině pacientů s normální odpovědí na léčbu azathioprinem 1,02 %, naopak ve skupině intolerantních pacientů byla frekvence výskytu nestandardních alel desetinásobně vyšší a dosahovala více než 13 % (graf 4 a 5). Statistická analýza potvrdila, že asociace mezi genotypem TPMT a výskytem leukopenie po podání azathioprinu je vysoce signifikantní (P < 0,01).
DISKUSE
Incidence nespecifických střevních zánětů v celé západní Evropě rok od roku vzrůstá. Ačkoliv dosud není s definitivní platností potvrzena etiopatogeneze choroby, je v současné době všeobecně akceptováno, že nespecifické střevní záněty jsou onemocněním s genetickým podkladem, přičemž interakce s vnějším prostředím se stává spouštěcím faktorem propuknutí choroby(22). Dědičné predispozice mají u Crohnovy choroby větší význam než u ulcerózní kolitidy, do rozvoje nemoci je však zapojeno více produktů více genů, neexistuje zde jednoduchá mendelistická dědičnost(23).
S genetickou predispozicí je nejčastěji spojován gen NOD2/CARD15. V naší studii jsme sledovali tři polymorfismy v tomto genu. Alespoň jednu nestandardní alelu mělo 56,3 % pacientů s CD, zatímco u pacientů s UC to bylo pouze 14,6 % a u zdravých dobrovolníků 20 %. K obdobným procentuálním hodnotám došli také autoři Hradský a kol.(24). V jejich souboru bylo nositeli alespoň jedné nestandardní alely tohoto genu 46 % pacientů s CD a 21 % zdravé kontroly. Zajímavé je, že recesivní homozygoti (nositelé dvou nestandardních alel v genu NOD2/CARD15) se v naší studii vyskytovali pouze ve skupině pacientů s Crohnovou chorobou. K obdobným závěrům došli i jiní autoři(25). Nejvýraznější klinický dopad, a tedy nejsilnější asociace byla popsána u posunové mutace (Leu1007fs insC) v tomto genu. Nositelé jedné mutantní alely mají 2-4× vyšší riziko propuknutí CD a recesivní homozygoti dokonce 20-40× vyšší(26). I v našem testovaném souboru vykázala tato posunová mutace nejsilnější asociační vztah ke Crohnově chorobě (tab. 2).
Druhá sledovaná mutace v tomto genu (Arg702Trp) se signifikantně nejméně často vyskytovala u pacientů s UC při porovnání s CD. U třetí sledované mutace genu Gly908Arg jsme nezjistili žádnou statistickou asociaci (tab. 2). Výskyt této alely v české a slovenské populaci je velmi nízký - alelová frekvence se ve skupině zdravých dobrovolníků pohybovala do 2 %. K podobným výsledkům došel i Brant a kol., kteří nezaznamenali statisticky významný rozdíl ve výskytu této mutace mezi nemocnými s CD a zdravými jedinci(25). Posunovou mutaci 1007fs potvrdili jako nejsilnější asociační mutaci v genu NOD2/CARD15 ve své práci také Hradský a kol. 2008(24). Na rozdíl od našich výsledků zjistili ve svém rozsáhlejším souboru pacientů signifikantní vztah ke Crohnově chorobě i u mutace Gly908Arg.
Všechny současné studie poukazují na skutečnost, že genetická predispozice k IBD onemocněním je polygenní, tj., že do procesu patogeneze jsou zapojeny produkty více genů a přítomnost jednotlivých mutací má kumulativní charakter, tj. s výskytem většího počtu mutací v tomtéž genu vzrůstá pravděpodobnost závažného postižení proteinu kódovaného tímto genem. Naše výsledky potvrdily, že průměrný počet mutací v genu NOD2/CARD15 přepočtený na jednu osobu je signifikantně (P < 0,05) nejvyšší ve skupině pacientů s CD oproti UC i oproti kontrole, zatímco pacienti s diagnózou UC měli výskyt těchto mutací dokonce nesignifikantně nižší než skupina kontrolní. Zdá se tedy, že výskyt nestandardních alel v genu NOD2/CARD15 je skutečně typický pro pacienty s Crohnovou chorobou(1).
Gen ICAM-1 hraje klíčovou roli v migraci neutrofilů k místu zánětu a má spojitost s některými zánětlivými nemocemi(14). Výrazně zvýšenou četnost nestandardní alely polymorfismu Lys469Glu v tomto genu zaznamenal mezi japonskými pacienty s Crohnovou chorobou Matsuzawa(14). Také v našem souboru jsme potvrdili silnou asociaci mezi výskytem nestandardní alely tohoto polymorfismu a výskytem Crohnovy choroby (P = 0,0002). Až 83 % pacientů trpících Crohnovou chorobou bylo nositeli dvou nestandardních alel v tomto genu, ale pouze 0,6 % pacientů trpících ulcerózní kolitidou a necelé procento osob zdravých. Při výpočtu poměru šancí (OR) u našeho souboru osob jsme vypočetli, že riziko vzniku CD je u těchto recesivních homozygotů 10,6× (95% CI = 2,9-38,7) vyšší než u osob se standardními alelami v genu ICAM-1 a u UC 3, 1× (95% CI = 0,55-17,35) vyšší.
Herfarth a kol.(27) navrhli ve své práci hypotézu, že by mutace v chemokinových receptorech CCR5 mohly hrát centrální roli v regulaci intestinální imunitní odpovědi u CD. Nepodařilo se jim sice zaznamenat vyšší výskyt mutantní alely δ32 u pacientů s CD, ale objevili, že polymorfismus v CCR5 receptoru může participovat na průběhu nemoci a její lokalizaci. Výsledky naší studie ukazují, že pacienti s CD mají signifikantně méně často deleční alelu δ32 v genu CCR5 než pacienti s UC. Pacienti s ulcerózní kolitidou mají deleční alelu dokonce častěji než zdraví dobrovolníci, ovšem nesignifikantně (tab. 2).
Z dostupných literárních dat je zřejmé, že genetické faktory rozhodují také o charakteru IBD onemocnění, především Crohnovy choroby. U monozygotních dvojčat nemocných CD byla v sedmi případech z devíti zjištěna shoda v lokalizaci nemoci, v šesti případech z devíti byla choroba diagnostikována v rozmezí dvou let. Chování nemoci však shodu nevykazovalo(5). Poněvadž jsme měli provedenu genetickou analýzu u více než 130 pacientů s IBD, zajímalo nás, zda dojdeme u českých a slovenských pacientů ke stejným závěrům jako autoři zahraniční. Pomocí statistické analýzy χ2-testem jsme se pokusili najít statistický rozdíl v zastoupení jednotlivých genotypů u pacientů s daným klinickým projevem.
Podle literárních údajů mohou být mutace v genu CARD15/NOD2 spojeny s postižením ilea, resp. s přednostním výskytem zánětu v ileocékální oblasti(23) a se stenózujícím typem choroby(5,28). Diskutován je i vliv mutací v tomto genu na věk propuknutí Crohnovy choroby(29). Žádný z těchto předpokladů jsme však v našem souboru pacientů statisticky nepotvrdili.
Nositelé deleční mutace δ32 v genu CCR5 mají podle Herfartha(27) méně často postiženou horní část gastrointestinálního traktu, jsou však náchylnější k vývoji striktur. Deficience receptoru CCR5 působí protektivně proti agresivnějšímu průběhu nemoci (perforující nebo fistulující) v důsledku absence CCR5-exprimujících buněk a z ní vyplývající snížené schopnosti buňky vyvolávat zánětlivou odpověď(27). Naše výsledky však ukázaly, že při perforujícím typu chování CD se u pacientů vyskytuje statisticky významně častěji deleční alela δ32 v porovnání s pacienty s nestenózující formou onemocnění, u nichž je výskyt této deleční alely signifikantně nižší.
Naše statistické analýzy potvrdily asociaci polymorfismu v genu ICAM-1 s věkem propuknutí Crohnovy choroby. Výskyt nestandardní alely 469Glu v genu ICAM-1 a» již v heterozygotním, nebo homozygotním stavu je u pacientů, u nichž propukla CD do 16 let života, statisticky vysoce významně vyšší než u pacientů, u nichž propukla mezi 17. až 40. rokem (graf 2). Nepotvrdili jsme však zjištění Hradského a kol. 2008(24), že posunová mutace 1007fs v genu NOD2/CARD15 se vyskytuje častěji u dětských pacientů s CD než u pacientů dospělých, a to pravděpodobně proto, že skupina pacientů s velmi ranou klinickou manifestací choroby čítala pouze 10 osob. Přesto i naše výsledky poukazují na skutečnost, že čím mladší pacienti, tím je u nich větší genetická predispozice k onemocnění. Například tři a více mutací ve všech námi sledovaných kandidátních genech má 46,2 % mladých pacientů, u nichž se klinické projevy onemocnění objevily do 16 let věku, ale pouze 26,3 % pacientů s klinickou manifestací mezi 17. a 40. rokem věku a 0 % pacientů, u nichž se Crohnova choroba objevuje až ve věku nad 40 let. Co se týče sledování nikotinismu, patří většina pacientů v obou podskupinách mezi nekuřáky. Přesto jsme našli mezi pacienty s CD 23,5 % kuřáků (současných) a mezi pacienty s UC 4,6 % kuřáků. Statistická analýza nám potvrdila, že zastoupení kuřáků je mezi pacienty s Crohnovou chorobou signifikantně (P < 0,05) vyšší než u pacientů s ulcerózní kolitidou. Toto zjištění může souviset s faktem, že pro Crohnovu chorobu je kouření považováno za rizikový faktor, zatímco u ulcerózní kolitidy za faktor ochranný.
Ve druhé části naší práce jsme sledovali geny, které bývají nazývány geny terapeutickými. Kódují proteiny (enzymy, receptory aj.), které se významným způsobem podílejí buď na efektivitě, nebo na bezpečnosti farmakoterapie. Naše výsledky potvrdily, že existuje statisticky významná asociace mezi nežádoucím účinkem léčby azathioprinem, jakým je leukopenie a mezi polymorfismy v genu pro TPMT. Vážná leukopenie se signifikantně častěji (P < 0,01) vyskytovala u pacientů nesoucích některou nestandardní alelu genu pro TPMT.
Na procesu metabolizace 6-MP se může kromě TPMT podílet také enzym xantinoxidáza, který jej přeměňuje na kyselinu thiomočovou. Tato reakce je však pouze minoritní metabolickou cestou. Majoritní cestou inaktivace účinné látky (6-MP) je právě metylace thiolové skupiny enzymem TPMT. Zajímavé by jistě bylo zjistit, zda některý z polymorfismů v genu pro xantinoxidázu nemůže hrát kompenzační roli při geneticky snížené aktivitě TPMT. Daly by se tím vysvětlit situace, kdy u některých jedinců nedochází k tak výrazným fenotypovým projevům a nežádoucím účinkům terapie azathioprinem, jak by odpovídalo jejich zjištěnému genotypu.
ZÁVĚR
Z našich výsledků vyplývá, že u pacientů s Crohnovou chorobou se statisticky častěji než u zdravé populace vyskytuje substituční mutace (Lys469Glu) v genu ICAM-1 a posunová mutace v genu NOD2/CARD15 (Leu1007fs insC). Oproti pacientům s ulcerózní kolitidou se u nich častěji vyskytuje rovněž substituční mutace Arg702Trp v genu NOD2/CARD15. Deleční mutace CCR5 je v porovnání se souborem zdravé populace zastoupena s menší četností. U pacientů s ulcerózní kolitidou jsme zjistili statisticky významně častější výskyt substituční mutace (Lys469Glu) v genu ICAM-1 oproti zdravým dobrovolníkům. Všechny tři sledované mutace v genu NOD2/CARD15 jsou statisticky častější u pacientů s diagnózou CD oproti pacientům s UC. Rozdíl v počtu mutací v tomto genu je u CD pacientů oproti zdravé populaci dokonce statisticky vysoce významný.
Pokud porovnáme výskyt nestandardních alel ve všech sledovaných genech, pacienti s CD jich mají ve svém genotypu signifikantně nejvíce. Zdá se tedy, že Crohnova choroba je více geneticky podmíněna než ulcerózní kolitida.
Vážná leukopenie se jako nežádoucí účinek léčby azathioprinem vysoce signifikantně častěji (P < 0,01) vyskytovala u pacientů, kteří měli v genotypu některou ze čtyř nestandardních alel v genu pro enzym TPMT.
Za zprostředkování vzorků krve pacientů a za spolupráci při získávání klinických děkujeme lékařům prof. MUDr. P. Dítěti a doc. MUDr. V. Zbořilovi z GAEK FN Brno, prof. MUDr. Marianu Bátovskému z III. interní kliniky FNsP akademika Ladislava Dérera v Bratislavě a MUDr. Marianu Kaščákovi z gastroenterologické kliniky v Trenčíně.
Experimentální část předložené práce vznikla na Ústavu humánní farmakologie a toxikologie, Farmaceutické fakulty VFU Brno.
Tato práce byla podpořena finančními prostředky grantového projektu IGA MZd č. NR93423/ 2007.
Použité zkratky
CD - Crohnova choroba (Crohn disease)
DNA - deoxyribonukleová kyselina
IBD - nespecifické střevní záněty (inflammatory bowel disease)
MTHFR - methylen-tetrahydrofolát-reduktáza
NF-κ - jaderný faktor kappa B
PCR - polymerázová řetězová reakce
PCR-REA - polymerázová řetězová reakce doplněná resktrikčním štěpením
Real-time PCR - kvantitativní polymerázová řetězová reakce (PCR v reálném čase)
SNP - jednoduchý nukleotidový polymorfismus (single nucleotide polymorphism)
TPMT - thiopurin- S- methyl- transferáza
UC - ulcerózní kolitida (colitis)
6-MP - 6-merkaptopurin
LITERATURA
- 1. Ogura Y, Bonen DK, Inohara N, et al. A frameshift mutation in Nod2 associated with susceptibility to Crohn‘s disease. Nature 2001; 411: 603-606.
- 2. Hugot JP, Laurent-Pulg P, Gower-Rousseau C, Olson, JM, Lee JC, Beaugerie L, et al. Mapping of susceptibility locus for Crohn’s disease on chromosome 16. Nature 1996; 379: 821-823.
- 3. Hugot JP, Chamaillard M, Zouali H, Lesage S, Cezard JP, Belaiche J, et al. Association of NOD2 leucine-rich repeat variants with susceptibility to Crohn’s disease. Nature 2001; 411: 599-603.
- 4. Aldhous MC, Nimmo ER, Satsangi J. NOD2/CARD15 and the Paneth cell: another piece in the genetic jigsaw of inflammatory bowel disease. Gut 2003; 52: 1533-1535
- 5. Peeters H, Vander Cruyssen B, et al. Radiological sarcoiliitis, a hallmark of spondylitis, is linked with CARD15 gene polymorphisms in patients with Crohn’s disease. Ann Rheum Dis 2004; 63: 1131- 1134.
- 6. Mathew ChG, Lewis CM. Genetics of inflammatory bowel disease: progress and prospects. Human Molecular Genetics 2004; 13: 161-168.
- 7. Wehkamp J, Harder J, Weichenthal M, et al. NOD2 (CARD15) mutations in Crohn‘s disease are associated with diminished mucosal [alpha]-defensin expression. Gut 2004; 53: 1658-1664.
- 8. Hubbard AK, Rothlein R. Intercellular Adhesion Molecule-1 (ICAM-1) expression and cell signalling cascades. Free radical biology and medicine 2000; 28: 1379-1386.
- 9. Papa A, Pola R, Flex A, Danese S, Armuzzi A, et al. Prevalence of the K469E polymorphism of intercellular adhesion molecule 1 gene in Italian patients with inflammatory bowel disease. Dig Liver Dis 2004; 36: 528-532.
- 10. Nejentsev S, Laine AP, Simell O, Ilonen J. Intercellular adhesion molecule-1 (ICAM-1) K469E polymorphism: no association with type 1 diabetes among Finns Tissue Antigens. 2000; 55: 568-570.
- 11. Mycko MP, Kwinkowski M, Tronczynska E, et al. Multiple sclerosis, the increased frequency of the ICAM-1 exon 6 gene point mutation genetic type K469. Ann Neurol 1998; 44: 70-75.
- 12. Verity DH, Vaughan RW, Kondeatis E, et al. Inter- cellular adhesion molecule 1 gene polymorphisms in Behcet’s disease. Eur J Immunogenet 2000; 27: 73-76.
- 13. Ho P, Bruce IN, Silman A, Symmons D, Newman B, Young H, Griffiths CE, John S, Worthington J, Barton A. Evidence for common genetic control in pathways of inflammation for Crohn’s disease and psoriatic arthritis. Arthritis Rheum 2005; 52: 3596- 3602.
- 14. Matsuzawa J, Sugimura K, Matsuda Y, Takazoe M, Ishizuka K, et al. Association between K469E allele of intercellular adhesion molecule 1 gene and inflammatory bowel disease in a Japanese population. Gut 2003; 52: 75-78.
- 15. Algood H, Flynn J. CCR5-deficient mice control Mycobacterium tuberculosis infection despite increased pulmonary lymphocytic infiltration. J Immunol 2004; 173: 3287-3296.
- 16. Katchar K, Eklund A, Grunewald J. Expression of Th1 markers by lung accumulated T cells in pulmonary sarcoidosis. J Intern Med 2003; 254: 564-571.
- 17. Prahalad S, Bohnsack JF, Jorde LB, et al. Association of two functional polymorphisms in the CCR5 gene with juvenile rheumatoid arthritis. Genes and immunity 2006; 7: 468-475.
- 18. Garlet G, Martins W, Ferreira B, et al. Patterns of chemokines and chemokine receptors expression in different forms of human periodontal disease. J Periodontal Res 2003; 38: 210-217.
- 19. Yates CR, Krynetski EY, Loennechen T, Fessing MY, Tai HL et al. Molecular diagnosis of thiopurine S-methyltransferase deficiency: genetic basis for azathioprine and mercaptopurine intolerance. Ann Intern Med. 1997; 126: 608-614.
- 20. Relling MV, Hancoc ML, Rivera GK, Sandlund JT, Ribeir RC, Krynetski EY et al. Mercaptopurine Therapy Intolerance and Heterozygosityat the Thiopurine S-Methyltransferase Gene Locus. Journal of the National Cancer Institute 1999; 91: 2001-2008.
- 21. Hosek J, Bartosova L, Gregor P, Kolorz M, Dite P, Batovsky M, Bartos M. Frequency of representative single nucleotide polymorphisms associated with inflammatory bowel disease in the Czech Republic and Slovak Republic. Folia Biologica (Praha) 2008; 54: 88-96.
- 22. Annese V, Latiano A, Palmieri O, Lombardi G, Andriulli A. NOD2/CARD15 in healthy relatives of IBD patients. European Review for Medical and Pharmacological Sciences 2006; 10: 33-36.
- 23. Podolsky DK. Inflammatory bowel disease. N Engl J Med 2002; 347: 417-429.
- 24. Hradsky O, Lenicek M, Dusatkova P, Bronsky F, Nevoral J, et al. Variants of CARD15, TNFA and PTPN22 and susceptibility to Crohn’s disease in the Czech population: high frequency of the CARD15 1007fs. Tissue Antigens 2008; 6: 538-547.
- 25. Brant SR, Picco MF, Achkar JP, et al. Defining complex contributions of NOD2/CARD15 gene mutations, age at onset and tobacco use on Crohn’s disease phenotypes. Inflamm bowel dis 2003; 9: 281-289.
- 26. Bonen DK, Cho JH. The genetics of inflammatory bowel disease. Gastroenterology 2003; 124: 521-536.
- 27. Herfarth H, Pollok-Kopp B, Goke M, Press A, Oppermann M. Polymorphism of CC chemokine receptors CCR2 and CCR5 in Crohn’s disease. Immunology Letters 2001; 77: 113-117.
- 28. Karban A, Dagan E, Eliakim R, et al. Prevalence and significance of mutations in the familial Mediterranean fever gene in patients with Crohn‘s disease. Genes and Immunity 2005; 6: 134-139.
- 29. Leshinsky-Silver E, Karban A, Buzhakor E, Fridlander M. Is age of onset of Crohn‘s disease governed by mutations in NOD2/caspase recruitment domains 15 and Toll-like receptor 4? Evaluation of a pediatric cohort. Pediatr Res 2005; 58: 499-504.
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené