Postižení gastrointestinálního traktu u nemocných s běžnou variabilní imunodeficiencí
Pavlína Králíčková1, Štěpán Šembera Orcid.org 2, Kateřina Kamarádová3,4, Ilja Tachecí2
+ Pracoviště
Souhrn
Běžná variabilní imunodeficience (CVID) reprezentuje skupinu vrozených protilátkových poruch imunity. Nemocní mohou trpět recidivujícími bakteriálními infekcemi, autoimunitně/ dysregulačními komplikacemi a bývají zvýšeně vnímaví ke vzniku nádorových onemocnění (lymfom, adenokarcinom žaludku). Mezi nejčastější patogeny v zažívacím traktu patří Helicobacter pylori, Campylobacter jejuni, Giardia lamblia, v závažnějších případech norovirus či cytomegalovirus (CMV) působící závažné průjmy. Velmi častý je syndrom bakteriálního přerůstání. CVID provází změny mikrobiomu, které nepřímo ovlivňují komplikace ve vzdálených orgánech (plíce, játra). Neinfekčními komplikacemi může být postižena celá délka zažívacího traktu. Mezi významné patří intestinální metaplazie žaludeční sliznice s rizikem vzniku karcinomu, enteropatie imitující celiakii, kolitida příbuzná nespecifickým střevním zánětům, jaterní portosinusoidální vaskulární porucha (nodulární regenerativní hyperplazie či necirhotická portální hypertenze). Obtíže obvykle probíhají dlouhodobě nenápadně. V případě zaznamenání klinických známek malnutrice bývá však již přítomna nevratná porucha vstřebávání. Péče o nemocné vyžaduje multidisciplinární přístup se zavedením pravidelných screeningových programů. K přesné diagnostice je klíčové endoskopické vyšetření vč. opakovaných a vícečetných biopsií. Při záchytu hepatopatie je vhodné využití elastografie. Sérologická vyšetření jsou zcela nepřínosná. Léčba bývá obecně svízelná, vždy přísně individualizovaná. Imunoglobulinová substituční léčba snižuje pouze frekvenci infekcí, v případě neinfekčních komplikací je nezbytná imunomodulační léčba, v ideálním případě cílená dle genetického pozadí.
Klíčová slova
imunodeficience běžná variabilní, endoskopie, onemocnění střev, syndromy malabsorpce, onemocnění jater, mikrobiota, imunomodulace
Úvod
Pod pojmem běžná variabilní imunodeficience (CVID) se skrývá skupina vzácných, vrozených poruch imunity, které jsou především spjaty s poruchou tvorby protilátek. V Českém registru primárních imunodeficiencí bylo na konci roku 2020 nahlášeno více než 330 nemocných s CVID, což odpovídá výskytu 3 : 100 000 obyvatel České republiky [1]. Díky novým možnostem genetické diagnostiky zahrnujícím celoexomové sekvenování můžeme až u 30 % případů najít monogenní příčinu (např. syndrom aktivované PI3K-delta, NFkB1, NFkB2 deficience, mutace v CTLA4, LRBA, deficience CD19, CD20, CD21). Některé genové mutace jsou považovány za jasně kauzální, jiné jako onemocnění modifikující. V dalších případech díky překrývajícím se fenotypovým projevům s jinými klinickými jednotkami může závěr genetického vyšetření přinést poměrně překvapující nálezy (autozomálně recesivní formy agamaglobulinemie, poruchy v signalizaci JAK/ STAT) [2]. Stále však ve většině případů přesná příčina uniká. Diagnóza onemocnění bývá stanovena na základě kombinace klinických a laboratorních dat. Hlavními kritérii jsou: snížení sérových koncentrací imunoglobulinů v třídě IgG a IgA (bez ohledu na výši IgM) spojené se špatnou vakcinační odpovědí a/ nebo snížení počtu izotypově přesmyknutých paměťových B-lymfocytů při současném vyloučení závažnější poruchy T-lymfocytů. Klinicky se ve většině případů vyskytují zvýšená vnímavost k infekcím, autoimunitní komplikace, tvorba granulomů, polyklonální lymfoproliferace. Může být zaznamenán rodinný výskyt. Ke stanovení diagnózy není nezbytná přítomnost všech klinických kritérií současně. Nezbytným krokem je dále vyloučení sekundární příčiny hypogamaglobulinemie.
Ke klinické manifestaci onemocnění může dojít kdykoli během života, nejčastěji však v 2.– 4. dekádě. I když mohou první projevy onemocnění nastat dříve, definitivní závěr učiníme až po čtvrtém roku věku [3]. Pokud onemocnění vzniká v dětském věku, mívá závažnější průběh [4]. Pro CVID jsou typické recidivující bakteriální infekce, autoimunitně/ dysregulační komplikace a zvýšená frekvence nádorových onemocnění. Slovo „variabilní“ v názvu onemocnění vychází z velmi vysoké interindividuální fenotypové různorodosti, co do typu i závažnosti jednotlivých komplikací. Přibližně dvě třetiny pacientů vyhledají primárně lékaře pro opakující se infekce, nejčastěji dýchacích cest (sinusitidy, bronchitidy, pneumonie) způsobené převážně Streptococcus pneumoniae, Haemophilus influenzae či Moraxella catarrhalis [5]. V průběhu trvání onemocnění se u dvou třetin postupně vyvíjejí tzv. komplikace neinfekční, které mohou být i vícečetné, dané dysregulačními změnami imunitního systému. Poměrně častý je výskyt idiopatické trombocytopenické purpury či autoimunitní hemolytické anemie, které mohou i mnoho let předcházet poklesu tvorby protilátek. Z klasických autoimunitních komplikací se setkáváme např. s vitiligem, perniciózní anemií, psoriázou, tyreopatiemi, diabetem 1. typu, artritidami či systémovým lupus erythematodes. Typické jsou polyklonální lymfoproliferativní změny ať již ve formě infiltrátů, či nekaseifikujících granulomů vedoucích k lymfadenopatii, hepatosplenomegalii či postižení dalších orgánů (plic, gastrointestinálního traktu – GIT) [6]. Výskyt nádorových komplikací je 6krát vyšší než v běžné populaci. Nejčastěji se jedná o lymfomy či adenokarcinom žaludku. Vznikají obvykle v mladším věku, než je populační průměr [7].
Postižení GIT může probíhat dlouhodobě klinicky zcela asymptomaticky. Mezi nejčastější stesky nemocných s CVID patří nadýmání, průjmy a bolesti břicha. V pozdních fázích pak známky malnutrice [8].
CVID a infekce GIT
Chronické postižení GIT u nemocných s CVID představuje závažný negativní prognostický faktor z hlediska morbidity i mortality, neboť vede v řadě případů k malabsorpci s následnou malnutricí se všemi závažnými konsekvencemi nebo selhání jater [9]. Postihuje přibližně 20 % nemocných [8]. Zcela obecně můžeme rozlišit infekční a neinfekční postižení GIT. Infekce mohou být akutní, často s protrahovaným průběhem, či mají povahu chronickou. Typickými patogeny jsou: Giardia lamblia (obr. 1), Campylobacter jejuni či Salmonella spp. Z virových původců se jedná o norovirus či cytomegalovirus, což obvykle svědčí o celkově závažném klinickém stavu nemocného [10]. Norovirové infekce mohou vést ke vzniku chronické enteropatie s atrofií klků a k následné malabsorpci kvůli zesílené produkci IFNy s následným rizikem poškození okolních tkání [11]. Na možnost cytomegalovirových enteritid či dalších oportunních infekcí bychom měli pomýšlet zejména u nemocných se závažnými neinfekčními komplikacemi s anamnézou dlouhodobé imunosupresivní léčby či malnutrice [12]. Infekce Helicobacterem pylori může u nemocných s CVID podporovat vznik chronické gastritidy, atrofii sliznice, intestinální metaplazie, dysplazie či adenokarcinomu žaludku, a proto by měla být aktivně vyhledávána a následně důsledně eradikována [13].
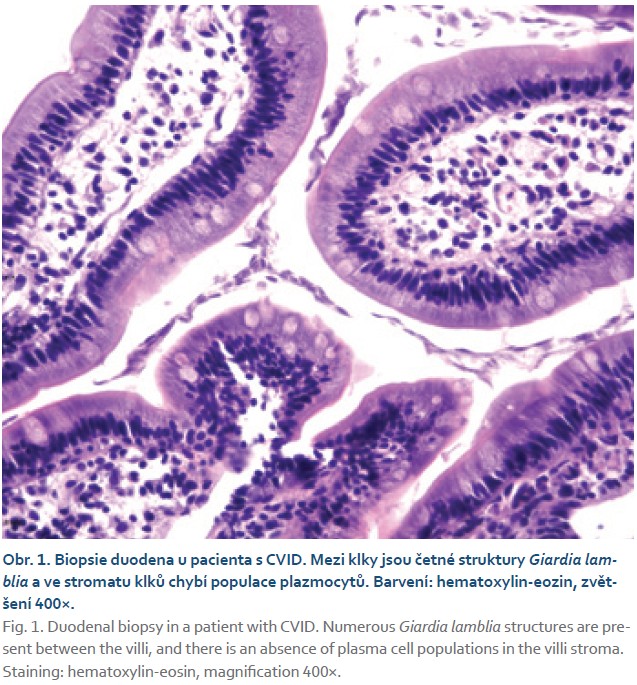
CVID a syndrom bakteriálního přerůstání v tenkém střevě (SIBO)
Chronické obtíže nemocných, zejména nadýmání, průjmy a bolesti břicha, bývají poměrně často spojeny se SIBO [14]. Jasná etiopatogeneze není známa, předpokládá se podíl nízké koncentrace slizničního IgA a s ní spojených změn mikrobiomu. Klinické zkušenosti ukazují i na důsledky opakované antibiotické léčby pro infekce respiračního traktu či dlouhodobé podávání blokátorů protonové pumpy v rámci systémové kortikoterapie např. pro neinfekční postižení plicního parenchymu, charakteru granulomatózně-lymfocytární infiltrativní plicní nemoci.
Bakteriální přerůstání negativně ovlivňuje vstřebávání bílkovin, tuků i cukrů, vitaminů a dalších mikronutrientů. Spolupodílí se např. i na deficienci vitaminu B12 kvůli spotřebování cobalaminu anaeroby. Na střevní sliznici dochází dále ke kompetici vitaminu B12 s produkty bakterií. V závažnějších případech je střevní sliznice poškozována přímo toxickými metabolity žlučových kyselin, hydroxylovanými mastnými kyselinami a dalšími organickými kyselinami v důsledku porušení střevní bariéry. Dekonjugace žlučových kyselin střevními bakteriemi může zapříčinit malabsorpci tuků a vitaminů rozpustných v tucích vedoucí následně ke steatoree a projevům vitaminových deficiencí [15].
CVID a střevní mikrobiom
O vzájemném ovlivňování mikrobiomu a imunitního systému není pochyb. Tvorba mikrobiomu je dynamický celoživotní proces, který začíná již před narozením. Zejména v prvních letech života dochází k největším změnám. Jedním z důležitých faktorů ovlivňujícím osídlení GIT je přítomnost slizničního IgA, který je u nemocných s CVID významně snížen až prakticky nepřítomen. V korelaci se závažností deficitu IgA je snížena nejen alfa-diverzita střevní mikrobioty, ale také její beta-diverzita. Jørgensen et al. popsali zvýšení podílu Firmicutes z třídy Clostridia (Lachnospiraceae Dorea a Lachnospiraceae Roseburia rodiny), Bacilli a některých Proteobacteria ze třídy Gammaproteobacteria. Jiné Firmicutes z třídy Clostridia (rodiny Christensenellaceae a Lachnospiraceae Blautia), Actinobacteria (rod Bifidobacteriaceae) a další Proteobacteria ze třídy Deltaproteobacteria (Desulfovibrionales) byly naopak redukovány. Obecně lze shrnout, že kombinace snížení prospěšných tax z rodu Bifidobacteriaceae, a naopak zvýšení škodlivých tříd Bacilli a Gammaproteobacteria, podtrhuje propojení mezi CVID, alterací střevní mikrobioty a systémového zánětu v důsledku poruchy střevní bariéry se zvýšenou mikrobiální translokací. Důkazem toho jsou nálezy zvýšených plazmatických hladin lipopolysacharidů či solubilních forem CD14 a CD25 [16]. Výše popsané změny se tak mohou podílet na vzniku dalších vzdálených neinfekčních komplikacích, jako je např. postižení plicního parenchymu či jater. Na patogenezi neinfekčních komplikací se mikrobiota podílí i nepřímo přes indukci epigenetických změn. V bioptických vzorcích nemocných s vyšším podílem intraepiteliálních lymfocytů byla popsána rozdílná metylace DNA v porovnání se zdravými kontrolami i nemocnými trpícími celiakií. Nález byl spojen s rozdílnou regulací genů ovlivňujících sekreci TNF, dalších cytokinů i aktivací makrofágů [17]. Současně u nemocných s CVID trpících neinfekčními komplikacemi na rozdíl od nemocných s fenotypem charakterizovaným pouze infekcemi byly v souvislosti s vyšším indexem dysbiózy zaznamenány změny v lipidovém profilu. I přes normální hodnoty celkového cholesterolu a LDL byl popsán pokles HDL a a-lipoproteinu A se současným zvýšením VLDL a TAG. Tyto změny dále pozitivně korelovaly s hodnotou CRP, IL-6, IL-12 a LPS reflektující systémový zánět. Zajímavým faktem je, že však tyto změny nebyly spojeny se změnou stravovacích návyků či hodnotou body mass index (BMI). Zdají se být na nich zcela nezávislé [18].
CVID a neinfekční komplikace GIT
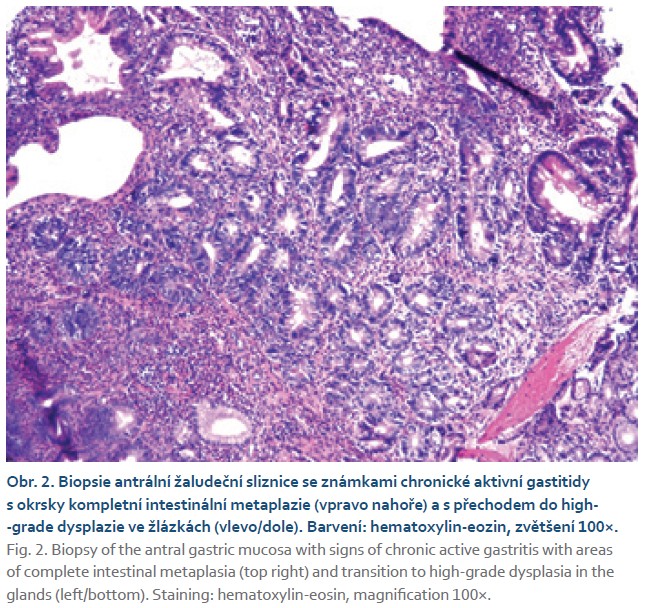
Neinfekční komplikace GIT mohou postihnout kteroukoli část zažívacího traktu. Častou komplikací bývá perniciózní anemie. Obvykle se manifestuje v mladším věku a může předcházet diagnóze základního onemocnění o řadu let. Při gastroskopickém vyšetření bývá u nemocných s CVID nacházena hypo- či achlorhydrie, atrofická gastritida a intestinální metaplazie (obr. 2) představující potenciální riziko vzniku adenokarcinomu. Adenokarcinom žaludku u nemocných s CVID je 6krát častější v porovnání s běžnou českou populací. Vzniká v mladším věku, obvykle před 60. rokem věku. Histologicky se jedná nejčastěji o intestinální typ se zvýšeným množstvím intratumorózních lymfocytů [7].
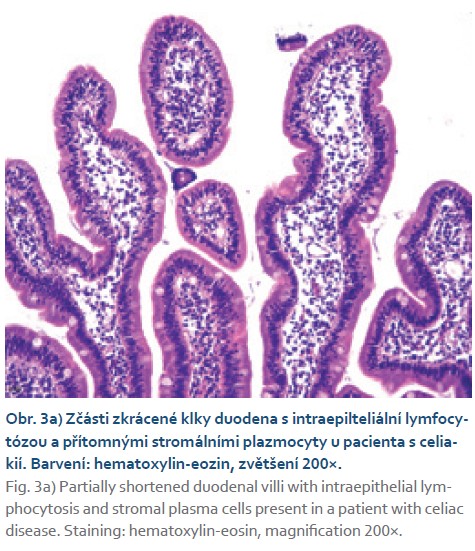
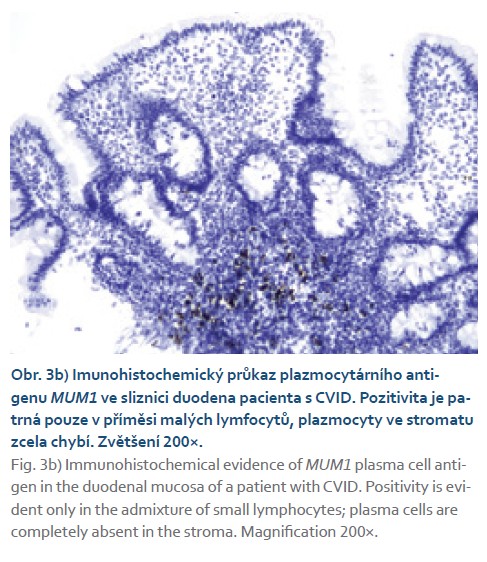
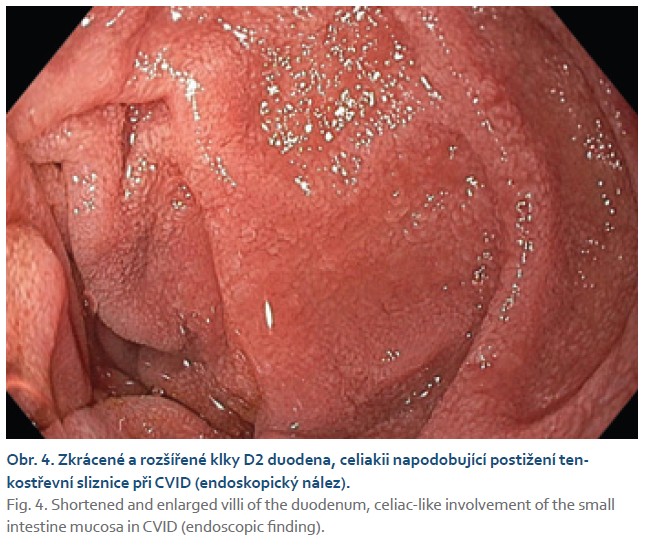
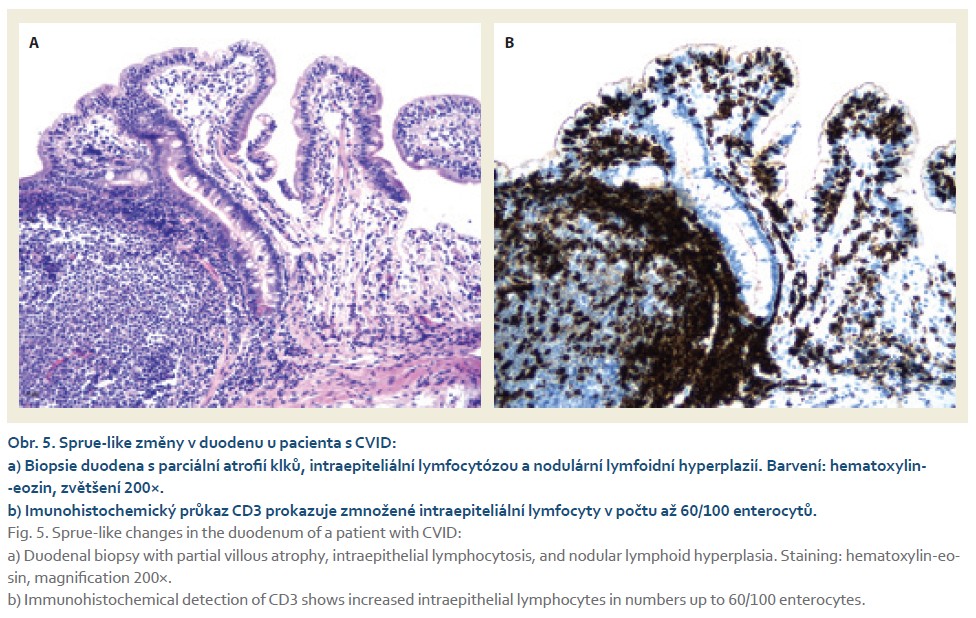
Postižení tenkého střeva (CVID asociovaná enteropatie) zahrnuje folikulární hyperplazii (obr. 3a), zmnožení intraepiteliálních lymfocytů a atrofii klků často vedoucí k mylné diagnóze celiakie (obr. 4, 5a, b). Někdy bývá označována jako „celiakia-like“. Při histologickém vyšetření nacházíme významné snížení až chybění plazmatických buněk (obr. 3b) a infiltraci slizničního epitelu zvýšeným počtem CD3/ CD8+ T-lymfocytů [19]. Koincidence s pravou celiakií bývá vzácná. Vzájemné odlišení může činit obtíže. Použití sérologických testů není přínosné pro primární poruchu tvorby protilátek, tedy i autoprotilátek. Navíc imunoglobulinová substituční léčba může naopak vést k falešně pozitivnímu nálezu protilátek pro riziko pasivního přenosu protilátek dárcovských. Nápomocná může být HLA typizace DQ2, DQ8 s vysokou negativní prediktivní hodnotou vzhledem k celiakii, je však nutno zohlednit výskyt HLA-DQ2 u 24 % a HLA-DQ8 u 15 % zdravé české populace [20]. K definitivnímu odlišení v indikovaných případech lze použít diagnosticko-terapeutický test s bezlepkovou dietou, která je u CVID-enteritidy zcela neefektivní [21]. Klinický stav nemocného po zavedení bezlepkové diety by měl být pečlivě monitorován. Při neefektivitě je nezbytné dietu ihned ukončit pro riziko zhoršení nutričního stavu nemocného, nehledě k ekonomickým konsekvencím.
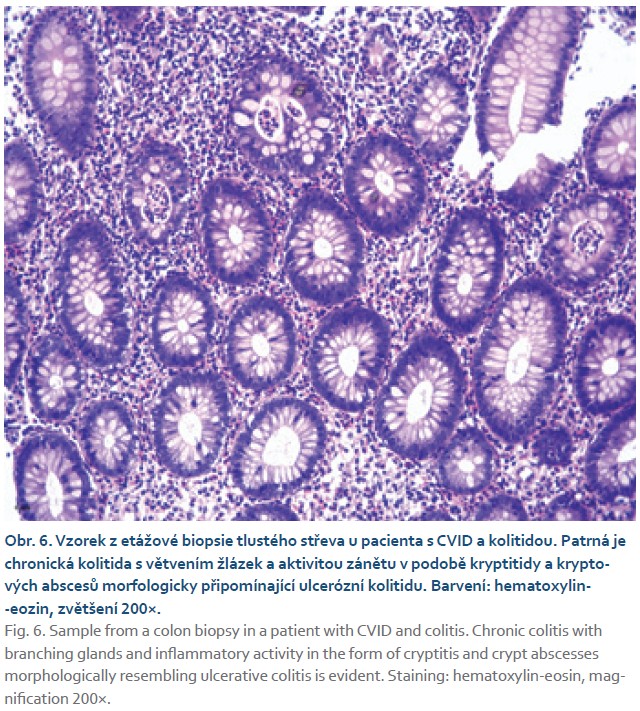
Postižení tračníku může být histopatologem popsáno jako mikroskopická či kolagenní kolitida či ulcerativní zánět blízký nespecifických střevním zánětům (IBD) (obr. 6). V jiných případech může obraz připomínat GVH (graft versus host) léze. Raritní není ani přítomnost nekaseifikujících granulomů či folikulární lymfoidní hyperplazie, které nemívají po dlouhou dobu žádných klinických konsekvencí [22].
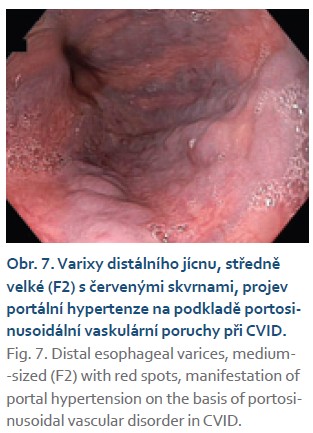
Specifickou skupinu nemocných s vážnou prognózou představují nemocní s jaterním postižením. Nejčastěji jsou játra postižena nodulární regenerativní hyperplazií (NRL), která je doprovázena portální hypertenzí, splenomegalií (typicky > 16 cm) a hypersplenizmem s trombocytopenií. Podstatně méně často jsou pozorována postižení s autoimunitními rysy (značná elevace transamináz, interface hepatitida, event. přemosťující nekrózy), postižení s granulomy nebo lymfocytární infiltrace [23,24]. NRL, která je asociována i s jinými komorbiditami (prokoagulační stavy, autoimunitní onemocnění, cystická fibróza, časté gastrointestinální infekce, užívání azathioprinu a další), se nejčastěji vysvětluje teorií o tvorbě trombů v drobných větvích portální žíly. Uzávěr přítoku portální krve k některým částem jaterního parenchymu vede k atrofii drobného okrsku tkáně a zároveň ke kompenzatorní hypertrofii okolních částí se zachovaným přítokem portální krve. To vede ke vzniku nodulovaného vzhledu jaterního parenchymu, který může být pozorovatelný i na zobrazovacích vyšetření. Postupné uzavírání portálního řečiště vede k portální hypertenzi, jedná se o intrahepatální, avšak presinusoidální typ portální hypertenze. Nodulace parenchymu jater je jednou z pozorovatelných histopatologických změn, další mohou být patrné v portálních trias. Jako obliterativní portální venopatie se označují změny, u nichž dochází k zesílení cévní stěny porty, přítomnosti trombu v portální žíle nebo k úplnému chybění portální žíly v portálním trias. Zastřešujícím názvem pro všechny tyto změny je portosinusoidální vaskulární porucha (PSVD), dříve označovaná jako idiopatická necirhotická portální hypertenze (INCPH). Tito nemocní mohou mít typické projevy portální hypertenze (varixy, ascites) a v kombinaci s nodulovaným parenchymem jater je lze snadno zaměnit za nemocné s jaterní cirhózou (obr. 7). Tento stav lze však jednoduše vyloučit, mnoho napoví již jaterní elastografie (neinvazivní měření tuhosti jater založené na principu ultrazvuku), při níž tito nemocní mívají jen mírně zvýšené hodnoty, které vylučují možnost pokročilé jaterní cirhózy s portální hypertenzí. Typické jsou hodnoty mezi 6,5 a 20 kPa. Pro diagnózu stavu je však mandatorní jaterní biopsie, která má za úkol vyloučit jaterní cirhózu, při zjevných známkách portální hypertenze toto pro diagnózu stačí. V preparátu mohou být popsány i typické histopatologické změny PSVD, které jsou ovšem často jen obtížně patrné [25– 27].
Diagnostika
Každému nově diagnostikovanému nemocnému s CVID by měla být doporučena gastroskopie. Frekvence následných kontrol je závislá na histologickém nálezu a klinických symptomech. Jednou ročně je indikován ultrazvuk břicha k vyloučení hepatosplenomegalie a lymfadenopatie. Při nálezu velikosti sleziny > 16 cm je vhodné pomýšlet na možný rozvoj portální hypertenze a doplnit event. i jaterní elastografii a další potřebná vyšetření [25]. Při pravidelných kontrolách v ambulanci by měl být vždy zhodnocen stav nutrice a cíleně pátráno po hmotnostním úbytku. Laboratorně je vhodné sledovat sérové koncentrace železa, feritinu, vitaminu B12 a kyseliny listové, v indikovaných případech i vitaminů rozpustných v tucích. Důraz je kladen na včasný záchyt a následnou eradikaci Helicobacter pylori. Kromě průkazu v rámci endoskopického vyšetření lze využít neinvazivní stanovení antigenu ve stolici či dechový test. Ke zvážení je v indikovaných případech rozšířit vyšetření o stanovení kalprotektinu k vyloučení probíhajícího zánětu. Některá pracoviště mají možnost vyšetřit i alfa1-antitrypsin ve stolici za účelem neinvazivní monitorace zánětu a malabsorpce. V průběhu endoskopického vyšetření je doporučeno provádět vícečetné biopsie, a to i při opticky normálním nálezu na sliznicích. Vhodnou součástí je i vyloučení přítomnosti Giardia lamblia. V komplikovanějších případech je s výhodou využití kapslové endoskopie.
Ošetřující lékař by neměl podceňovat zažívací obtíže nemocného a důsledně pátrat po příčinách. Při výskytu břišního diskomfortu či průjmů by měla být primárně vyloučena infekční příčina obtíží, nejen bakteriálních, ale také parazitárních a virových. Lze využít metodiky kultivační či PCR. Sérologická diagnostika není přínosná. Dechového testu lze využít při podezření na SIBO. Vhodné je doplnění kalprotektinu ve stolici. V nejasných případech či případech neodpovídajících standardně na léčbu následuje vyšetření endoskopické. V současné době však neexistují jednotná doporučení odborných společností, a praxe na jednotlivých pracovištích se tak mohou lišit.
Léčba
Péče o nemocné s CVID vyžaduje úzkou mezioborovou spolupráci. I když správně vedená substituční léčba imunoglobuliny nezabrání vzniku ani progresi postižení GIT, ošetřující imunolog by měl vyvinout maximální snahu o její optimalizaci k zabránění infekčních komplikací [28]. Při prokázaných ztrátách bílkovin do GIT je vhodné upřednostnit podkožní cestu podání protilátek před intravenózní.
Všechny infekce by měly být aktivně léčeny a následně má být verifikována léčebná odpověď z důvodu vyššího rizika rezistencí u jedinců opakovaně předléčených antibiotickými kúrami z různých důvodů. Zdá se, že cílená léčba ribavirinem v případě závažné norovirové infekce je schopna zlepšit nejen klinický stav nemocného, ale i histopatologický obraz s regenerací struktury sliznice [11]. Jasná doporučení k léčbě pozitivních kultivačních nálezů ze stolice (Giardia, Campylobacter, Salmonela) u zcela asymp- tomatických jedinců nejsou stanovena. V případě nálezu Helicobacter pylori je eradikace vždy namístě z hlediska vysokého rizika vzniku karcinomu žaludku.
Při prvních známkách porušeného vstřebávání nemocní profitují z včasné spolupráce s metabolickou poradnou za účelem zavést vhodná dietní opatření, sipping či v závažnějších případech enterální výživu. Důležité je nepodceňovat syndrom bakteriálního přerůstání, zlepšuje se kvalita života nemocných, stav nutrice a snižuje se riziko poškození střevního epitelu [29]. V refrakterních případech lze zvážit možnost fekální transplantace. Doposud byl publikován jediný případ úspěšně provedené fekální transplantace u 59letého nemocného s CVID a se současnou anamnézou splenektomie pro trombocytopenii v mládí. Pacient byl přijat pro průjem s více než 10 stolicemi denně, s malnutricí se známkami kachexie. Pozitivní nález CMV ve stolici byl řádně přeléčen valganciclovirem, následně však došlo k manifestaci infekce způsobené Clostridium difficile. Transplantace byla provedena za pomoci certifikovaného preparátu zcela bez komplikací. Obtíže nemocného odezněly a i za 2 roky byl jeho stav dobrý, bez recidivy [30].
V léčbě neinfekčních komplikací neexistuje jednotný doporučený postup. Není jasně definováno, jakého nemocného, a zejména ve kterém okamžiku začít aktivně léčit. Včas zahájená imunomodulační léčba zlepšuje prognózu nemocných s oddálením závažné malnutrice, event. jaterního selhání. Díky řádně probíhající substituční léčbě imunoglobuliny je potenciální riziko infekcí akceptovatelné s přihlédnutím k individuálním charakteristikám nemocného. V první linii bývají užívány topické či celkové kortikosteroidy [23,31]. V druhé linii je přistupováno k cílené terapii, v ideálním případě na podkladě genetického vyšetření. Možnosti cílené terapie u nemocných s monogenními formami CVID a fenotypově příbuzných jednotek ukazuje tab. 1. U stavů označovaných IBD-like se léčba obvykle neliší od managementu nespecifických střevních zánětů (budesonid 3– 9 mg/ den, nízkodávkovaný prednison ≤ 10 mg/ den, anti-TNF léčba ve formě infliximabu 5 mg/ kg à 6 týdnů či adalimumab 40 mg à 2 týdny) [32]. V paletě individuálně použitých léků při managementu enteropatií či hepatopatií nechybí: azathioprin, mykofenolát mofetil, tacrolimus, rapamycin, rituximab, abatacept, vedolizumab, ustekinumab, guselkumab, tofacitinib, baricitinib či cyklofosfamid [23,32,33]. U nemocných se známkami hepatopatie (elevace jaterních enzymů, splenomegalie, trombocytopenie) by měla být provedena gastroskopie k vyloučení varixů, v případě jejich přítomnosti je indikována léčba neselektivním betablokátorem carvediolem, při jeho špatné toleranci, kontraindikaci či po dohodě s nemocným je možnou alternativou endoskopická ligace varixů. Závažné komplikace portální hypertenze (selhání léčby variceálního krvácení, recidivující variceální krvácení, refrakterní či rekurentní ascites) lze léčit zavedením transjugulární intrahepatické portosystomové spojky (TIPS), tak jako u nemocných s portální hypertenzí při jaterní cirhóze. Je však potřeba upozornit na to, že u těchto nemocných byl pozorován vyšší výskyt úmrtí na sepse (46 % z 13 nemocných v jedné sérii) v období až 5 let po zavedení TIPS. Jsou reportovány zprávy o provedení jaterní transplantace. Mortalita spojená s výkonem je však vyšší v porovnání s transplantacemi jater z jiných příčin. Azzu et al. popisují 3leté přežití 55 % u nemocných s CVID v porovnání s 89 % s transplantací jater z jiných příčin [34]. U nemocných s autoimunitními rysy postižení jater (výrazná elevace transamináz, interface hepatitida, přemosťující nekrózy či fibróza) se používá léčba obdobná jako u nemocných s autoimunitní hepatitidou (kortikosteroidy, azathioprin).

V poslední době je živě diskutována možnost alogenní transplantace dospělých s komplikovaným průběhem CVID. Z hlediska variabilní povahy průběhu onemocnění je co do počtu i rychlosti progrese onemocnění její načasování velmi obtížné. Prognóza transplantovaných adolescentů a dospělých s vrozenými poruchami imunity obecně je významně horší než při provedení transplantace v dětském věku, i když díky novým možnostem dochází k signifikantnímu zlepšení přežití [35– 37]. Multicentrická studie publikovaná v časopise Blood v roce 2022 shrnuje údaje za období mezi roky 2000 a 2019. Do studie bylo zahrnuto 329 adolescentů či dospělých léčených pro vrozené poruchy imunity, overal survival (OS) činil po 1 roce od transplantace 78 % a po 5 letech 71 %. Intenzita akutní i chronické extenzivní GVHD byla 8, resp. 7 %. Negativní vliv na přežití měla přítomnost bronchiektazií, jaterního postižení či stavy po splenektomii. Vliv věku nebyl jednoznačně prokázán [37]. Fox et al. ukazují na důležitost výpočtu pretransplantačního imunitního dysregulačního indexu (IDDA v2.1), který lépe kopíruje rizikovost než tradičně užívaný index HCT-CI skóre (index transplantačních komorbidit) [38]. Výsledky pacientů s CVID a blízkých jednotek nejsou konzistentní, nicméně vykazují významně horší prognózu ve srovnání s ostatními vrozenými poruchami imunity, pravděpodobně právě pro charakter multiorgánového postižení [36,38,39].
Závěr
Postižení gastrointestinální traktu u nemocných s CVID je velmi pestré a vyžaduje multidisciplinární přístup zkušených odborníků. Důsledně prováděné screeningové programy a včas zahájená intervence zlepšují nejen kvalitu života nemocných, ale významně prodlužují i jejich délku přežití.
ORCID autorů
P. Králíčková 0000-0001-6402-3816,
Š. Šembera 0000-0003-0151-9982,
K Kamarádová 0000-0001-8128-2326,
I. Tachecí 0000-0003-3583-2651.
Doručeno/ Submitted: 9. 7. 2025
Přijato/ Accepted: 28. 7. 2025
Korespondenční autorka
doc. MU Dr. Pavlína Králíčková, Ph.D.
Ústav klinické imunologie a alergologie
LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
pavlina.kralickova@fnhk.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Chovancová Z, Hlaváčková E, Milota T et al. Substituční imunoglobulinová léčba v České republice: data z Národního registru primárních imunodeficiencí ke konci roku 2020. Alergie 2022; 24(1): 13– 21.
2. Cunningham-Rundles C, Casanova JL, Boisson B. Genetics and clinical phenotypes in common variable immunodeficiency. Front Genet 2024; 14: 1272912. doi: 10.3389/ fgene.2023.1272912.
3. Seidel MG, Kindle G, Gathmann B et al. The European Society for Immunodeficiencies (ESID) registry working definitions for the clinical diagnosis of inborn errors of immunity. J Allergy Clin Immunol Pract 2019; 7(6): 1763– 1770. doi: 10.1016/ j. jaip.2019.02.004.
4. Carrabba M, Salvi M, Baselli LA et al. Long-term follow-up in common variable immunodeficiency: the pediatric-onset and adult-onset landscape. Front Pediatr 2023; 11: 1125994. doi: 10.3389/ fped.2023.1125994.
5. Thalhammer J, Kindle G, Nieters A et al. Initial presenting manifestations in 16,486 patients with inborn errors of immunity include infections and noninfectious manifestations. J Allergy Clin Immunol 2021; 148(5): 1332.e5– 1341.e5. doi: 10.1016/ j. jaci.2021.04.015.
6. Yazdani R, Habibi S, Sharifi L et al. Common variable immunodeficiency: epidemiology, pathogenesis, clinical manifestations, diagnosis, classification, and management. J Investig Allergol Clin Immunol 2020; 30(1): 14– 34. doi: 10.18176/ jiaci.0388.
7. Kralickova P, Milota T, Litzman J et al. CVID-associated tumors: Czech Nationwide Study focused on epidemiology, immunology, and genetic background in a cohort of patients with CVID. Front Immunol 2019; 9: 3135. doi: 10.3389/ fimmu.2018.03135.
8. Bez P, Smits B, Geier C et al. Uncovering risk factors of premature mortality in Common Variable Immunodeficiency (CVID). J Allergy Clin Immunol Pract 2025; 13(5): 1201.e10– 1209.e10. doi: 10.1016/ j. jaip.2025.03.009.
9. Franzblau LE, Fuleihan RL, Cunningham-Rundles C et al. CVID-associated intestinal disorders in the USIDNET registry: an analysis of disease manifestations, functional status, comorbidities, and treatment. J Clin Immunol 2023; 44(1): 32. doi: 10.1007/ s10875-023-01604-6.
10. Sanchez DA, Rotella K, Toribio C et al. Characterization of infectious and non-infectious gastrointestinal disease in common variable immunodeficiency: analysis of 114 patient cohort. Front Immunol 2023; 14: 1209570. doi: 10.3389/ fimmu.2023.12095708.
11. Woodward J, Gkrania-Klotsas E, Kumara- ratne D. Chronic norovirus infection and common variable immunodeficiency. Clin Exp Immunol 2017; 188(3): 363– 370. doi: 10.1111/ cei.12884.
12. Kralickova P, Mala E, Vokurkova D et al. Cytomegalovirus disease in patients with common variable immunodeficiency: three case reports. Int Arch Allergy Immunol 2014; 163(1): 69– 74. doi: 10.1159/ 000355957.
13. Motta-Raymundo A, Rosmaninho P, Santos DF et al. Contribution of helicobacter pylori to the inflammatory complications of common variable immunodeficiency. Front Immunol 2022; 13: 834137. doi: 10.3389/ fimmu.2022.834137.
14. Baniadam L, Arshi S, Nabavi M et al. Can concurrent lower gastrointestinal manifestations help the timely diagnosis of small intestinal bacterial overgrowth in CVID patients? Eur Ann Allergy Clin Immunol 2021; 53(1): 18– 22. doi: 10.23822/ EurAnnACI.1764-1489.137.
15. Varricchi G, Poto R, Ianiro G et al. Gut microbiome and common variable immunodeficiency: few certainties and many outstanding questions. Front Immunol 2021; 12: 712915. doi: 10.3389/ fimmu.2021.712915.
16. Jørgensen SF, Trøseid M, Kummen M et al. Altered gut microbiota profile in common variable immunodeficiency associates with levels of lipopolysaccharide and markers of systemic immune activation. Mucosal Immunol 2016; 9(6): 1455– 1465. doi: 10.1038/ mi.2016.18.
17. Yang M, Kaarbø M, Myhre V et al. Altered genome-wide DNA methylation in the duodenum of common variable immunodeficiency patients. J Clin Immunol 2024; 44(6): 133. doi: 10.1007/ s10875-024-01726-5.
18. Macpherson ME, Skarpengland T, Hov JR et al. Increased plasma levels of triglyceride-enriched lipoproteins associate with systemic inflammation, lipopolysaccharides, and gut dysbiosis in common variable immunodeficiency. J Clin Immunol 2023; 43(6): 1229– 1240. doi: 10.1007/ s10875-023-01475-x.
19. Jørgensen SF, Reims HM, Frydenlund D et al. A cross-sectional study of the prevalence of gastrointestinal symptoms and pathology in patients with common variable immunodeficiency. Am J Gastroenterol 2016; 111(10): 1467– 1475. doi: 10.1038/ ajg.2016.329.
20. Wroblova K, Kolorz M, Pav I et al. Frequencies of HLA-DQ2 and HLA-DQ8 haplotypes in Czech and Slovak coeliac patients and the healthy population. Acta Biochim Pol 2014; 61(1): 191– 193.
21. Andersen IM, Jørgensen SF. Gut inflammation in CVID: causes and consequences. Expert Rev Clin Immunol 2022; 18(1): 31– 45. doi: 10.1080/ 1744666X.2021.2008241.
22. Velthof L, Geldof J, Truyens M et al. Gastrointestinal disease in Common Variable Immunodeficiency Disorder (CVID): histological patterns, diagnostic clues and pitfalls for the pathologist and gastroenterologist. J Clin Med 2025; 14(2): 497. doi: 10.3390/ jcm14020497.
23. Daza-Cajigal V, Segura-Guerrero M, López-Cueto M et al. Clinical manifestations and approach to the management of patients with common variable immunodeficiency and liver disease. Front Immunol 2023; 14: 1197361. doi: 10.3389/ fimmu.2023.1197361.
24. Baumert LS, Shih A, Chung RT. Management of liver disease and portal hypertension in Common Variable Immunodeficiency (CVID). JHEP Rep 2023; 5(11): 100882. doi: 10.1016/ j. jhepr.2023.100882.
25. DiGiacomo DV, Shay JE, Crotty R et al. Liver stiffness by transient elastography correlates with degree of portal hypertension in common variable immunodeficiency patients with nodular regenerative hyperplasia. Front Immunol 2022; 13: 864550. doi: 10.3389/ fimmu.2022.864550.
26. Globig AM, Strohmeier V, Surabattula R et al. Evaluation of laboratory and sonographic parameters for detection of portal hypertension in patients with common variable immunodeficiency. J Clin Immunol 2022; 42(8): 1626– 1637. doi: 10.1007/ s10875-022-01319-0.
27. De Gottardi A, Rautou PE, Schouten J et al. Porto-sinusoidal vascular disease: proposal and description of a novel entity. Lancet Gastroenterol Hepatol 2019; 4(5): 399– 411. doi: 10.1016/ S2468-1253(19)30047-0.
28. Výbor České společnosti alergologie a klinické imunologie. Návrh standardu imunoglobulinové léčby nemocných s protilátkovými imunodeficiencemi. 2016 [online]. Dostupné z: https:/ / www.csaki.cz/ soubory/ stanoviska-a-doporuceni/ 13.-Navrh-standardu-imunoglobulinove-lecby.pdf.
29. Jørgensen SF, Macpherson ME, Bjørnetrø T et al. Rifaximin alters gut microbiota profile, but does not affect systemic inflammation – a randomized controlled trial in common variable immunodeficiency. Sci Rep 2019; 9(1): 167. doi: 10.1038/ s41598-018-35367-7.
30. Napiórkowska-Baran K, Biliński J, Pujanek M et al. Fecal microbiota transplantation in a patient with chronic diarrhea and primary and secondary immunodeficiency (common variable immunodeficiency and splenectomy). Front Cell Infect Microbiol 2024; 14: 1456672. doi: 10.3389/ fcimb.2024.1456672.
31. Sousa eSilva R, Pereira da Silva S, Luís R et al. Nodular regenerative hyperplasia in CVID patients: could low-dose oral glucocorticoids be part of the solution? Eur Ann Allergy Clin Immunol 2023; 55(6): 313– 315. doi: 10.23822/ EurAnnACI.1764-1489.251.
32. Fevang B. Treatment of inflammatory complications in Common Variable Immunodeficiency (CVID): current concepts and future perspectives. Expert Rev Clin Immunol 2023; 19(6): 627– 638. doi: 10.1080/ 1744666X.2023.2198208.
33. Marley F, Lockett M, Gompels M et al. A patient with CVID-enteropathy successfully treated with ustekinumab. Immunol Res 2024; 73(1): 19. doi: 10.1007/ s12026-024-09559-5.
34. Azzu V, Elias JE, Duckworth A et al. Liver transplantation in adults with liver disease due to common variable immunodeficiency leads to early recurrent disease and poor outcome. Liver Transpl 2018; 24(2): 171– 181. doi: 10.1002/ lt.24979.
35. Hashem H, Ghatasheh L, Najjar R et al. Outcomes of hematopoietic cell transplantation in children with inborn errors of immunity: a single-center series. J Clin Immunol 2024; 45(1): 59. doi: 10.1007/ s10875-024-01853-z.
36. Wehr C, Gennery AR, Lindemans C et al. Multicenter experience in hematopoietic stem cell transplantation for serious complications of common variable immunodeficiency. J Allergy Clin Immunol 2015; 135(4): 988.e6– 997.e6. doi: 10.1016/ j. jaci.2014.11.029.
37. Albert MH, Sirait T, Eikema DJ et al. Hematopoietic stem cell transplantation for adolescents and adults with inborn errors of immunity: an EBMT IEWP study. Blood 2023; 141(18): 2284. doi: 10.1182/ blood.2023020298.
38. Fox TA, Massey V, Lever C et al. Pre-transplant immune dysregulation predicts for poor outcome following allogeneic haematopoietic stem cell transplantation in adolescents and adults with Inborn Errors of Immunity (IEI). J Clin Immunol 2025; 45(1): 64. doi: 10.1007/ s10875-024-01854-y.
39. Tsilifis C, Speckmann C, Lum SH et al. Hematopoietic stem cell transplantation for CTLA-4 insufficiency across Europe: a European Society for Blood and Marrow Transplantation Inborn Errors Working Party study. J Allergy Clin Immunol 2024; 154(6): 1534– 1544. doi: 10.1016/ j. jaci.2024.08.020.
40. Tessarin G, Baronio M, Lougaris V. Monogenic forms of common variable immunodeficiency and implications on target therapeutic approaches. Curr Opin Allergy Clin Immunol 2023; 23(6): 461– 466. doi: 10.1097/ ACI.0000000000000947.
41. Fischer M, Olbrich P, Hadjadj J et al. JAK inhibitor treatment for inborn errors of JAK/ STAT signaling: An ESID/ EBMT-IEWP retrospective study. J Allergy Clin Immunol 2024; 153(1): 275.e18– 286.e18. doi: 10.1016/ j. jaci.2023.10.018.