Endoskopická dispenzarizace u pacientů s idiopatickými střevními záněty a primární sklerozující cholangitidou – zkušenosti terciárního centra
Mojmír Hlavatý1, Peter Mačinga Orcid.org 1, Pavel Wohl Orcid.org 1, Tetiana Osadcha2, Pavel Drastich Orcid.org 1
+ Pracoviště
Souhrn
Úvod: Pacienti s primární sklerozující cholangitidou (PSC) asociovanou s idiopatickými střevními záněty (PSC-IBD) mají vyšší riziko kolorektálních neoplazií. Cílem této studie bylo zhodnotit incidenci kolorektálních neoplazií a identifikovat rizikové faktory pro jejich vznik v rámci dlouhodobého endoskopického sledování v jednom terciárním centru. Metodika: Do retrospektivní studie bylo zařazeno 365 pacientů s PSC-IBD sledovaných mezi lety 2007 a 2025, u nichž bylo provedeno celkem 2 352 koloskopií. Byla analyzována demografická data, klinické charakteristiky, výsledky endoskopických vyšetření a histologické nálezy. Rizikové faktory pro vznik dysplazie a karcinomu byly hodnoceny pomocí Coxova regresního modelu s časově závislými proměnnými. Výsledky: Dysplazie byla detekována u 76 (20,8 %) pacientů, přičemž četnost detekce činila 9,18 %. Bylo zachyceno celkem 216 dysplazií (50,9 % z polypektomií a 49,1 % z biopsií). Adenokarcinom byl diagnostikován u 13 (3,6 %) pacientů. Statisticky významným rizikovým faktorem byl vyšší věk (HR = 1,03; p = 0,008), biologická léčba (HR = 2,48; p = 0,029) a délka trvání onemocnění (p < 0,001). Mayo endoskopic subscore dosahovalo pozitivní trend k významnosti (HR = 1,27; p = 0,051). Závěr: Naše studie potvrzuje vysoké riziko vzniku kolorektálních neoplazií u pacientů s PSC-IBD, zejména u pacientů ve vyšším věku s delším trváním onemocnění a na biologické léčbě. Zdůrazňuje význam dispenzárních koloskopií s cílenými a náhodnými biopsiemi v ročním intervalu.
Klíčová slova
primární sklerozující cholangitida, idiopatické střevní záněty, endoskopická dispenzarizace, kolorektální karcinom, dysplazie
Úvod
Primární sklerozující cholangitida (PSC) je chronické cholestatické onemocnění jater ne zcela jasné etiologie, pro které je příznačný rozvoj multifokálních stenóz žlučovodů podmíněný jejich chronickým zánětem a fibrotizací [1]. PSC je asociována s idiopatickými střevními záněty (IBD), které se v této skupině pacientů vyskytují až ve více než 70 % [2]. Tito pacienti vykazují specifický fenotyp střevního zánětu s typickým mírným klinickým průběhem, pankolitidou s pravostrannou predominancí, „back-wash“ ileitidou a ušetřením konečníku [3,4]. Další významnou charakteristikou je vysoké riziko vzniku kolorektálních neoplazií. Pacienti s PSC a IBD mají 3násobně vyšší riziko vzniku kolorektálního karcinomu (CRC) ve srovnání s pacienty s IBD bez PSC a 7násobně vyšší riziko ve srovnání s běžnou populací [5,6]. Ve švédské populační studii byla kumulativní incidence kolorektálního karcinomu u pacientů s PSC 3 %, 7 % a 11 % v 10, 20 a 30 letech od stanovení diagnózy [6].
Mezi rizikové faktory vzniku CRC u IBD pacientů obecně patří extenzivní postižení tračníku, chronická zánětlivá aktivita, délka trvání onemocnění, záchyt dysplazie s nízkým stupněm (LGD), přítomnost zánětlivých polypů, výskyt CRC v rodině, přítomnost striktur tračníku a konkomitantní PSC [7,8]. Chronický zánět se zdá být hlavním mechanizmem vzniku kolorektálního karcinomu u pacientů s IBD, a to zejména urychlením již probíhajících mutací ve zdravém epitelu tračníku [9– 11]. Ve srovnání s IBD asociovaným CRC, CRC u pacientů s PSC vykazuje podobné mutace, nejčastěji v genu TP-53. Zdůvodnění vysokého rizika CRC u pacientu stále chybí, v současnosti se přikládá ještě neprozkoumaným epigenetický faktorům [12]. Současně chybí evidence o rizikových faktorech u PSC-IBD pacientů. Z dostupných dat se zdá, že pacienti se „small-duct“ PSC jsou v nižším riziku ve srovnání s „large-duct“ PSC [13].
Vysoké riziko vzniku pokročilých neoplazií u pacientů s PSC-IBD bylo zohledněno v mezinárodních doporučených postupech, přičemž spadají do vysoce rizikové skupiny, kde je doporučena dispenzární koloskopie v ročních intervalech se segmentárními biopsiemi. Současné doporučené postupy stanovují jak endoskopii s vysokým rozlišením a bílým světlem (HD-WLE), tak konvenční chromoendoskopii (DCE) s odběrem segmentárních náhodných biopsií [14– 16].
Cílem studie bylo popsat incidenci kolorektálních neoplazií v čase u pacientů s PSC-IBD a definovat rizikové faktory pro vznik těchto neoplazií.
Metodika
Pacienti a data
Do této retrospektivní monocentrické studie byli zařazeni pacienti s PSC a překryvným syndromem PSC a autoimunitní hepatitidy (AIH), kteří byli nebo jsou sledováni v Institutu klinické a experimentální medicíny v letech 2007– 2025. Vyhledávání pacientů jsme provedli za pomoci Orphakódu, kombinace kódů MKN (K83.0; K51.0; K51.1; K51.2; K51.8; K51.9; K50.0; K50.1; K50.8; K50.9) a za pomoci jazykového AI modelu s hesly „primární sklerozující cholangitida“ a „PSC“. PSC byla diagnostikována podle současných evropských doporučení na základě typického nálezu na cholangiografii, po vyloučení sekundárních příčin anebo na základě typického nálezu v jaterní biopsii [17]. Ze studie byli vyloučení pacienti s jinou jaterní chorobou než PSC, pacienti bez IBD a pacienti po kolektomii před začátkem sledování. Ve studované populaci byly zaznamenány tyto charakteristiky: věk pacienta, datum diagnózy PSC, datum diagnózy IBD, fenotyp IBD, datum koloskopií, zaznamenaná aktivita IBD (Mayo endoskopic subscore), léčba IBD, datum transplantace jater, léčba IBD, zachycené léze a biopsie a jejich lokalizace, přítomnost dysplazie.
Endoskopie
Endoskopické výkony byly prováděny v analgosedaci za účelem dosažení dobré tolerance výkonu za použití midazolamu s fentanylem nebo propofolu. Pacienti se k vyšetření připravili preparáty s obsahem makrogolu. Všichni pacienti podepsali informované souhlasy s endoskopickým vyšetřením. Vyšetření byla prováděna s insuflací CO2, s endoskopy Olympus CF-EZ1500DL/ I, CF-H190L, PCF-H190TL, CF-H180AL/ I nebo Fujifilm EC-760Z-V/ L. Aktivita střevního zánětu byla endoskopicky hodnocena dle Mayo endoscopic subscore (MES), u pacientů s PSC-IBD a Crohnovou chorobou vzhledem k zanedbatelnému množství pacientů pouze semikvantitativně bez ohledu na lokalizaci postižení (0 – remise, 1 – mírný zánět, 2 – středně těžký zánět, 3 – těžký zánět). Během koloskopie byla provedena inspekce celého tračníku a rekta za pomoci bílého světla a byly odebrány náhodné a cílené biopsie, případně odstraněny viditelné léze. Konvenční ani virtuální chromoendoskopie nebyla prováděna.
Histologie
Dysplazie byla zaznamenána podle revidované Vídeňské klasifikace neoplazií gastrointestinálního traktu: indefinit for dysplasia (ID), dysplazie nízkého stupně (LDG) a dysplazie vysokého stupně (HGD). Všechny dysplazie i adenokarcinomy byly potvrzeny dvěma patology. Histologické preparáty nebyly revidovány a byly zaznamenány dle původní zprávy.
Statistická analýza
Po automatickém vyhledání záznamů pacientů byly tyto záznamy manuálně kontrolovány a zaznamenány do MS Excel. Statistické analýzy byly provedeny v prostředí R verze 4.5.0. Fisher’s exact test, Pearson’s Chi squared test a Wilcoxon rank sum test byly použity pro základní srovnání sledovaných skupin. K identifikaci rizikových faktorů vedoucích k záchytu dysplazie nebo adenokarcinomu byl použit Coxův proporční hazardní model s časově závislými proměnnými. Tento model byl zvolen z důvodu přítomnosti proměnných, jejichž hodnoty se v průběhu sledování mění, a mohou tak ovlivnit riziko záchytu v čase. Pro hodnocení incidence dysplazií v čase byly sestaveny Kaplan-Meierovy křivky a odhadnuty mediány přežití bez záchytu.
Výsledky
Demografie
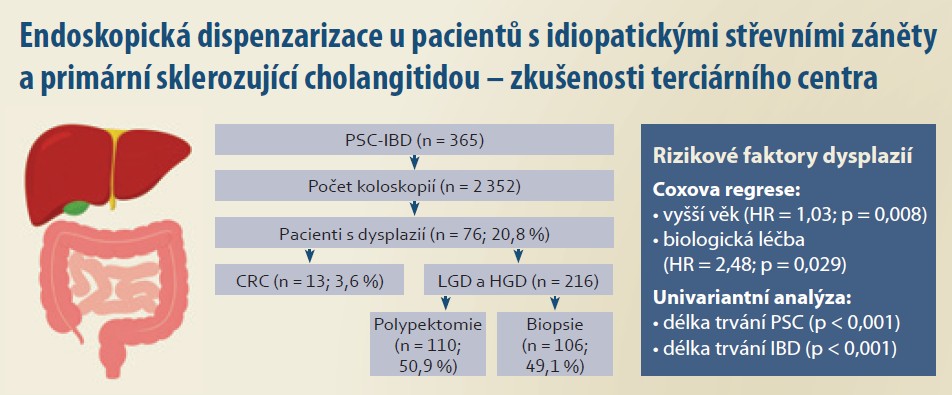
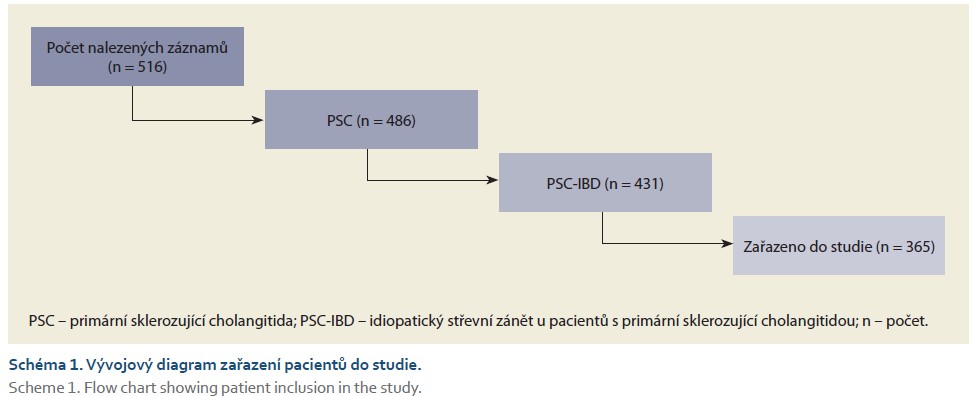
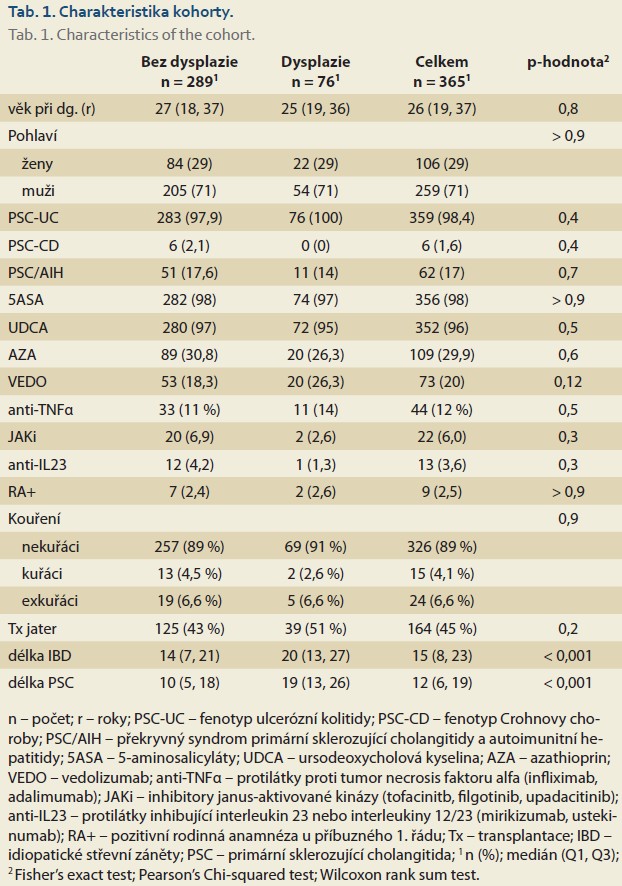
Do studie bylo po splnění všech kritérií zařazeno 365 pacientů s PSC a PSC IBD, u nichž bylo provedeno od začátku ledna 2007 do konce června 2025 celkem 2 352 koloskopii s mediánem 5 (IQR 2– 8) vyšetření na pacienta (schéma 1). Délka sledování dosahovala 4 069 pacient-roků. Většinu kohorty, až 259 (71 %) pacientů, tvořili muži, medián věku v době diagnózy dosahoval 26 (IQR 19-37) let. Zařazeno bylo i 62 (17 %) pacientů s PSC/ AIH overlap syndromem. Až 359 (98,4 %) pacientů mělo dokumentovaný fenotyp střevního zánětu PSCUC, pouze 6 (1,6 %) pacientů bylo hodnoceno jako PSCCD. Jednu a/ nebo více transplantací jater podstoupilo 164 (45 %) pacientů. Ursodeoxycholovou kyselinu (UDCA) užívalo 352 (96 %) pacientů. Většina pacientů, tj. celkem 356 (98 %), užívala během sledování 5aminosalyciláty (5ASA), 73 (19,8 %) pacientů během sledování užívalo azathioprin. Z preparátů biologické a inovativní léčby užívalo až 73 (20 %) pacientů během sledování vedolizumab, 44 (12 %) užívalo jeden z preparátů ze skupiny anti-TNFa, 22 (6 %) užívalo minimálně jeden z preparátů ze skupiny inhibitorů JAK a 13 pacientů (3,6 %) užívalo alespoň jeden z preparátů ze skupiny anti-IL23. Celkem 40 (10,9 %) pacientů podstoupilo subtotální kolektomii nebo proktokolektomii, z nich 12 pro aktivitu onemocnění, 15 z důvodu záchytu multifokální dysplazie nízkého stupně nebo endoskopicky neřešitelné dysplazie a 13 pacientů z důvodu nálezu adenokarcinomu. Ostatní demografické údaje včetně rozdělení pacientů podle záchytu dysplazií jsou uvedeny v tab. 1.
Dispenzární koloskopie a záchyt dysplazií
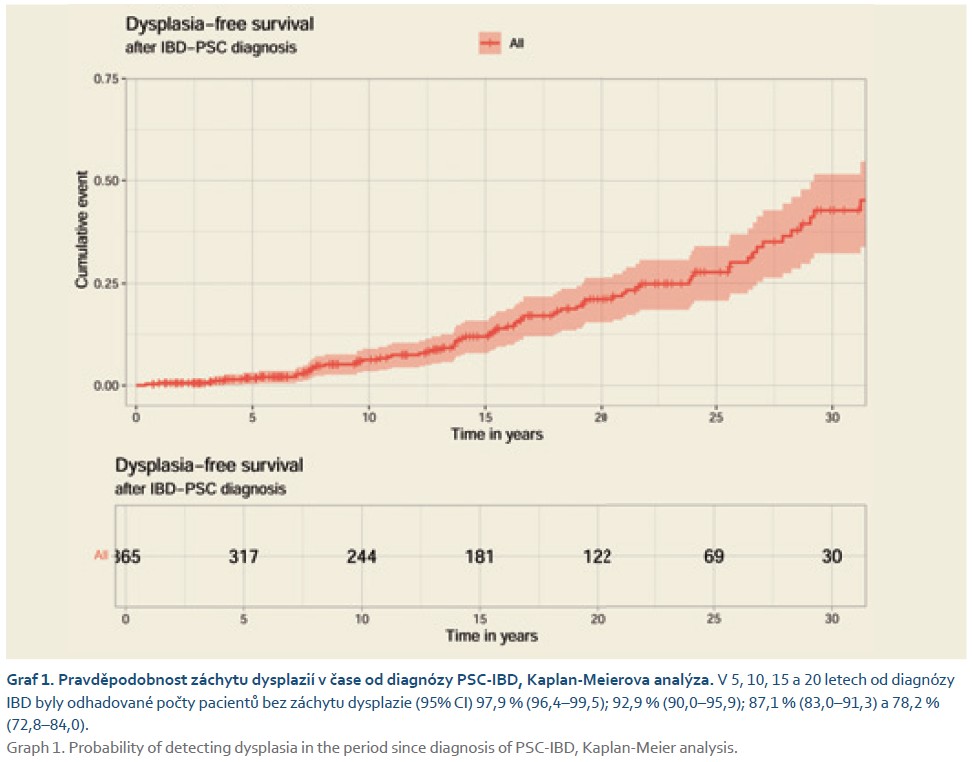
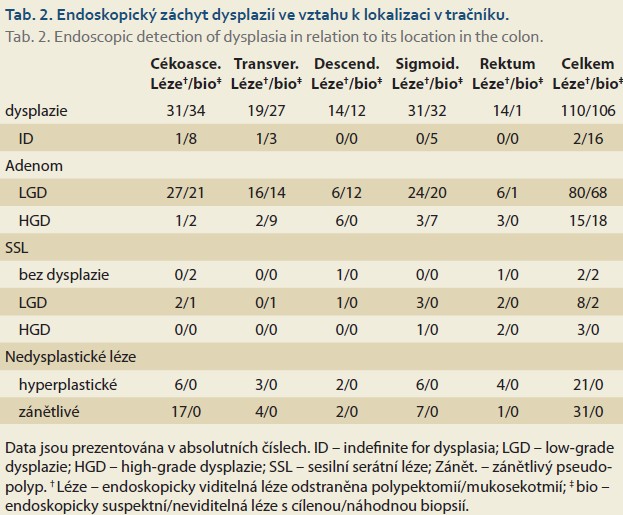
Provedenými vyšetřeními bylo zachyceno dohromady 216 dysplazií u celkem 76 (20,8 %) pacientů s PSC-IBD. Četnost detekce dysplazií (neoplasia detection rate) dosahovala 9,18 % při použití endoskopie s bílým světlem a vysokým rozlišením. Celkem bylo detekováno 110 (50,9 %) dysplazií a 106 (49,1 %) endoskopicky neviditelných lézí. Nejvíce dysplazií, tj. 75 (34,7 %), bylo zachyceno v pravém tračníku, z toho 31 viditelných a 34 neviditelných. Následovalo colon sigmoideum s celkovým počtem 73 (33,8 %) identifikovaných dysplazií, 31 viditelných a 32 neviditelných. Zachyceno bylo 18 (8,3 %) lézí hodnocených jako ID, 2 z viditelných lézí, 16 z náhodných biopsií. LGD bylo 148 (68,5 %), 80 z viditelných lézí a 68 z biopsií. HGD bylo dohromady 33 (15,3 %), z toho 15 z viditelných lézí a 18 zachyceno v biopsiích. Detailnější distribuce záchytu dysplazií je uvedena v tab. 2. Záchyt dysplazii v čase je uveden v grafu 1.
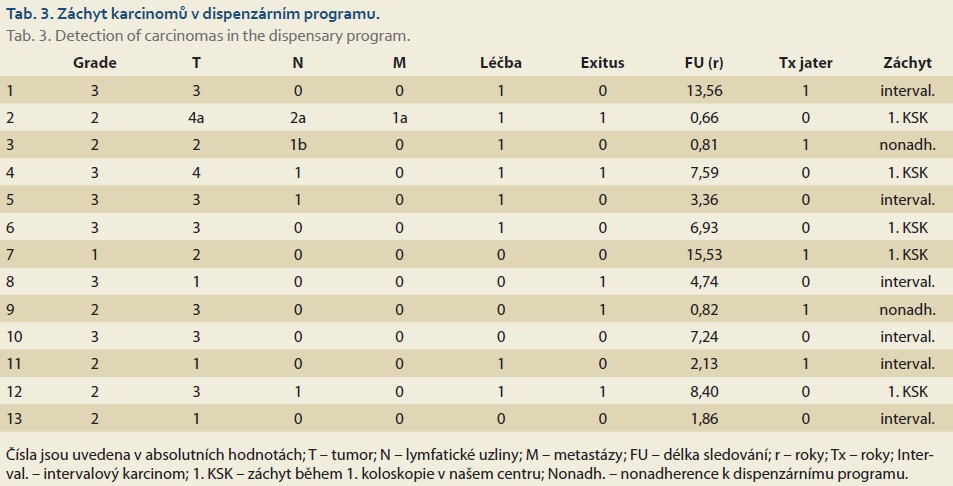
V kohortě byl nalezen adenokarcinom u 13 (3,6 %) pacientů, z nichž 5 bylo již po transplantaci jater. Medián věku během diagnózy byl 45,4 (IQR 38,8; 52,5) let, medián délky trvání IBD dosahoval 11,1 (IQR 4,3; 18,4) let. U většiny, tj. celkem osmi (61,5 %), pacientů byl adenokarcinom zachycen jako makroskopicky viditelná léze, u pěti (38,5 %) byla histologie vyhodnocena jako HGD a diagnóza malignity byla potvrzena následně v explantátu po proktokolektomii. U pěti pacientů (38,5 %) byl zachycen karcinom na první koloskopii po převzetí do péče. Dalších šest pacientů (46,5 %) mělo intervalový karcinom, z nichž ve čtyřech případech byla diagnóza stanovena po kolektomii pro multifokální dysplazie z explantátu střeva, pouze u dvou pacientů se vyskytla viditelná endoskopická léze. Pouze jeden pacient ze skupiny intervalových karcinomů zemřel na generalizaci karcinomu. Zbylí dva pacienti byli diagnostikováni po non-adherenci k dispenzárnímu programu. K úmrtí v důsledku generalizace malignity došlo u tří pacientů. Staging nádorů a prognóza pacientů je uvedena v tab. 3.
Rizikové faktory záchytu dysplazií
K identifikaci rizikových faktorů vedoucích k záchytu dysplazie nebo adenokarcinomu byl použit Coxův regresní model s časově závislými proměnnými. Do modelu byly zahrnuty proměnné transplantace jater, biologická léčba a MES jako časově závislé proměnné, zatímco věk a pohlaví byly zahrnuty jako fixní. Začátek sledování (počátek rizikového období) byl definován jako datum diagnózy IBD. Výsledný soubor zahrnoval 2 307 časových intervalů a celkem 76 záchytů neoplazií.
Model ukázal, že statisticky významným rizikovým faktorem byla biologická léčba (HR = 2,48; 95% CI 1,10– 5,61; p = 0,029). Vyšší věk měl rovněž statisticky významný efekt, přičemž vyšší věk zvyšoval riziko záchytu dysplazií (HR = 1,03; 95% CI 1,01– 1,05; p = 0,008). Pohlaví (HR = 1,00; 95% CI 0,61– 1,65; p = 0,990), stav po transplantaci jater (HR = 1,42; 95% CI 0,88– 2,30; p = 0,152) a MES (HR = 1,27; 95% CI 1,00– 1,61; p = 0,051) neprokázaly statisticky významnou souvislost se záchytem. Celkový model byl statisticky významný (LR test = 18,22; df = 5; p = 0,0027).
Diskuze
Naše stude popisuje záchyt kolorektálních neoplazií v dispenzárním programu v dobře definované a doposud největší publikované monocentrické kohortě pacientů s PSC-IBD, včetně těch po transplantaci jater. Mezi nezávislý rizikový faktor vzniku kolorektálních neoplazií patří vyšší věk pacientů a biologická léčba. Kohorta se záchytem dysplazií měla signifikantně delší dobu trvání PSC i IBD. Vysoký záchyt dysplazií z náhodných a cílených biopsií podporuje jejich klinický přínos během dispenzárních koloskopií u vysoce rizikových skupin s IBD.
Demografické údaje se ve většině parametrů shodují s ostatními publikovanými kohortami pacientů s PSC a PSC-IBD. Výjimku tvořila překvapivě vysoká prevalence fenotypů PSC-IBD. PSC-UC byla více zastoupena v naší kohortě ve porovnání s výsledky předchozích studií (98,4 vs. 69,3 %) [18,19]. Nižší prevalence PSC-UC v ostatních publikovaných kohortách může být vysvětlena jejich multicentrickým formátem nebo užitím registrů, a tím i nedokonalé kategorizaci fenotypu IBD. Dalším pozoruhodným rozdílem je vysoký počet pacientů na terapii 5ASA a UDCA, které v naší kohortě dosahovalo 98 a 96 %. V současnosti neexistuje jasný konsenzus v případě UDCA a jeho dlouhodobého efektu na přežití pacientů stran jaterního onemocnění, nicméně možný benefit na snížení incidence CRC u pacientů s PSC-IBD byl prokázán ve starší metaanalýze [20]. Stejně tak chemoprotektivní efekt 5ASA zejména v kombinaci s inovativní léčbou nebyl jasně prokázán [16].
Záchyt dysplazií dosahoval 20,8 % a byl srovnatelný s ostatními publikovanými studiemi (20,8 vs. 24 %) [18,21]. Poměr endoskopicky viditelných a neviditelných dysplazií byl v naší kohortě srovnatelný (50,9 vs. 49,1 %), což potvrzuje potřebu cílených i náhodných segmentárních biopsií. Watanabe et al. popsali podobný záchyt z cílených a náhodných biopsií, další studie Moussaata et al. z Francie také potvrzují význam náhodných biopsii u pacientů s PSC-IBD, nicméně záchyt dysplazií u pacientů s IBD bez PSC byl nízký [22,23]. Tyto skutečnosti se odrážejí i v poslední aktualizaci doporučení SCENIC, u nichž je u vysoce rizikových pacientů s IBD včetně PSC-IBD během dispenzární koloskopie doporučeno provádět segmentární necílené biopsie [24]. Nejvyšší incidence dysplazií byla v pravém tračníku (34,7 %), což je v souladu s předchozími publikovanými výsledky u pacientů s PSC-IBD [25]. Nicméně záchyt dysplazií ve zbytku tračníku nebyl zanedbatelný, a proto je nezbytná důkladná inspekce celého tračníku. Vysoký podíl LGD (n = 148) oproti HGD (n = 33) odráží efektivitu dispenzárního sledování v záchytu časných lézí i v bílém světle. Četnost záchytu dysplazií (dysplasia detection rate) dosahovala 9,18 %. Studie srovnávající HD-WLE a DCE reportovala záchyt dysplasia detection rate 6 % u HD-WLE a 13,6 % u DCE. V recentně publikovaných metaanalýzách studií na populaci IBD pacientů DCE zvyšovala šanci záchytu dysplazie 2,5násobně [26]. Nesporný benefit DCE na záchyt dysplastických lézí je odvozen ze studií s IBD pacienty, nicméně prospektivní studie u PSC-IBD doposud publikována nebyla.
Při zkoumání rizikových faktorů pro vznik dysplazií jsme použili Coxův regresní model s proměnnými závislými na čase. Nezávislým rizikovým faktorem byl vyšší věk (HR = 1,03; 95% CI 1,01– 1,05) a biologická léčba (HR = 2,48; 95% CI 1,10– 5,61). Kumulativní MES mělo trend k statistické významnosti (HR = 1,27; 95% CI 1,00– 1,61). Skupina pacientů s dysplaziemi měla rovněž signifikantně delší dobu trvání PSC i IBD. Většina těchto rizikových faktorů je již známá v IBD, nicméně se zde jedná o první výsledky v populaci pacientů s PSC-IBD. Podporují fakt, že chronický aktivní zánět tlustého střeva vede k akceleraci dysplastických změn. Biologická léčba nepředstavuje rizikový faktor jako takový, ale spíše definuje skupinu pacientů s těžkým průběhem střevního zánětu ve vysokém riziku vzniku dysplazií. Z metaanalýzy rizikových faktorů vyplývá, že pouze histologická aktivita je asociována s vyšším rizikem vzniku pokročilých dysplazií [7]. V naší studií měl MES trend k statistické významnosti, zhodnocením histologické aktivity by se možná dosáhlo statistické významnosti, ta ale vzhledem k retrospektivní povaze studie a dlouhé době sledování nemohla být hodnocena. Pro PSC-IBD je charakteristická také nízká asociace histologické aktivity a MES u pacientů s PSC-IBD [7,27]. Pozitivní rodinná anamnéza na CRC a kouření nedosáhly statistické významnosti, a proto nebyly do finálního modelu zařazeny. Zvažovaný protektivní účinek UDCA a 5ASA jsme ve studii nemohli prokázat, jelikož tyto léky užívá více než 95 % pacientů.
Záchyt kolorektálního karcinomu byl srovnatelný s rozsáhlou švédskou populační studií (3,6 vs. 4,2 %) [28]. U více než třetiny případů byla malignita potvrzena až na základě explantátu po proktokolektomii, což podtrhuje obtížnost detekce karcinomů během rutinní endoskopické dispenzarizace, zejména v případě plochých lézí v zánětlivém terénu. Méně než polovina pacientů měla intervalový karcinom, který byl ve většině případů zachycen v časném stadiu a neměl vliv na jejích mortalitu. Tyto výsledky podporují význam ročního intervalu dispenzárních koloskopií u pacientů s PSC-IBD. Medián věku v době diagnózy (45,4 let) a medián délky trvání IBD (11,1 let) ukazují, že malignita může vzniknout i časně po stanovení diagnózy IBD. Úmrtí ve třech případech v důsledku generalizace onemocnění pak podtrhuje závažnost CRC v této vysoce rizikové populaci.
Mezi nejvýznamnější limitace této studie patří její retrospektivní design a absence kontrolní skupiny. Vzhledem k retrospektivní povaze studie se těžko odlišují sporadické adenomy a IBD-asociované dysplazie. S ohledem na dlouhý interval sledování pacientů a rozdíly ve formátu popisů vyšetření a kategorizaci lézí v čase nebylo možné spolehlivě hodnotit endoskopickou klasifikaci detekovaných lézí ani jejích velikost. Záchyty dysplazií mohly být ovlivněny užíváním pouze bílého světla a absencí DCE. Vzhledem k velkému množství PSC pacientů v naší kohortě není možné provádět rutinně DCE pro časovou náročnost a kapacity našeho endoskopického centra (cca osm koloskopií u PSC-IBD pacientů týdně). Část pacientů nebyla sledována na našem pracovišti od doby diagnózy IBD, což může vést k podhodnocení množství dysplazií v čase.
Závěr
Výsledky této studie poukazují na skutečnost, že pacienti s PSC-IBD jsou ve zvýšeném riziku kolorektálních neoplazií a vyžadují pravidelnou endoskopickou dispenzarizaci. Toto riziko vzrůstá s vyšším věkem, délkou trvání onemocnění a pacientů na biologické léčbě. V této skupině pacientů je důležité provádět náhodné i cílené biopsie.
ORCID autorů
M. Hlavatý 0009-0007-1718-436X,
P. Mačinga 0000-0003-3699-6914,
P. Wohl 0000-0003-0948-0904,
T. Osadcha 0009-0008-7659-9431,
P. Drastich 0000-0002-5656-9242.
Doručeno/ Submitted: 7. 8. 2025
Přijato/ Accepted: 11. 8. 2025
Korespondenční autor
MU Dr. Mojmír Hlavatý
Klinika hepatogastroenterologie
Institut klinické a experimentální medicíny
Vídeňská 1958/ 9
140 21 Praha
hltm@ikem.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Karlsen TH, Folseraas T, Thorburn D et al. Primary sclerosing cholangitis – a comprehensive review. J Hepatol 2017; 67(6): 1298– 1323. doi: 10.1016/ j. jhep.2017.07.022.
2. Zhang Y, Gao X, He Z et al. Prevalence of inflammatory bowel disease in patients with primary sclerosing cholangitis: a systematic review and meta-analysis. Liver Int 2022; 42(8): 1814– 1822. doi: 10.1111/ liv.15339.
3. Loftus EV, Harewood GC, Loftus CG et al. PSC-IBD: a unique form of inflammatory bowel disease associated with primary sclerosing cholangitis. Gut 2005; 54(1): 91– 96. doi: 10.1136/ gut.2004.046615.
4. Bajer L, Kamenar D, Sticova E et al. Inflammatory bowel disease in patients with primary sclerosing cholangitis – a unique phenotype of IBD. Gastroent Hepatol 2014; 68(1): 24– 35.
5. Zheng HH, Jiang XL. Increased risk of colorectal neoplasia in patients with primary sclerosing cholangitis and inflammatory bowel disease: a meta-analysis of 16 observational studies. Eur J Gastroenterol Hepatol 2016; 28(4): 383– 390. doi: 10.1097/ MEG.00000000000 00576.
6. Lundberg Båve A, Bergquist A, Bottai M et al. Increased risk of cancer in patients with primary sclerosing cholangitis. Hepatol Int 2021; 15(5): 1174– 1182. doi: 10.1007/ s12072-021- 10214-6.
7. Wijnands AM, de Jong ME, Lutgens MW et al. Prognostic factors for advanced colorectal neoplasia in inflammatory bowel disease: systematic review and meta-analysis. Gastroenterology 2021; 160(5): 1584– 1598. doi: 10.1053/ j. gastro.2020.12.036.
8. Shah SC, Itzkowitz SH. Colorectal cancer in inflammatory bowel disease: mechanisms and management. Gastroenterology 2022; 162(3): 715.e3– 730.e3. doi: 10.1053/ j. gastro.2021.10.035.
9. Olafsson S, McIntyre RE, Coorens T et al. Somatic evolution in non-neoplastic IBD-affected colon. Cell 2020; 182(3): 672.e11.e11– 684.e11. doi: 10.1016/ j. cell.2020.06.036.
10. Zhou RW, Harpaz N, Itzkowitz SH et al. Molecular mechanisms in colitis-associated colorectal cancer. Oncogenesis 2023; 12(1): 48. doi: 10.1038/ s41389-023-00492-0.
11. Choi CHR, Al Bakir I, Ding NS et al. Cumulative burden of inflammation predicts colorectal neoplasia risk in ulcerative colitis: a large single-centre study. Gut 2019; 68(3): 414– 422. doi: 10.1136/ gutjnl-2017-314190.
12. de Krijger M, Carvalho B, Rausch C et al. Genetic profiling of colorectal carcinomas of patients with primary sclerosing cholangitis and inflammatory bowel disease. Inflamm Bowel Dis 2022; 28(9): 1309– 1320. doi: 10.1093/ ibd/ izac087.
13. Al-Shakhshir S, Abbas N, Morris S et al. P316 small duct primary sclerosing cholangitis is not associated with heightened risk of colorectal cancer compared to inflammatory bowel disease alone. Gut 2024; 73(Suppl 1): A245– A246. doi: 10.1136/ gutjnl-2024- BSG.398.
14. Gordon H, Biancone L, Fiorino G et al. ECCO Guidelines on inflammatory bowel disease and malignancies. J Crohns Colitis 2022; 17(6): 827– 854. doi: 10.1093/ ecco-jcc/ jjac187.
15. Murthy SK, Feuerstein JD, Nguyen GC et al. AGA clinical practice update on endoscopic surveillance and management of colorectal dysplasia in inflammatory bowel diseases: expert review. Gastroenterology 2021; 161(3): 1043.e4– 1051.e4. doi: 10.1053/ j. gastro.2021. 05.063.
16. East JE, Gordon M, Nigam GB et al. British society of gastroenterology guidelines on colorectal surveillance in inflammatory bowel disease. Gut 2025; gutjnl-2025-335023. doi: 10.1136/ gutjnl-2025-335023.
17. Chazouilleres O, Beuers U, Bergquist A et al. EASL clinical practice guidelines on sclerosing cholangitis. J Hepatol 2022; 77(3): 761– 806. doi: 10.1016/ j. jhep.2022.05.011.
18. Motta RV, Gupta V, Hartery K et al. Dye-based chromoendoscopy detects more neoplasia than white light endoscopy in patients with primary sclerosing cholangitis and IBD. Endosc Int Open 2024; 12(11): E1285– E1294. doi: 10.1055/ a-2437-8102.
19. Shah SC, ten Hove JR, Castaneda D et al. High risk of advanced colorectal neoplasia in patients with primary sclerosing cholangitis associated with inflammatory bowel disease. Clin Gastroenterol Hepatol 2018; 16(7): 1106.e3– 1113.e3. doi: 10.1016/ j. cgh.2018.01.023.
20. Singh S, Khanna S, Pardi DS et al. Effect of ursodeoxycholic acid use on the risk of colorectal neoplasia in patients with primary sclerosing cholangitis and inflammatory bowel disease: a systematic review and meta-analysis. Inflamm Bowel Dis 2013; 19(8): 1631– 1638. doi: 10.1097/ MIB.0b013e318286fa61.
21. Weiss A, Thanawala S, Buchner A et al. Severity of inflammation as a risk factor for the development of colorectal dysplasia in PSC-IBD. Gastrointest Endosc 2023; 97(6): AB545.
22. Watanabe T, Ajioka Y, Mitsuyama K et al. Comparison of targeted vs random biopsies for surveillance of ulcerative colitis-associated colorectal cancer. Gastroenterology 2016; 151(6): 1122– 1130. doi: 10.1053/ j. gastro.2016. 08.002.
23. Moussata D, Allez M, Cazals-Hatem D et al. Are random biopsies still useful for the detection of neoplasia in patients with IBD undergoing surveillance colonoscopy with chromoendoscopy? Gut 2018; 67(4): 616– 624. doi: 10.1136/ gutjnl-2016-311892.
24. Kiesslich R. SCENIC update 2021: is chromoendoscopy still standard of care for inflammatory bowel disease surveillance? Gastrointest Endosc 2022; 95(1): 38– 41. doi: 10.1016/ j. gie. 2021.10.009.
25. Claessen MM, Lutgens MW, van Buuren HR et al. More right-sided IBD-associated colorectal cancer in patients with primary sclerosing cholangitis. Inflamm Bowel Dis 2009; 15(9): 1331– 1336. doi: 10.1002/ ibd. 20886.
26. Huang CW, Yen HH, Chen YY. Endoscopic techniques for colorectal neoplasia surveillance in inflammatory bowel disease: a systematic review and network meta-analysis. United European Gastroenterol J 2025. doi: 10.1002/ ueg2.70017.
27. Wohl P, Krausova A, Wohl P et al. Limited validity of Mayo endoscopic subscore in ulcerative colitis with concomitant primary sclerosing cholangitis. World J Gastrointest Endosc 2024; 16(11): 607– 616. doi: 10.4253/ wjge.v16. i11.607.
28. Abdalla M, Eberhardson M, Landerholm K et al. Impact of inflammatory bowel disease and primary sclerosing cholangitis on colorectal cancer risk: national cohort study. Clin Gastroenterol Hepatol 2025; S1542-3565(25)00621-4. doi: 10.1016/ j. cgh.2025.06.037.