Výlučná enterální výživa – léčba první volby Crohnovy choroby u dětí
Eva Karásková1
+ Pracoviště
Souhrn
Nespecifické střevní záněty zahrnují Crohnovu chorobu a ulcerózní kolitidu. Až u 20 % pacientů se Crohnova choroba projeví před 18. rokem věku. Vznik onemocnění v dětství je často provázen růstovou retardací a poruchou kostního metabolizmu. Terapeutický přístup se v některých léčebných postupech liší od léčby dospělých. Jde především o iniciální indukční terapii nově diagnostikovaného dětského pacienta s Crohnovou chorobou, kde ve většině případů používáme exkluzivní enterální výživu, která v posledních letech z velké části nahradila léčbu kortikoidy. Tato léčba podle dostupných studií indukuje endoskopickou remisi lépe než kortikoidy, zlepšuje kostní metabolizmus a růstové i nutriční parametry. Je většinou dobře tolerovaná a při správném podání má minimum komplikací a nežádoucích účinků.
Klíčová slova
Crohnova choroba, dítě, enterální výživaÚvod
Crohnova choroba (CN) patří spolu s ulcerózní kolitidou mezi nespecifické střevní záněty (IBD – inflammatory bowel diseases). Jde o chronicky relabující zánětlivé onemocnění postihující trávicí trakt. Před 18. rokem věku se CN manifestuje přibližně u 20 % pacientů. Incidence u dětí se uvádí 2,5–11,4 na 100 000 a prevalence 58 na 100 000 [1]. V dětském věku je často postižena rozsáhlejší část gastrointestinálního traktu a IBD mívá agresivnější průběh [2]. Ve srovnání s onemocněním, které vznikne v dospělosti, je u dětských pacientů vyšší riziko nutnosti chirurgického výkonu do 30 let věku (48 ± 5 % vs. 14 ± 2 %) [3]. Specifickou komplikací CN u dětí je porucha růstu, která se vyskytuje až u 46 % pacientů v době diagnózy [4]. Léčba kortikoidy může růstovou poruchu dále prohloubit [1,5].
Cílem léčby pediatrické CN je tedy nejen zmírnit/odstranit klinické potíže a zlepšit kvalitu života s minimalizací lékové toxicity, ale také optimalizovat růst. V nejlepším případě pak dosáhnout slizničního hojení, které je spojeno s dlouhodobě příznivějším průběhem choroby a menším počtem komplikací [1,6]. Terapie CN u dětí se v některých léčebných postupech liší od léčby dospělých pacientů. Jde především o iniciální indukční terapii nově diagnostikovaného, léčebně naivního dětského pacienta, kde ve většině případů používáme exkluzivní enterální výživu (EEV). V posledních letech nahradila EEV z velké části léčbu kortikoidy. Jak již bylo zmíněno, kortikoidy vedou u dětí k prohloubení preexistující růstové retardace [1,5] a navíc mohou mít další známé nežádoucí účinky. U EEV je naopak prokázán dlouhodobý příznivý vliv na antropometrické ukazatele (hmotnost a BMI) [7] a parametry kostního metabolizmu [8].
V roce 2014 byla publikována aktualizovaná doporučení pro léčbu CN u dětí, která byla vypracována jako konsenzus odborných společností ESPGHAN (European Society of Pediatric Gastroenterology, Hepatology and Nutrition) a ECCO (European Crohn’s and Colitis Organization). EEV je doporučena jako indukční terapie první volby z důvodů výborného bezpečnostního profilu a měla by být preferována před kortikoidy u všech forem CN. Po indukční léčbě vyžaduje většina dětí dlouhodobou udržovací terapii imunomodulátory (azatioprin, 6-merkaptopurin, metotrexát) a v indikovaných případech pak biologickou léčbu (BL; infliximab, adalimumab). Mimo standardní klinické a laboratorní markery remise je u dětí ukazatelem dobré léčebné kontroly onemocnění také obnovení adekvátního růstu a kostního metabolizmu [1].
Historie EEV
Nutriční terapie CN byla poprvé zmíněna v 50. letech 20. století u komplikovaných pacientů nevhodných k chirurgické léčbě, tehdy ještě bez znalosti jejího efektu na aktivitu onemocnění [6]. V 70. letech 20. století byl po podání enterální výživy popsán pokles zánětlivých ukazatelů. V 80. a 90. letech 20. století pak byly publikovány první práce, které se zabývaly možností využít EEV k indukci remise CN u dětí i dospělých [9,10].
Mechanizmus účinku EEV
Mechanizmus účinku není dosud přesně znám. Zvažují se přímé protizánětlivé účinky EEV (redukce TNF-α, IL-6, IL-1β, IL-8, CRP) [6], regenerace epiteliální bariéry a modifikace střevní mikroflóry [11]. Zvažována je i modulace imunitní odpovědi substitucí některých deficitních nutrientů (vitamin C, D, E, zinek, selen) [6]. Formule EEV jsou bezlepkové a i tento faktor může mít vliv na terapeutický efekt. Roli zřejmě hraje i tekutá forma EEV, která aktivuje mechanoreceptory trávicího traktu jinak než strava pevná [12].
EEV vs. kortikoidy
Studie porovnávající efekt EEV vs. kor- tikoidy mají různé výsledky u dětí a u dospělých. Randomizovaná, kontrolovaná studie vyhodnotila při EEV oproti kortikoidům stejný klinický efekt, delší období bez relapsu a lepší nutriční stav dětských pacientů [13]. Po léčbě EEV bylo rovněž zjištěno zlepšení kostní denzity [8]. Naproti tomu metaanalýza z roku 2007, která však zahrnovala dětské i dospělé pacienty, ukázala lepší efekt kortikoidů [5].
Slizniční hojení po EEV
U dětí léčených EEV je uváděno slizniční hojení podle různých prací v širokém rozmezí 19–75 % [1]. V randomizované, kontrolované studii z roku 2006 byly děti s nově diagnostikova- nou CN rozděleny do dvou skupin a v týdnu 10 byl hodnocen endoskopický nález. Slizniční hojení bylo zjištěno u 74 % dětí léčených EEV oproti 33 % dětí léčených kortikoidy [14]. Americká studie, která porovnávala slizniční hojení pomocí měření kalprotektinu ve stolici, prokázala signifikantní pokles hodnot (pod 250 µg/g), u 62 % pacientů léčených anti-TNF-α léky a 45 % léčených EEV [15].
Indikace EEV
EEV je efektivní, především pokud CN postihuje tenké střevo. Indikovaná je ale také v případě CN kolitidy. Naproti tomu nejsou data, která by podporovala efektivitu EEV u izolované orální nebo perianální choroby. EEV není účinná při extraintestinální manifestaci CN (enteropatická artritida, erythema nodosum atd.) [1].
Způsob podání EEV
Indukční terapie EEV je podávána 6–8 týdnů. EEV má tekutou formu a svým složením odpovídá komplexní polymerní enterální formuli s neštěpenou bílkovinou, sacharidy, lipidy, vitaminy a stopovými prvky. Oligomerní nebo elementární formule jsou indikovány pouze v ojedinělých případech těžkého malabsorpčního syndromu, intolerance bílkoviny kravského mléka apod. Rozdíl v efektivitě polymerní a elementární výživy u dětí s CN nebyl prokázán [16]. Polymerní formule jsou levnější a chuťově lépe tolerované. Aby došlo k terapeutickému efektu EEV, nejí dítě během léčebné doby (6–8 týdnů) žádnou jinou stravu a pije pouze neslazenou balenou vodu.
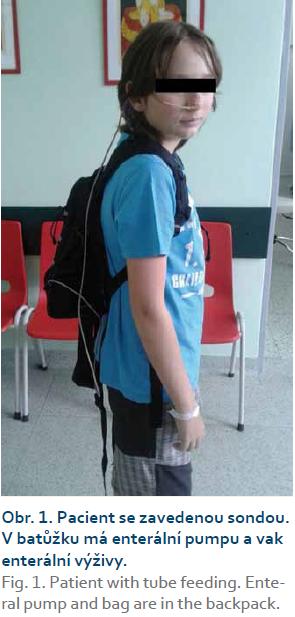
EEV lze podat per os nebo sondou. Perorální podání je preferováno, ale tolerance je individuální. Palatabilita přípravků enterální výživy se v posledních letech výrazně zlepšila, nicméně u dětí s CN, které trpí nechutenstvím z důvodů základního onemocnění, může být dosažení doporučené denní dávky živin nemožné. U těchto pacientů je nezbytné zavést nazogastrickou nebo nazojejunální sondu. Nazojejunální sondou podáváme EEV kontinuálně. Do nazogastrické sondy je možné podávat EEV bolusově nebo kontinuálně, podle tolerance dětského pacienta. S výhodou využíváme noční dobu k aplikaci větší části z celodenní předepsané dávky, kdy je EEV aplikována kontinuálně enterální pumpou. Během dne je pak EEV podávána per os nebo opět sondou. U některých dětí může 6–8tý- denní aplikace sondové výživy přinášet sociální problémy (děti např. nechtějí „se sondou v nose“ chodit do školy mezi spolužáky). Jakkoli se tento problém může jevit zásadní, nakonec jej většina dětí překoná. Compliance k EEV se zvyšuje, pokud jsou děti a jejich rodiče podrobně edukováni o přínosu léčby a sami pak sledují její příznivý efekt, zejména ústup klinických potíží. Sondovou výživou aplikovanou kontinuálně přes noc zajistíme podání podstatné části celkové denní dávky živin, a pokud je správně vypočtena, tak minimalizujeme u dítěte pocit hladu. Dítě, které má hlad, je ve vysokém riziku porušení EEV běžnou stravou. Tím se terapeutický účinek EEV výrazně snižuje.
Dávka EEV
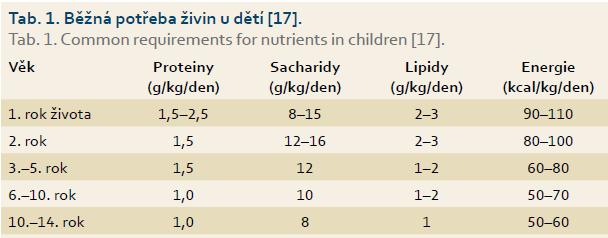
Celkovou denní dávku EEV vypočteme podle doporučené potřeby bílkovin, sacharidů, tuků a celkové energie vzhledem k ideální hmotnosti v daném věku s přídavkem 20 % energie k doplnění preexistujícího nutričního deficitu (tab. 1). V úvodu podávání EEV u těžce malnutričních dětí je třeba opatrnosti pro vysoké riziko vzniku refeeding syndromu. V tomto případě jsou počáteční dávky redukované a až po ověření tolerance EEV (klinické i laboratorní) jsou postupně zvyšovány.
Efektivitu léčby posuzujeme většinou po 2–3 týdnech podle klinického stavu a laboratorních parametrů (C-reaktivní protein, kalprotektin ve stolici atd.). Nejsou-li známky odpovědi, je třeba zvážit jiný druh terapie [17].
V posledních dnech podávání EEV se postupně zavádí bezezbytková šetřící strava. Forma návratu pacienta od EEV k běžné stravě není dosud standardizována. Některá data podporují příznivý efekt na prodloužení doby remise CN, pokud po EEV následuje podávání parciální enterální výživy [18].
Komplikace a nežádoucí účinky EEV
Nežádoucí účinky EEV se vyskytují zřídka. Jde jednak o komplikace sondové výživy (poranění sliznice trávicího traktu při zavádění sondy, vznik dekubitu v místě tlaku sondy na sliznici, neprůchodnost sondy, porucha funkce enterální pumpy) a komplikace metabolické.
Mezi metabolické komplikace patří:
Refeeding syndrom – soubor metabolických abnormalit (hypofosfa- temie, hypokalemie, hypomagnezemie, hyperglykemie, deficit vitaminů skupiny B, porucha acidobazické rovnováhy), které vznikají jako následek příliš rychlé úvodní fáze realimentace u dlouhodobě a/nebo těžce malnutričních pacientů. V těchto případech je nutné na možnost vzniku refeeding syndromu myslet, při zahájení realimentace pacienta monitorovat, podat výživu v redukovaných dávkách a adekvátně suplementovat deficitní substráty [19].
Hyperosmolární syndrom a malabsorpce živin z EEV – projeví se bolestí břicha, průjmy, zvracením. Potíže působí vysoká osmolarita preparátu EEV (vyšší osmolaritu mají oligomerní a elementární přípravky EEV než polymerní) nebo malabsorpce sacharidů střevními disacharidázami při rozsáhlejším poškození sliznice tenkého střeva zánětem.
Hyperalimentační syndrom – vzniká v případě podání neadekvátně vysoké dávky EEV. Může dojít k iritaci pankreatu, elevaci hodnot jaterních testů, hyperglykemii, hypertriglyceridemii apod.
Nedostatečná dávka EEV většinou souvisí s perorálním podáním EEV, kdy dítě není schopno předepsanou dávku vypít nebo v případě špatně vypočtené dávky vzhledem k věku. V tomto případě je vysoké riziko prohloubení malnutrice a porušení režimu EEV tím, že dítě přijímá kromě EEV i běžnou stravu (tab. 2, obr. 1).
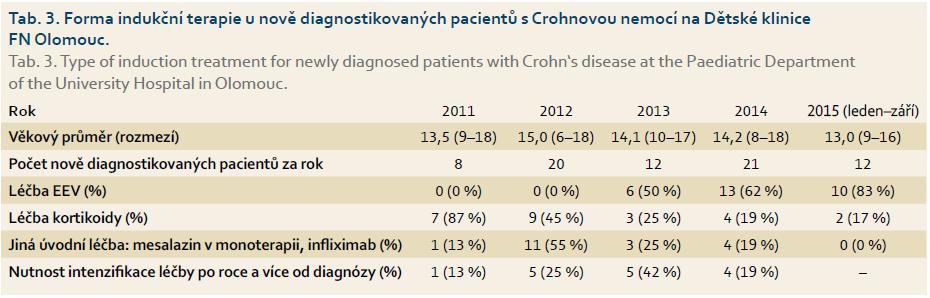
V souladu s doporučeními pro léčbu pediatrické CN i na našem pracovišti stoupl za posledních několik let počet dětí léčených EEV (tab. 3). Zatímco v roce 2011 jsme u většiny dětí s CN zahajovali indukční terapii kortikoidy, v roce 2014 bylo léčeno pomocí EEV 61 % a v letošním roce (do září 2015) 83 % pacientů. Kortikoidy jsme podali v případě extraintestinální manifestace onemocnění, při selhání EEV po dvou týdnech léčby nebo v případě odmítnutí EEV pacientem. V některých případech byla využita k indukční léčbě BL nebo mesalazin.
Závěr
EEV je lékem první volby indukční terapie u nově diagnostikované CN u dětí. Tato léčba má v pediatrii přednost před léčbou kortikoidy. EEV lépe indukuje endoskopickou remisi CN, zlepšuje parametry růstu, nutrice a kostního metabolizmu. Je většinou dobře tolerovaná a při správném podání má minimum komplikací a nežádoucích účinků. Po indukční léčbě vyžaduje většina dětí dlouhodobou udržovací terapii imunomodulátory (azatioprin, 6-merkaptopurin, metotrexát) a v indikovaných případech pak BL (infliximab, adalimumab). I přes dostupná data o prospěchu EEV při léčbě CN u dětí bude třeba dalších studií k ověření dlouhodobé efektivity, porovnání podání EEV v monoterapii a v kombinaci s jinými léčivy (mesalazin, kortikoidy, BL), typu navazující terapie atd.
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno/Submitted: 21. 10. 2015
Přijato/Accepted: 6. 11. 2015
MUDr. Eva Karásková
Dětská klinika
LF UP a FN Olomouc
I. P. Pavlova 6
779 00 Olomouc
eva.karaskova@fnol.cz

Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Ruemmele FM, Veres G, Kolho KL et al. Consensus guidelines of ECCO/ESPGHAN on the medical management of pediatric Crohn’s disease. J Crohns Colitis 2014; 8 (10): 1179–1207. doi: 10.1016/j.crohns.2014.04.005.
2. Bousvaros A. Use of immunomodulators and biologic therapies in children with inflammatory bowel disease. Expert Rev Clin Immunol 2010; 6 (4): 659–666. doi: 10.1586/eci.10.46.
3. Pigneur B, Seksik P, Viola S et al. Natural history of Crohn’s disease: comparison between childhood- and adult-onset disease. Inflamm Bowel Dis 2010; 16 (6): 953–961. doi: 10.1002/ibd.21152.
4. Navas-López VM, Blasco-Alonso J, Lacasa Maseri S et al. Exclusive enteral nutrition continues to be first line therapy for pediatric Crohn’s disease in the era of biologics. An Pediatr (Barc) 2015; 83 (1): 47–54. doi: 10.1016/j.anpedi.2014.02. 027.
5. Zachos M, Tondeur M, Griffiths AM. Enteral nutritional therapy for induction of remission in Crohn’s disease. Cochrane Database Syst Rev 2007; 1: CD000 542.
6. Kansal S, Wagner J, Kirkwood CD et al. Enteral nutrition in Crohn’s disease: an underused therapy. Gastroenterol Res Pract 2013; 2013: 482108. doi: 10.1155/ 2013/482108.
7. Cameron FL, Gerasimidis K, Papangelou A et al. Clinical progress in the two years following a course of exclusive enteral nutrition in 109 paediatric patients with Crohn’s disease. Aliment Pharmacol Ther 2013; 37 (6): 622–629. doi: 10.1111/apt.12 230.
8. Soo J, Malik BA, Turner JM et al. Use of exclusive enteral nutrition is just as effective as corticosteroids in newly diagnosed pediatric Crohn’s disease. Dig Dis Sci 2013; 58 (12): 3584–3591. doi: 10.1007/ s10620-013-2855-y.
9. Sanderson IR, Udeen S, Davies PS et al. Remission induced by an elemental diet in small bowel Crohn’s disease. Arch Dis Child 1987; 62 (2): 123–127.
10. González-Huix F, de León R, Fernández-Bañares F et al. Polymeric enteral diets as primary treatment of active Crohn’s disease: a prospective steroid controlled trial. Gut 1993; 34 (6): 778–782.
11. Kaakoush NO, Day AS, Leach ST et al. Effect of exclusive enteral nutrition on the microbiota of children with newly diagnosed Crohn’s disease. Clin Transl Gastroenterol 2015; 6: e71. doi: 10.1038/ ctg.2014.21.
12. Lee D, Albenberg L, Compher C et al. Diet in the pathogenesis and treatment of inflammatory bowel diseases. Gastroenterology 2015; 148 (6): 1087–1106. doi: 10.1053/j.gastro.2015.01.007.
13. Ruuska T, Savilahti E, Mäki M et al. Exclusive whole protein enteral diet versus prednisolone in the treatment of acute Crohn’s disease in children. J Pediatr Gastroenterol Nutr 1994; 19 (2): 175–180.
14. Borrelli O, Cordischi L, Cirulli M et al. Polymeric diet alone versus corticosteroids in the treatment of active pediatric Crohn’s disease: a randomized controlled open-label trial. Clin Gastroenterol Hepatol 2006; 4 (6): 744–753.
15. Lee D, Baldassano RN, Otley AR el al. Comparative Effectiveness of Nutritional and Biological Therapy in North Ame- rican Children with Active Crohn’s Dis- ease. Inflamm Bowel Dis 2015; 21 (8): 1786–1793. doi: 10.1097/MIB.0000000000 000426.
16. Ludvigsson JF, Krantz M, Bodin L et al. Elemental versus polymeric enteral nutrition in paediatric Crohn’s disease: a multicentre randomized controlled trial. Acta Paediatr 2004; 93 (3): 327–335.
17. Adamcová M, Bajer M, Bajerová K et al. Doporučení Pracovní skupiny dětské gastroenterologie a výživy ČPS pro diagnostiku a léčbu nespecifických střevních zánětů u dětí. Čes Slov Pediat 2012; 67 (Suppl 2): 4–48.
18. Esaki M, Matsumoto T, Nakamura S et al. Factors affecting recurrence in patients with Crohn’s disease under nutritional therapy. Dis Colon Rectum 2006; 49 (Suppl 10): S68–S74.
19. Karásková E, Vydra D, Smolka V et al. Refeeding syndrom v dětském věku. Čes-slov Pediat 2014; 69 (6): 363–369.