Endoskopický management dehiscence a refrakterní stenózy gastroezofageální anastomózy po robotické Ivor Lewisově operaci pro adenokarcinom jícnu
Kateřina Košťálová Orcid.org 1, Ján Csomor1, Zuzana Vacková1, Radek Pohnán Orcid.org 2, Petr Urbánek Orcid.org 1, Štěpán Suchánek1
+ Pracoviště
Souhrn
Úvod: Dehiscence gastroezofageální anastomózy po ezofagektomii představuje závažnou a život ohrožující komplikaci. Endoskopická vakuová terapie (EVT) se v poslední dekádě stala preferovanou miniinvazivní léčebnou metodou. Ani po jejím úspěšném použití však není vyloučeno riziko rozvoje benigní stenózy, která může být v některých případech refrakterní na dilatační léčbu. Popis případu: Prezentujeme případ 75leté pacientky po roboticky asistované Ivor Lewisově ezofagektomii pro adenokarcinom jícnu, u níž došlo k rozsáhlé dehiscenci anastomózy s únikem obsahu do pleurální dutiny. Komplikace byla úspěšně zvládnuta pomocí EVT. V následném průběhu se rozvinula refrakterní stenóza nereagující na opakované balonové dilatace, kterou se podařilo efektivně vyřešit zavedením lumen apozičního metalického stentu (LAMS). Závěr: Kazuistika ilustruje úspěšné využití moderních endoskopických postupů, konkrétně EVT a stentáže pomocí LAMS, v léčbě závažných komplikací po ezofagektomii. Klíčová byla těsná mezioborová spolupráce. Endoskopický přístup umožnil zhojení defektu bez chirurgické reintervence a efektivní řešení refrakterní stenózy s minimální zátěží pro pacientku.
Klíčová slova
endoskopická vakuová terapie, lumen apoziční metalický stent, refrakterní stenóza, ezofagektomie, dehiscence anastomózy, miniinvazivní endoskopie, karcinom jícnu
Úvod
Chirurgická resekce jícnu představuje základní terapeutický přístup u pacientů s lokálně pokročilým karcinomem jícnu a gastroezofageální junkce. Navzdory pokroku v oblasti perioperační péče a zavedení laparoskopických a roboticky asistovaných technik zůstává ezofagektomie výkonem s vysokou morbiditou. Jednou z nejzávažnějších komplikací je anastomotická dehiscence, jejíž incidence se udává v rozmezí 5–20 % a která je spojena s rizikem mediastinitidy, sepse, multiorgánového selhání a s významnou letalitou [1].
V posledních letech se léčba dehiscencí gastroezofageálních anastomóz (GEA) posunula od tradičních chirurgických reintervencí k miniinvazivním endoskopickým metodám, které nabízejí při zachování účinnosti nižší zátěž a lepší toleranci u křehkých pacientů. Endoskopická vakuová terapie (EVT) využívající negativní tlak k aktivní drenáži rány, zlepšení perfuze a stimulaci tvorby granulační tkáně se stala široce akceptovanou alternativou. Původně byla vyvinuta pro léčbu defektů rekta, ale od roku 2008 je úspěšně využívána také u transmurálních defektů stěny jícnu. EVT může být realizována pomocí otevřeného systému s polyuretanovou houbičkou (EsoSPONGE) nebo formou tzv. vakuového stentu (VacStent), který kombinuje vlastnosti samoexpandibilního metalického stentu a drenážního systému. Kohortové studie a metaanalýzy potvrzují vysokou míru klinické úspěšnosti EVT (až 85–90 %) a nižší letalitu oproti chirurgickému přístupu [2–5]. První české zkušenosti, publikované v roce 2024 na základě retrospektivního souboru pacientů léčených pomocí EVT, potvrdily účinnost této metody napříč různými indikacemi a zdůraznily význam multidisciplinární spolupráce [6].
Po ezofagektomii se může rozvinout stenóza v oblasti anastomózy, jejíž riziko se výrazně zvyšuje, pokud hojení komplikuje dehiscence s leakem [7–9]. Většina striktur dobře reaguje na opakované balonové dilatace, avšak přibližně 10 % případů se stává refrakterními [10,11]. V takových situacích je nutné zvažovat další terapeutické možnosti, mezi něž patří intralezionální injekce kortikosteroidů, strikturotomie či dočasná stentáž.
Stále větší pozornost přitahují lumen apoziční metalické stenty (LAMS), původně vyvinuté pro drenáž pankreatických kolekcí. Díky své konstrukci s krátkým tělem a fixačními lemy snižují riziko migrace a umožňují efektivní dilataci striktur. Recentní data ukazují jejich úspěšnost i v léčbě benigních striktur gastrointestinálního traktu [12].
Cílem této kazuistiky je první česká publikace případu úspěšné kombinace EVT a následné léčby refrakterní stenózy GEA pomocí LAMS u pacientky po roboticky asistované Ivor Lewisově ezofagektomii pro adenokarcinom jícnu.
Prezentace případu
Pacientka (75 let) byla na podzim 2023 vyšetřena na extramurálním pracovišti pro dysfagické obtíže a hmotnostní úbytek. Histologicky byl potvrzen adenokarcinom distálního jícnu a na stagingovém CT a PET/CT vyšetření byl popsán nález jako cT3N1M0, bez známek vzdálené diseminace, tumor se nacházel v těsném kontaktu s levou srdeční síní, avšak bez známek infiltrace okolních struktur. Na základě rozhodnutí multidisciplinárního týmu v ÚVN Praha byla pacientka indikována k neoadjuvantní chemoterapii režimem FLOT, kterou absolvovala v plném rozsahu (4 cykly do 18. 10. 2024). Po jejím dokončení byla odeslána na naše pracoviště k operačnímu řešení. Na Oddělení gastrointestinální endoskopie ÚVN Praha byla provedena vstupní restagingová endoskopie horní části trávicího traktu s nálezem exofyticky rostoucího, exulcerovaného, místy cirkulárního tumoru v rozsahu 29–35 cm od řezáků, s ulceracemi v terénu suspektního Barrettova jícnu.
Dne 20. 11. 2024 byla pacientka operována na Chirurgické klinice 2. LF UK a ÚVN Praha, kde podstoupila roboticky asistovanou resekci jícnu dle Ivor Lewise (torakoabdominální přístup s intratorakální gastroezofageální anastomózou) s náhradou jícnu tubulizovaným žaludkem. První pooperační dny probíhaly nekomplikovaně, s časnou extubací a mobilizací pacientky. Histologické vyšetření potvrdilo nízce diferencovaný mucinózní adenokarcinom (G3) vzniklý v terénu Barrettova jícnu ve stadiu ypT3N1 (1/21 uzlin). Osmý pooperační den se klinicky projevila dehiscence GEA vzestupem teploty, zvýšenými zánětlivými parametry a změnami v sekreci z hrudních drénů. Na CT vyšetření s pasáží jícnem byl popsán defekt anastomózy s extraluminací kontrastní látky do pravostranné pohrudniční dutiny, mediastina i intraperitoneálně. Komplikace byla doprovázena pneumomediastinem, pneumoperitoneem a fluidothoraxem oboustranně.
Devátý pooperační den byla na našem endoskopickém pracovišti zahájena EVT pomocí systému EsoSPONGE (Boston Scientific) s kontinuálním podtlakem –125 mmHg. Při endoskopii byl prokázán rozsáhlý defekt v oblasti 23–24 cm od řezáků se vstupem do mediastinální kavity (obr. 1a). V průběhu prosince 2024 bylo provedeno celkem sedm výměn EsoSPONGE vždy à 3–4 dny (obr. 1b–c), zpočátku se zavedením dvou houbiček do oddělených kavit. Při každé výměně probíhala mezioborová konzultace endoskopisty a chirurga přímo nad pacientkou, nálezy byly společně diskutovány a strategie léčby koordinována. Součástí péče byla rovněž intenzivní podpora ze strany týmu KARIM ÚVN (Klinika anestezie, resuscitace a intenzivní medicíny 1. LF UK a ÚVN Praha), včetně řízení výživy pomocí nazojejunální sondy (NJS). Postupně docházelo k tvorbě granulační tkáně, zmenšení, a nakonec k úplnému uzávěru defektu (obr. 1d–e). Poslední endoskopie dne 27. 12. 2024 dokumentovala zhojenou dehiscenci, bez nutnosti opětovného zavedení systému EsoSPONGE. (obr. 1f).
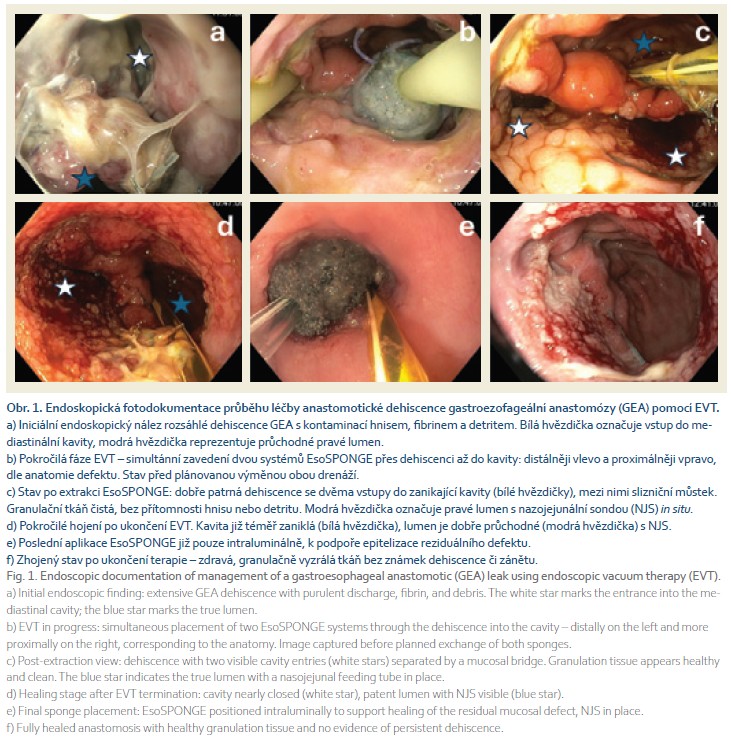
V lednu 2025 (jen 4 týdny po zhojení) se rozvinula progredující dysfagie, endoskopicky byla prokázána těsná stenóza benigního charakteru v oblasti zhojené GEA o průměru 4–5 mm (obr. 2a). Od února do května 2025 bylo provedeno pět etap balonových dilatací v přibližně 2–4týdenních intervalech, přičemž maximální dosažený průměr byl 15 mm (obr. 2b). Po páté dilataci se však potvrdila refrakterní povaha stenózy, neboť došlo k recidivě zúžení s návratem kompletní afagie a nutností opětovného zavedení NJS (obr. 2c). Z důvodu refrakterního průběhu stenózy anastomózy, nedostatečné odpovědi na opakované dilatace a při negativním onkologickém restagingu (PET/CT vyšetření z května 2025 neprokázalo recidivu ani metastázy) jsme přistoupili k pokročilému endoskopickému řešení. Vzhledem ke krátké délce stenózy, nižší pravděpodobnosti migrace a narůstajícím datům potvrzujícím efektivitu a bezpečnost LAMS v léčbě anastomotických striktur byl zvolen tento přístup.
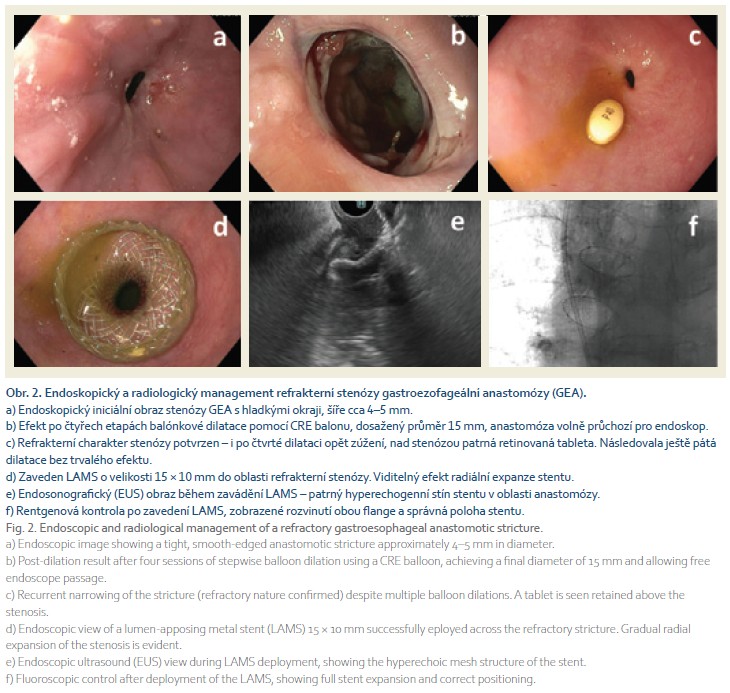
Dne 13. 5. 2025 byl pod endosonografickou a endoskopickou kontrolou zaveden LAMS (Hot Axios, Boston Scientific) o velikosti 15 × 10 mm do oblasti stenózy GEA (obr. 2d–e). Výkon proběhl bez komplikací, pozice stentu byla ověřena fluoroskopicky (obr. 2f). Pacientka již od následujícího dne tolerovala perorální příjem a byla dimitována v dobrém stavu. Aktuálně je pacientka přibližně 7–8 týdnů po zavedení stentu a je bez známek restenózy či jiných komplikací.
Chronologický přehled klinického průběhu a endoskopických intervencí je uveden v tab. 1.

Diskuze
Tato kazuistika ukazuje úspěšný, ryze endoskopický management dvou závažných komplikací po ezofagektomii – dehiscence GEA a následné refrakterní stenózy – s využitím EVT a implantace LAMS. Případ dokládá, že miniinvazivní metody mohou v individuálně zvolených indikacích představovat bezpečnou a účinnou alternativu k chirurgickým postupům, a to i u rozsáhlých defektů nebo striktur, které nereagují na standardní terapii.
Dehiscence GEA je závažnou a potenciálně život ohrožující komplikací po ezofagektomii, s letalitou dosahující až 35 %, zejména při opožděné diagnóze nebo nedostatečné kontrole infekčního ložiska [13]. Tradiční přístup zahrnoval konzervativní terapii (často stentáž) nebo chirurgickou reintervenci, která je však zatížena vysokou morbiditou, zejména u kriticky nemocných pacientů. V posledním desetiletí se prosadila EVT jako miniinvazivní a vysoce efektivní alternativa umožňující drenáž a podporu granulačního hojení. Systémy jako EsoSPONGE lze zavádět jak intraluminálně, tak intrakavitárně, s možností pravidelné endoskopické kontroly [6]. Metaanalýza Vohra et al. [14] prokázala celkovou klinickou úspěšnost EVT u 88 % pacientů srovnatelnou jak u pooperačních anastomotických leaků (86,6 %), tak u spontánních perforací jícnu (88,9 %), při nízké letalitě 4,2 %. Dvě další systematické metaanalýzy ukázaly, že EVT má oproti plně potaženým samoexpandibilním kovovým stentům (SEMS) vyšší míru uzávěru defektu (OR 2,47–2,58), kratší dobu léčby (−9 až −11 dní) a nižší výskyt striktur (OR 0,22) i letality [15,16]. V onkologické podskupině sice nebyl potvrzen statisticky významný rozdíl v účinnosti, přesto zůstává EVT preferovanou metodou zejména tam, kde je dostupná potřebná technická expertiza a mezioborová spolupráce. Naše předchozí analýza publikovaná v roce 2024 dokumentovala podobně vysokou úspěšnost EVT u různých etiologií jícnových defektů, včetně pooperačních leaků, a zdůraznila význam správného načasování výkonu a multidisciplinárního postupu [6]. I náš současný případ potvrzuje, že při včasném zahájení a vedení zkušeným týmem může EVT vést k úplnému uzávěru i rozsáhlé dehiscence bez nutnosti chirurgického zásahu.
U části pacientů po zvládnuté dehiscenci se následně rozvíjí benigní stenóza v oblasti anastomózy. Zatímco po nekomplikované ezofagektomii bývá výskyt anastomotické striktury udáván přibližně v rozmezí 10–20 %, při komplikovaném průběhu s dehiscencí riziko stoupá až na 42 % [9]. Standardní léčbou anastomotických stenóz bývá opakovaná endoskopická balonová dilatace (EBD), která ve většině případů vede k úlevě od obtíží. U části pacientů, zejména rizikových, však nedochází k trvalému efektu. Refrakterní striktura je definována jako přetrvávající dysfagie navzdory ≥ 5 dilatacím na průměr ≥ 14 mm během 6 měsíců, zatímco rekurentní striktura označuje recidivu po předchozí úspěšné léčbě [17]. Naše pacientka splnila kritéria refrakterní striktury, když i přes pět dilatací došlo k opakované recidivě stenózy a návratu afagie, což vedlo k nutnosti znovuzavedení enterální výživy. Předchozí dehiscence anastomózy je významným rizikovým faktorem refrakterního průběhu. Ve studii Vermeulen et al. pacienti s prodělanou dehiscencí vyžadovali více dilatací (6,1 vs. 4,7; HR = 1,3; p = 0,037). Dalšími rizikovými faktory byly kardiovaskulární onemocnění (HR = 1,5; p = 0,002) a časné zahájení ED do 90 dnů po operaci (HR = 1,8; p < 0,001), zatímco lokalizace anastomózy a vstupní průměr stenózy významně asociovány nebyly [11]. Tyto poznatky zdůrazňují potřebu včas zvážit doplňkové či alternativní metody u rizikových pacientů s nedostatečnou odpovědí na EBD.
Vzhledem k selhání opakovaných balonových dilatací jsme u naší pacientky zvolili jako záchrannou strategii implantaci LAMS. Tyto stenty byly původně vyvinuty pro EUS-řízenou transluminální drenáž pankreatických kolekcí [18,19]. Jejich konstrukce zahrnuje krátké sedlové tělo se dvěma širokými kotvícími disky, které minimalizují riziko migrace. Postupně našly využití i při drenážích žlučových cest či žlučníku u inoperabilních pacientů nebo v léčbě maligních obstrukcí výtokové části žaludku [20,21]. Právě díky nízké migraci, variabilním rozměrům a snadné extrakci se LAMS stále častěji využívají off-label k léčbě benigních striktur GIT, zejména refrakterních anastomotických stenóz. Výhodou je relativně jednoduché zavedení s vysokou technickou úspěšností, dilatační efekt vyplývající z postupně narůstající radiální síly při plném rozvinutí stentu a také skutečnost, že na rozdíl od dlouhých SEMS jsou LAMS vhodné pro krátké, prstencovité anastomotické striktury [12]. Jejich účinnost v léčbě benigních striktur shrnuje metaanalýza Giri et al. zahrnující 18 studií (z toho dvě prospektivní), s podílem anastomotických stenóz mezi 40 a 100 %. Technická úspěšnost dosahovala 99,9 %, krátkodobá klinická úspěšnost (při ponechání stentu) 94,6 % a dlouhodobá klinická úspěšnost (po extrakci bez nutnosti dalších intervencí) 76,9 %. Nežádoucí účinky se objevily u 13,5 % pacientů, nejčastěji bolest, krvácení, infekce či okluze stentu. Migrace byla zaznamenána u 10,6 % všech benigních striktur a 13,3 % striktur anastomotických [22]. Další metaanalýza porovnávající LAMS, plně potažené kovové stenty (FC SEMS) a biodegradabilní stenty (BDS) prokázala nejvyšší klinickou úspěšnost u LAMS (78,8 vs. 48,4 % u FC SEMS a 34,9 % u BDS) a zároveň nízkou míru migrace (13,7 vs. 31,5 % a 11,5 %). Rozdíly byly statisticky významné mezi LAMS a FC SEMS i mezi LAMS a BDS, zatímco mezi FC SEMS a BDS významný rozdíl prokázán nebyl. Přímé srovnání LAMS oproti standardní endoskopické dilataci však zatím chybí [12]. Ekonomický pohled přináší studie Hallac et al., která analyzovala nákladovou efektivitu LAMS oproti opakovaným dilatacím. Bod zvratu byl stanoven na 3,5 dilatace v celkové populaci a 2,2 dilatace u pacientů po resekčních výkonech, což naznačuje potenciální ekonomický přínos LAMS u refrakterních striktur vyžadujících vícečetné zákroky [23].
Implantace LAMS po páté neúspěšné dilataci vedla u naší pacientky k rychlé obnově perorálního příjmu bez komplikací. S ohledem na literární údaje a stabilizovaný klinický stav jsme se rozhodli ponechat stent zatím po dobu 2 měsíců (60 dní), což odpovídá dolní hranici doporučeného rozmezí, přičemž medián doby ponechání LAMS u benigních striktur se podle literatury pohybuje mezi 60 a 119 dny [22]. Aktuálně pacientka podstupuje lázeňskou rehabilitaci, toleruje běžnou stravu a je bez známek restenózy či jiných komplikací. Při plánované kontrolní endoskopii po 60 dnech bude stav zhodnocen a v případě příznivého nálezu může být zváženo prodloužení stentáže až na 90 dní.
Tato kazuistika dle našich vědomostí poprvé v české literatuře dokumentuje úspěšnou kombinaci EVT a následné léčby refrakterní benigní stenózy GEA pomocí LAMS stentu u pacientky po roboticky asistované Ivor Lewisově ezofagektomii. Ukazuje, že moderní endoskopické metody mohou být bezpečnou a účinnou alternativou k chirurgickým postupům i u komplikovaných stavů, pokud jsou indikovány individuálně a v prostředí multidisciplinární spolupráce. EVT by měla být vždy zvažována jako metoda první volby u dobře přístupných anastomotických dehiscencí, zatímco u refrakterních striktur nereagujících na standardní dilatace může LAMS představovat perspektivní možnost.
Závěr
Prezentovaná kazuistika dokládá, že moderní miniinvazivní endoskopické metody, jako jsou EVT a zavedení LAMS, mohou být účinnou alternativou k chirurgické léčbě závažných komplikací po ezofagektomii. Úspěšné zvládnutí dehiscence GEA i následné refrakterní stenózy v našem případě potvrzuje význam multidisciplinární spolupráce a individualizovaného přístupu k pacientovi. Sdílení podobných zkušeností a sledování dlouhodobých výsledků může přispět k dalšímu rozvoji a optimalizaci péče o pacienty s těmito komplikacemi.
ORCID autorů
K. Košťálová 0000-0003-2505-9239,
J. Csomor 0000-0002-8121-1170,
Z. Vacková 0000-0002-0443-5752,
R. Pohnán 0000-0002-1003-4883,
P. Urbánek 0000-0002-1506-1135,
Š. Suchánek 0000-0003-3659-0252.
Doručeno/Submitted: 13. 7. 2025
Přijato/Accepted: 28. 8. 2025
Korespondenční autorka
pplk. MUDr. Kateřina Košťálová
Oddělení gastrointestinální endoskopie
Interní klinika
1. LF UK a ÚVN – VFN
U Vojenské nemocnice 1200/1
162 09 Praha 6
katerina.kostalova@uvn.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Fabbi M, Hagens ER, van Berge Henegouwen MI et al. Anastomotic leakage after esophagectomy for esophageal cancer: definitions, diag- nostics, and treatment. Dis Esophagus 2021; 34(1): doaa039. doi: 10.1093/dote/doaa039.
2. Jung DH, Yun HR, Lee SJ et al. Endoscopic vacuum therapy in patients with transmural defects of the upper gastrointestinal tract: a systematic review with meta-analysis. J Clin Med 2021; 10(11): 2346. doi: 10.3390/jcm10112346.
3. Aziz M, Haghbin H, Sharma S et al. Safety and effectiveness of endoluminal vacuum-assisted closure for esophageal defects: systematic review and meta-analysis. Endosc Int Open 2021; 9(9): E1371–E1380. doi: 10.1055/a-1508-5947.
4. Richter F, Hendricks A, Schniewind B et al. Eso-Sponge® for anastomotic leakage after oesophageal resection or perforation: outcomes from a national, prospective multicentre registry. BJS Open 2022; 6(2): zrac030. doi: 10.1093/bjsopen/zrac030.
5. Luttikhold J, Pattynama LM, Seewald S et al. Endoscopic vacuum therapy for esophageal perforation: a multicenter retrospective cohort study. Endoscopy 2023; 55 (9): 859–864. doi: 10.1055/a-2042-6707.
6. Košťálová K, Vacková Z, Pohnán R et al. Endoscopic vacuum therapy in esophageal defects treatment – our first experience. Gastroent Hepatol 2024; 78(4): 306–313. doi: 10.48095/ccgh2024306.
7. Na B, Kang CH, Na KJ et al. Risk factors of anastomosis stricture after esophagectomy and the impact of anastomosis technique. Ann Thor Surg 2023; 115(5): 1257–1264. doi: 10.1016/ j.athoracsur.2023.01.026.
8. Koshy RM, Brown JM, Chmelo J et al. Anastomotic stricture after Ivor Lewis esophagectomy: an evaluation of incidence, risk factors, and treatment. Surgery 2022; 171(2): 393–398. doi: 10.1016/j.surg.2021.07.034.
9. Zhong Y, Sun R, Li W et al. Risk factors for esophageal anastomotic stricture after esophagectomy: a meta-analysis. BMC Cancer 2024; 24(1): 872. doi: 10.1186/s12885-024-12625-8.
10. Mendelson AH, Small AJ, Agarwalla A et al. Esophageal anastomotic strictures: outcomes of endoscopic dilation, risk of recurrence and refractory stenosis, and effect of foreign body removal. Clin Gastroenterol Hepatol 2015; 13(2): 263–271. doi: 10.1016/j.cgh.2014.07.010.
11. Vermeulen BD, de Zwart M, Sijben J et al. Risk factors and clinical outcomes of endoscopic dilation in benign esophageal strictures: a long-term follow-up study. Gastrointest Endosc 2020; 91(5): 1058–1066. doi: 10.1016/ j.gie.2019.12.040.
12. Mohan BP, Chandan S, Garg R et al. Lumen-apposing metal stents, fully covered self-expanding metal stents, and biodegradable stents in the management of benign of GI strictures: a systematic review and meta-analysis. J Clin Gastroenterol 2019; 53(8): 560–573. doi: 10.1097/MCG.0000000000001228.
13. Kassis ES, Kosinski AS, Ross P et al. Predictors of anastomotic leak after esophagectomy: an analysis of the society of thoracic surgeons general thoracic database. Ann Thor Surg 2013; 96(6): 1919–1926. doi: 10.1016/j.athoracsur. 2013.07.119.
14. Vohra I, Gopakumar H, Sharma NR et al. Efficacy of endoscopic vacuum therapy in esophageal luminal defects: a systematic review and meta-analysis. Clin Endosc 2025; 58(1): 53–62. doi: 10.5946/ce.2023.282.
15. Scognamiglio P, Reeh M, Melling N et al. Management of intra-thoracic anastomotic leakages after esophagectomy: updated systematic review and meta-analysis of endoscopic vacuum therapy versus stenting. BMC Surg 2022; 22(1): 309. doi: 10.1186/s12893-022-01764-z.
16. Mandarino FV, Barchi A, D’Amico F et al. Endoscopic vacuum therapy (EVT) versus self-expandable metal stent (SEMS) for anastomotic leaks after upper gastrointestinal surgery: systematic review and meta-analysis. Life 2023; 13(2): 287. doi: 10.3390/life13020287.
17. Dell’Anna G, Fanizza J, Mandarino FV et al. The endoscopic management of anastomotic strictures after esophagogastric surgery: a comprehensive review of emerging approaches beyond endoscopic dilation. J Pers Med 2025; 15(3): 111. doi: 10.3390/jpm15030111.
18. Vanella G, Dell’Anna G, Arcidiacono PG. Plastic versus metal EUS-guided drainage of pancreatic fluid collections: do we really know when to use the hard way? Clin Gastroenterol Hepatol 2022; 20(6): e1507–e1508. doi: 10.1016/ j.cgh.2021.07.002.
19. Kumar VC, Singh S, Moond V et al. Safety and efficacy of lumen-apposing metal stents for endoscopic ultrasound-guided drainage of pancreatic fluid collections: a systematic review and meta-analysis. Endoscopy 2025; 57(3): 282–290. doi: 10.1055/a-2461-3773.
20. Vanella G, Dell’Anna G, Arcidiacono PG. EUS-directed transenteric ERCP with giant intrahepatic stone lithotripsy after a LAMS-in-LAMS rescue in response to a misdeployment. VideoGIE 2024; 9(3): 150–153. doi: 10.1016/j.vgie.2023.10.008.
21. Vanella G, Dell’Anna G, Bronswijk M et al. Endoscopic ultrasound-guided biliary drainage and gastrointestinal anastomoses: the journey from promising innovations to standard of care. Ann Gastroenterol 2022; 35(5): 441–451. doi: 10.20524/aog.2022.0736.
22. Giri S, Vaidya A, Kale A et al. Efficacy of lumen-apposing metal stents for the management of benign gastrointestinal stricture: a systematic review and meta-analysis. Ann Gastroenterol 2023; 36(5): 524–532. doi: 10.20524/aog.2023.0819.
23. Hallac A, Srikureja W, Liu E et al. Economical effect of lumen apposing metal stents for treating benign foregut strictures. World J Gastrointest Endosc 2018; 10(10): 294–300. doi: 10.4253/wjge.v10.i10.294.