Stereotaktická radioterapie v léčbě hepatocelulárního karcinomu
Petr Hříbek1, Ferdinand Třebický2, Petr Urbánek1
+ Pracoviště
Souhrn
Hepatocelulární karcinom (HCC) je jednou z nejzávažnějších komplikací jaterní cirhózy. Přestože včasné stanovení diagnózy umožňuje použití kurativních přístupů, mnoho pacientů není kandidáty chirurgické léčby. V takových případech nabývají na významu alternativní metody lokoregionální terapie. Stereotaktická radioterapie (SBRT) je specifická forma externí radioterapie, která umožňuje vysoce přesné ozáření cílového ložiska s minimálním zásahem do okolní tkáně a vykazuje vysokou míru lokální kontroly onemocnění. Aktuální doporučené postupy EASL z roku 2025 již SBRT zařazují mezi uznávané terapeutické možnosti pro vybrané skupiny pacientů, zejména tam, kde nelze použít ablační techniky ani TACE. Klinické zkušenosti z našeho pracoviště potvrzují dobrou snášenlivost SBRT a její vhodnost v rámci konsolidační léčby. Přestože zůstává vysoce selektivní metodou s omezenou dostupností, představuje SBRT cenný doplněk stávajících terapeutických modalit a její význam v léčbě HCC bude pravděpodobně narůstat.
Klíčová slova
hepatocelulární karcinom, jaterní cirhóza, radiochirurgie, stereotaktická radioterapie
Úvod
Hepatocelulární karcinom (HCC) představuje jednu z nejčastějších fatálních komplikací chronických jaterních onemocnění, nejčastěji ve stadiu pokročilé jaterní fibrózy až cirhózy. Dlouhodobě se HCC v celosvětovém měřítku pohybuje na předních příčkách v příčinách úmrtí na nádorové onemocnění. V České republice byla v roce 2021 incidence HCC 9,41 nových případů na 100 tisíc obyvatel [1]. Staging onemocnění se řídí u nemocných s jaterní cirhózou tzv. Barcelona Clinic Liver Cancer klasifikací (BCLC), která rozlišuje stadia [2]:
- velmi časné a časné;
- středně pokročilé;
- pokročilé;
- terminální.
Klasifikace BCLC je specifická tím, že v sobě zahrnuje i zhodnocení funkční zdatnosti jater, která může nezřídka limitovat přežití pacienta více než samotné nádorové onemocnění. HCC je malignita s vysoce nepříznivou prognózou. V případě nemocných s jaterní cirhózou a HCC je medián celkového přežití (OS) u neléčených pacientů u časného stadia 13,4 měsíce, zatímco ve stadiu terminálním 1,6 měsíce [3]. Jedině včasné stanovení diagnózy může zajistit nemocnému naději na terapii potenciálně kurativními metodami. V takovém případě pak bývá prognóza velmi dobrá. Pacienti, u nichž jsou splněna standardní kritéria pro transplantační léčbu, mají 10leté celkové přežití 64–70 % [4]. Nespornou výhodou transplantační léčby je současné řešení častého základního onemocnění – jaterní cirhózy. V případě, že se HCC rozvinul v necirhotických játrech, je metodou volby nadále jaterní resekce [5]. V případě, že pacient není vhodným kandidátem pro chirurgickou léčbu, ale nádor není velký, je možné zvažovat i lokální ablační metody, např. radiofrekvenční ablaci (RFA). Tyto metody léčby jsou u nejmenších ložisek HCC do velikosti 2 cm dokonce srovnatelné co do efektivity s chirurgickou léčbou [5]. U pokročilejších stadií HCC v terénu jaterní cirhózy je možnost použití lokoregionální terapie ve formě transarteriální chemoembolizace (TACE) a z ní odvozených variant. TACE je však zpravidla považována za metodu, která má i přes významné prodloužení OS paliativní charakter. Na našem pracovišti je u pacientů léčených TACE medián OS 24 měsíců ve středně pokročilém stadiu HCC [6]. To představuje 2,5násobné prodloužení mediánu přežití ve srovnání s neléčeným onemocněním, které činí 9,5 měsíce [3]. V reálném životě existuje řada situací, které neumožňují u konkrétního pacienta s časnými stadii HCC standardní léčbu s kurativním záměrem. V takovém případě se řídíme tzv. step down přístupem a nemocní bývají indikováni často k různým kombinacím lokoregionálních destrukčních metod a systémové léčby. Mezi takové důvody patří nepříznivé uložení ložiska, komorbidity, ale v řadě případů třeba i odmítavý postoj pacienta k chirurgické léčbě. Ošetření takového pacienta TACE s ohledem na to, že je cíleno na menší a méně početná ložiska, vede ve větším počtu případů ke kompletní radiologické odpovědi, čemuž odpovídají i naše vlastní zkušenosti [7]. Metody externí radioterapie (EBRT – external beam radiotherapy) a jejich možnosti u HCC byly již v minulosti předmětem zkoumání, ale dlouho se jejich použití nedostalo do oficiálních léčebných doporučení.
Stereotaktická radioterapie
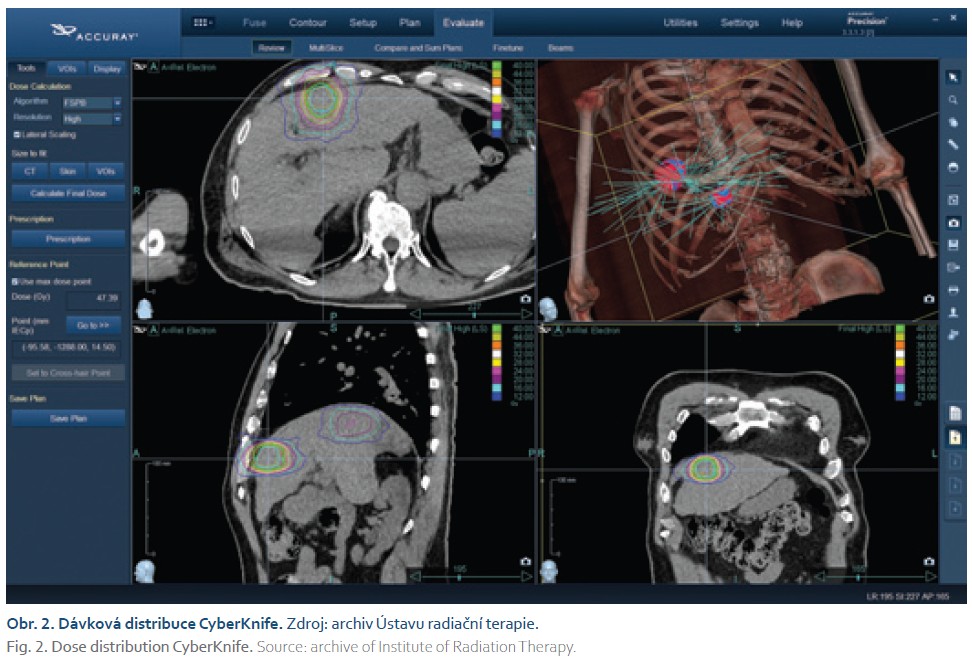
Stereotaktická radioterapie (SBRT – stereotactic body radiotherapy) je speciální druh EBRT. SBRT využívá aplikace vysoké kumulativní dávky ionizujícího záření v menším počtu frakcí s vysokou přesností. Vysoká přesnost podání dávky do cílového ložiska při šetření okolních tkání vedla i k zavedení termínu radiochirurgie. Významnou výhodou SBRT je její neinvazivní povaha, ačkoli je často nutné předchozí perkutánní zavedení markerů pro její navigaci. Množství dávky absorbované nádorovou buňkou jí prakticky nedovoluje základní principy radiobiologické odpovědi (tzv. 4R – repair of DNA damage, redistribution of cells in the cell cycle, repopulation, and reoxygenation of hypoxic tumor areas). Současně SBRT pracuje ještě s dalšími dvěma „R“ – navyšuje efekt pro projevy dávky na intrinsickou citlivost nádorové buňky (intrinsic radiosensitivity) a výše dávky na frakci ještě dovoluje obnovenou imunitní odpověď organizmu proti ošetřené nádorové buňce (reactivation of the anti-tumor immune response). SBRT tak pracuje s možností 6R radiobiologické odpovědi nádorové tkáně. SBRT dovoluje i velmi rychlý gradient dávky mimo cílový objem nádorového ložiska s podstatnou ochranou zdravé tkáně nebo orgánu, kde je dávka absorbovaná. Technika dodání dávky do nádorového ložiska prostřednictvím přístroje CyberKnife (obr. 1) dovoluje rozložení dávky přístupy izo- a nonizocentrického přístupu, kdy svazky mohou a nemusí směřovat do geometrického centra cílového objemu. Vedle toho CyberKnife umožňuje taktéž přístupy komplanarity a nonkomplanarity, to jest úhlu svazku nebo pozice stolu pacienta, který je mimo základní longitudinální osu pacienta a centrální parsek směřuje v jiném úhlu než v základní kolmé rovině na podélnou osu pacienta. Tato kombinace dovoluje vysokou homogenitu dávky, která prakticky lemuje ohraničení plánovacího cílového objemu. Stanovení nádorového objemu je dáno diagnostickými metodami – výpočetní tomografií (CT) s podáním kontrastní látky a někdy v kombinaci se zobrazením na magnetické rezonanci (MR). Pro plánování léčby je používána kombinace nativního 4D CT pro stanovení trasy pohybů nádorového objemu v závislosti na dechových pohybech bránice a MR zobrazení v T1 a T2 obraze v přirozeném výdechu a nádechu pacienta pro stanovení objemu nádorového ložiska v krajních polohách dechového rytmu pacienta, kdy může docházet i ke změnám objemu nádorového ložiska. SBRT CyberKnife užívá dynamického sledování nepřímo ionizujícího svazku do nádorového ložiska – trackingu. Pro tracking ložiska jsou užité denzní markery ze zlatého kovu o velikosti 3 mm, které jsou umístěny do maximální vzdálenosti 50 mm od nádorového ložiska. U některých lokalit (kraniálně uložená ložiska v jaterních segmentech S7, S8 nebo S2 a S4) je aplikace markeru vysoce riziková z poškození plicní tkáně, velkých cév, a proto je možné pro tracking užít vytvořenou strukturu kopule bránice a navigovat přesně pohyb ložiska dle jejich struktur. Všemi výše uvedenými přístupy lze docílit vysoké homogenity dávky a pokrytí ložiska dávkou 40 Gy v pěti frakcích, kdy referenční dávka má být v indexu proti objemu nádorového ložiska do maximálního poměru 1,2. Nádorová ložiska tak musí být do velikosti 50 mm. Bezprostředně před samotným dodáním nebo samotnou aplikací dávky musí proběhnout morfologická kontrola simulačního CT, kdy se srovnávají anatomické pozice nádorového ložiska a rizikových struktur (např. žaludek, srdce, aorta, dolní dutá žíla, ledviny). Dále je třeba zkontrolovat, zda toto srovnání odpovídá základnímu plánu léčby, anebo došlo k jejich změně s nutností změny plánu léčby tak, aby byly zachovány dávkové limity pro pokrytí ložiska a ošetření zdravých tkání a orgánů. Při stanovení plánu je nutné dále kontrolovat regionální spádové orgány a uzliny, což je zásadní zejména u pacientů s recidivujícím HCC po transplantaci jater, kdy první etáží generalizace bývají nadledviny nebo uzliny v peripankreatické oblasti. Kontrola aplikace dávky je prováděna dle rizikovosti pozic daných orgánů v intervalu 20–40 s v průběhu léčby. Podání dávky frakce probíhá v denním režimu a trvání jedné frakce je většinou do 30–40 min v poloze pacienta na zádech s ventrálním uložením paží a trackingem dle pravidelného dechu pacienta (obr. 2).
SBRT v léčbě HCC
Externí radioterapie není v léčbě HCC novinkou. Již v 80. letech minulého století byla používána spíše v paliativní léčbě ve formě ozáření celých jater ve spojení s konvenční chemoterapií. Pro nízký efekt a nežádoucí účinky se na dlouhou dobu radioterapie z problematiky HCC vytratila. Obávanou komplikací bylo ozářením indukované poškození jater. S rozvojem radiochirurgie došlo i k renesanci EBRT v léčbě HCC. Paradoxně rovnou ve formě významného skoku od čistě paliativní modality k metodě, která se používá s kurativním záměrem. Je zajímavé sledovat poměrně rychlý vývoj situace z pohledu doporučených postupů. Doporučené postupy Evropské společnosti pro studium jater (EASL – European Association for the Study of the Liver) z roku 2018 zmiňovaly, že EBRT je předmětem výzkumu v této oblasti, ale pro absenci dostatečné datové opory nebylo její použití v léčbě HCC rutinně doporučeno [8]. Již aktualizace BCLC klasifikace z roku 2022 vedla k posunu pozice radioterapie v konstatování, že SBRT přináší u HCC jistý léčebný účinek, ale k přesné definici její role v léčbě tohoto nádorového onemocnění je třeba více prospektivních studií [9]. V BCLC schématu tedy nebyla v terapeutických modalitách zahrnuta. Konečně zcela aktuální doporučené postupy EASL z počátku roku 2025 již konkrétně definují roli SBRT jako [5]:
- alternativu k lokálním ablačním metodám (v případě, že jich nelze využít) u pacientů, u kterých není možné chirurgická léčba;
- alternativu k TACE tam, kde lokální ablační metody nelze použít, anebo u postablačních recidiv, a to v případě, že TACE je z různých důvodů nevhodná.
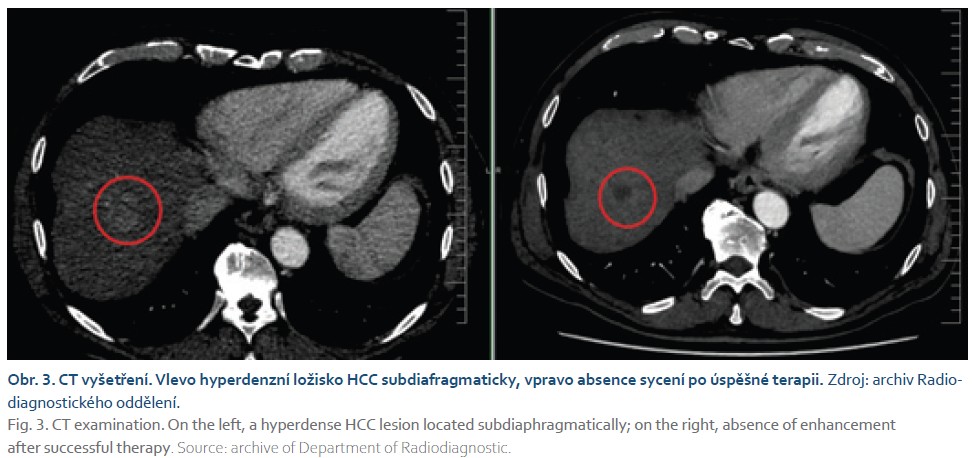
Skepsi k SBRT mohly vyvolávat údaje v některých studiích o nepřesvědčivém benefitu na prodloužení přežití nemocných. Nicméně studovanou populací v řadě těchto prací byli nemocní, kteří byli již předtím extenzivně léčeni standardními metodami, a pacienti v pokročilejších stadiích onemocnění [10–12]. V praktické rovině je SBRT metodou indikovanou jen u velmi selektované skupiny nemocných, ale vždy s cílem co nejradikálnějšího lokálního ošetření. Proti rutinnímu použití hovoří i technická náročnost metody a její cena. SBRT velmi vhodně doplňuje možnosti zavedených metod tím, že ji lze aplikovat velmi přesně i na místa, kam nelze bezpečně zavést ablační sondu (obr. 3). Účinek TACE je pak úměrný selektivitě podání terapeutické směsi do přívodné tepny nádoru, což v případě menších ložisek nemusí být vždy dobře možné. A právě v takových případech je SBRT vhodnou alternativou. Samozřejmé je, že každý případ musí být diskutován na multidisciplinárním semináři. Podmínkou pro správnou indikaci je však o možnostech SBRT vědět. Na SBRT by nemělo být pohlíženo jako na snad šetrnější alternativu k chirurgické léčbě – transplantaci jater a resekci. Na našem pracovišti jsme se založením Ústavu radiační terapie získali možnost využít SBRT, konkrétně přístroj CyberKnife, pro léčbu pacientů s HCC a v první polovině roku 2023 byl metodou ošetřen první pacient. Většina z osmi dosud léčených pacientů byla léčena v první fázi metodou TACE, se kterou máme dlouhodobé zkušenosti. SBRT byla využita jako jakási varianta konsolidační terapie u lézí, u nichž bychom při použití samotné TACE očekávali jen částečnou odpověď nebo lokální rekurenci. Jedinou možnou komplikací SBRT bylo v jednom případě zhoršení preexistující polyneuropatie u jednoho nemocného. Tento pacient však byl dlouhodobě léčen s duplicitním mnohočetným myelomem, se kterým byla polyneuropatie asociovaná. Jinak jsme nezaznamenali závažnou komplikaci léčby. Pět pacientů dosáhlo při prvním restagingu po 3 měsících kompletní radiologické odpovědi. S ohledem na to, že se jednalo o vysoce selektované případy, kdy SBRT byla indikována při nemožnosti použít standardní metody, byl soubor velmi heterogenní. V současné době tak neumožňuje bližší statistické zhodnocení. Otázka kombinace chemoembolizace se SBRT je diskutována právě i v recentně publikovaných EASL doporučeních, kde TACE není rutinně v kombinaci se SBRT doporučována. Ve zvláštních situacích, kdy je k ní pacient indikován, by měla TACE následovat po SBRT. Takovým příkladem vhodného užití kombinované léčby může být snaha o maximálně radikální ošetření pacientů s HCC komplikovaným nádorovou trombózou portální žíly [13]. Zdá se, že SBRT vykazuje ještě jednu zajímavou vlastnost ve srovnání s TACE. Lokální kontrola onemocnění je patrně u SBRT výrazně lepší než u TACE (ovšem bez vlivu na celkové přežití) [14,15]. V uvedené studii Sapira et al. byla lokální kontrola onemocnění 1 a 2 roky po SBRT 97 % a 91 % ve srovnání s 47 % a 23 % u TACE [14]. Z pohledu autorů se tím možná otevírá další zajímavá indikace, a tou je bridging terapie u pacientů na čekací listině k transplantaci jater. S nárůstem indikací k transplantaci jde bohužel ruku v ruce i prodlužování čekací doby a SBRT by pro některé pacienty mohla být vhodnou metodou v této indikaci.
Závěr
Stereotaktická radioterapie je již plně etablovanou metodou v léčbě hepatocelulárního karcinomu. Ačkoli je spektrum indikací úzké, velmi vhodně doplňuje stávající terapeutické modality. Mezi její hlavní výhody patří neinvazivní povaha, možnost zacílení kdekoli v parenchymu a vysoká lokální kontrola onemocnění. Limitací je vysoká technologická náročnost metody a její cena, které předurčují její použití jen do několika málo center. Do budoucna lze očekávat nárůst pacientů s HCC, kteří budou léčeni i SBRT.
ORCID autorů
P. Hříbek 0000-0002-8090-4389,
F. Třebický 0000-0003-0577-9845,
P. Urbánek 0000-0002-1506-1135.
Doručeno/Submitted: 26. 6. 2025
Přijato/Accepted: 5. 8. 2025
Korespondenční autor
MUDr. Petr Hříbek, Ph.D.
Interní klinika
1. LF UK a ÚVN – VFN
U Vojenské nemocnice 1200/1
169 02 Praha 6
petr.hribek@uvn.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Dušek L, Mužík J, Kubásek M et al. Epidemiologie zhoubných nádorů v České republice. 2012 [online]. Dostupné z: https: //portal.med.muni.cz/clanek-583-epidemiologie-zhoubnych-nadoru-v-ceske-republice.html.
2. Llovet JM, Bru C, Bruix J. Prognosis of hepatocellular carcinoma: the BCLC staging classification. Semin Liver Dis 1999; 19(3): 329–338. doi: 10.1055/s-2007-1007122.
3. Khalaf N, Ying J, Mittal S et al. Natural history of untreated hepatocellular carcinoma in a US cohort and the role of cancer surveillance. Clin Gastroenterol Hepatol 2017; 15(2): 273.e1–281.e1. doi: 10.1016/j.cgh.2016.07.033.
4. Ivanics T, Claasen M, Samstein B et al. Living donor liver transplantation for hepatocellular carcinoma within and outside traditional selection criteria: a multicentric North American experience. Ann Surg 2024; 279(1): 104–111. doi: 10.1097/SLA.0000000000006049.
5. European Association for the Study of the Liver. EASL Clinical Practice Guidelines on the management of hepatocellular carcinoma. J Hepatol 2025; 82(2): 315–374. doi: 10.1016/j.jhep.2024.08.028.
6. Hribek P, Klasova J, Tuma T et al. Etiopathogenetic factors of hepatocellular carcinoma, overall survival, and their evolution over time – Czech tertiary center overview. Medicina (Kaunas) 2022; 58(8): 1099. doi: 10.3390/medicina58081099.
7. Tůma T, Hříbek P, Koutný T et al. Mikrobalónová okluzivní chemoembolizace hepatocelulárního karcinomu – představení metody a první zkušenosti. Ces Radiol 2024; 78(4): 208–213. doi: 10.55095/CesRadiol2024.028.
8. European Association for the Study of the Liver. EASL Clinical Practice Guidelines: management of hepatocellular carcinoma. J Hepatol 2018; 69(1): 182–236. doi: 10.1016/ j.jhep.2018.03.019.
9. Reig M, Forner A, Rimola J et al. BCLC strategy for prognosis prediction and treatment recommendation: the 2022 update. J Hepatol 2022; 76(3): 681–693. doi: 10.1016/j.jhep.2021.11.018.
10. Kibe Y, Takeda A, Tsurugai Y et al. Local control by salvage stereotactic body radiotherapy for recurrent/residual hepatocellular carcinoma after other local therapies. Acta Oncol 2020; 59(8): 888–894. doi: 10.1080/0284186X.2020.1741679.
11. Buckstein M, Kim E, Fischman A et al. Stereotactic body radiation therapy following transarterial chemoembolization for unresectable hepatocellular carcinoma. J Gastrointest Oncol 2018; 9(4): 734–740. doi: 10.21037/jgo.2018.05.01.
12. Kang JK, Kim MS, Cho CK et al. Stereotactic body radiation therapy for inoperable hepatocellular carcinoma as a local salvage treatment after incomplete transarterial chemoembolization. Cancer 2012; 118(21): 5424–5431. doi: 10.1002/cncr.27533.
13. Guo L, Wei X, Feng S et al. Radiotherapy prior to or after transcatheter arterial chemoembolization for the treatment of hepatocellular carcinoma with portal vein tumor thrombus: a randomized controlled trial. Hepatol Int 2022; 16(6): 1368–1378. doi: 10.1007/s12072-022-10423-7.
14. Sapir E, Tao Y, Schipper MJ et al. Stereotactic body radiation therapy as an alternative to transarterial chemoembolization for hepatocellular carcinoma. Int J Radiat Oncol Biol Phys 2018; 100(1): 122–130. doi: 10.1016/j.ijrobp.2017.09.001.
15. Mendez Romero A, van der Holt B, Willemssen F et al. Transarterial chemoembolization with drug-eluting beads versus stereotactic body radiation therapy for hepatocellular carcinoma: outcomes from a multicenter, randomized, phase 2 trial (the TRENDY trial). Int J Radiat Oncol Biol Phys 2023; 117(1): 45–52. doi: 10.1016/j.ijrobp.2023.03.064.