Primárny lymfóm pankreasu – kazuistika
Zuzana Vrablicová1, Iveta Čierna2, Daniela Staníková2, Alexandra Kolenová3, Andrea Hrašková3, Lukáš Plank4, Igor Šturdík1, Tomáš Koller Orcid.org 1
+ Pracoviště
Souhrn
Bolesti brucha patria medzi pomerne časté symptómy u adolescentov. Príčiny, ktoré sa podieľajú na bolestiach brucha, sú pestré a tým aj diferenciálna diagnostika je pomerne rozsiahla a zložitá. To súvisí pravdepodobne s tým, že brucho zaberá pomerne veľkú oblasť, obsahuje množstvo orgánov, štruktúr, systémov vrátane lymfatických uzlín, ktoré generalizovane reagujú na infekciu, či nádorové ochorenia. V našej kazuistike opisujeme prípad 17-ročného pacienta s náhlymi bolesťami brucha, chudnutím, vracaním a ikterom. V rámci diferenciálnej diagnostiky sa realizovali laboratórne a zobrazovacie vyšetrenia so zameraním na pankreas a hepatobiliárny trakt, kde sa zobrazila zväčšená hlava a chvost pankreasu, peripankreatická lymfadenopatia s vedľajším nálezom drobných ložísk na obličkách. V úvode sa suponovala skôr hereditárna pankreatitída a pseudotumory na obličkách, vzhľadom na vek pacienta bol menej pravdepodobný tumor pankreasu a metastázy. Definitívna diagnóza bola stanovená odberom bioptických vzoriek pankreasu pomocou endosonografického vyšetrenia. Histologický a cytologický nález preukázal prítomnosť lymfocytárnych blastických buniek, charakteru CD20+ B-NHL, konštatovaný difúzny veľkobunkový B-lymfóm pankreasu (DLBCL – diffuse large B cell lymphoma). Staging ochorenia nepreukázal inflitráciu malígnych buniek v kostnej dreni a centrálnej nervovej sústave. Promptne stanovená diagnóza a podaná príslušná onkologická liečba (chemoterapia v kombinácii s monoklonálnou protilátkou) zabezpečila pacientovi návrat do každodenného života a je nevyhnutným predpokladom priaznivej prognózy pacienta.
Klíčová slova
bolesti brucha, žltačka, difúzny veľkobunkový B-lymfóm
Úvod
Lymfómy sú heterogénna skupina malígnych ochorení odvodených od zrelých alebo nezrelých (blastových, prekurzorových) lymfoidných buniek. Poznáme dva hlavné typy lymfómov: Hodgkinov lymfóm (HL) a non-Hodgkinov lymfóm (NHL). Líšia sa predovšetkým morfologickými, imunofenotypovými znakmi buniek, ktoré ich tvoria, rovnako aj molekulovo-biologickými parametrami a klinickými prejavmi [1]. U detí sú NHL takmer všetky malígne s vysokou proliferačnou aktivitou a často diseminované v čase diagnózy [2]. U non-Hodgkinovho lymfómu (NHL) dominuje skôr extranodulárny charakter, na rozdiel od Hodgkinovho lymfómu [3].
Primárne lymfómy tráviaceho traktu tvoria samostatnú skupinu extranodálnych lymfómov. Histologicky sú to rôzne typy non-hodgkinovských lymfómov (NHL), s rôznym biologickým správaním a odlišným spôsobom liečby [4]. Jedná sa približne o 12 % všetkých non-hodgkinovských lymfómov, pričom v dvoch tretinách je postihnutý žalúdok a v jednej tretine prípadov črevo [5]. Primárny lymfóm pankreasu (PPL – primary pancreatic lymphoma) je veľmi zriedkavé ochorenie, ktoré sa vyskytuje v menej ako 2 % všetkých extranodálnych NHL a v menej ako 0,5 % tumorov pankreasu [6]. Behrns et al ako prví definovali klinické kritéria pre primárny lymfóm pankreasu. Medzi tieto kritéria patrí tumorózna masa pankreasu so zavzatím lymfatických uzlín v peripankreatickej oblasti, neprítomnosť povrchovej (palpovateľnej) lymfadenopatie, splenomegálie, hepatomegálie a mediastinálnej lymfadenopatie. Laboratórny nález je bez signifikantných odchýlok v krvnom obraze [7]. V klinickej praxi sa definitívna diagnóza stanoví najčastejšie pomocou endosonografického vyšetrenia s tenko-ihlovou biopsiou (FNA – fine needle aspiration) tkaniva pankreasu a následným histologickým a cytologickým vyšetrením [8]. Z terapeutického hľadiska ma PPL vyššiu mieru kompletnej remisie ochorenia v porovnaní s adenokarcinómom pankreasu [6].
Kazuistika
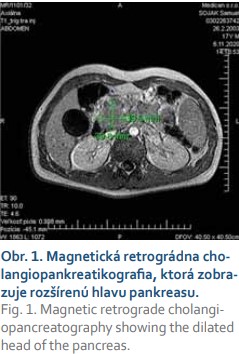
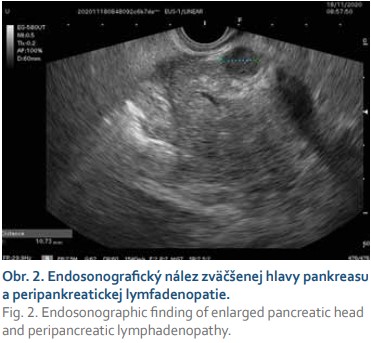
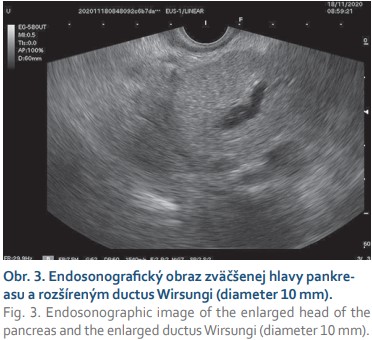
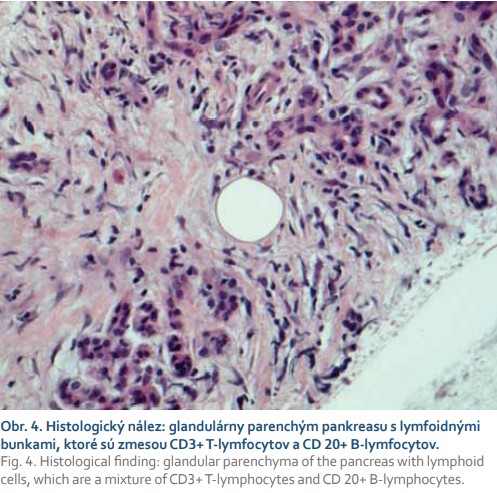
V kazuistike prezentujeme prípad 17-ročného pacienta bez závažných ochorení v minulosti, ktorý bol začiatkom novembra 2020 vyšetrený u svojho rajónneho pediatra pre tri týždne trvajúce bolesti brucha hlavne oblasti epigastria, hnačky a zvracanie. Pediatrom bol odporúčaný šetriaci režim, diéta, inhibítory protónovej pumpy a probiotiká s čiastočne dobrým efektom. Klinický stav sa síce zlepšil, hnačky ustúpili, avšak pretrvávala progredujúca slabosť a únava. O pár dní sa stav komplikoval rozvojom ikteru s tmavo sfarbeným močom a acholickou stolicou. Pacient bol ihneď odoslaný do spádovej nemocnice. Pri prijatí na detské oddelenie v objektívnom náleze dominoval ikterus a palpačne bolestivé epigastrium. V laboratórnom náleze dominovala hyperbilirubinémia (celkový bilirubín 145 µmol/l, konjugovaný bilirubín 105 µmol/l), hepatopatia s prevahou hepatálnych transamináz (AST 15,6 µkat/l, ALT 35 µkat/l, GMT 5,4 µkat/l, ALP 7,9 µkat/l), zvýšená pankreatická lipáza (LPS 4,95 µkat/l) a hypokoagulačný stav (INR 1,35, apTT 1,10). Infekčná príčina hepatopatie bola vylúčená (anti-HAV IgM total negat., HBs-Ag negat., anti-HBsAg negat., anti HCV negat.). Sonografickým vyšetrením brucha sa zobrazila zväčšená pečeň (v medioklavikulárnej čiare o priemere 17 cm) s primeranou echogenitou a bez ložísk. Žlčník bol zväčšený na 13,3 × 4,6 cm, rozšírený ductus hepatocholedochus na 13–14 mm s dilatáciou intrahepatálnych žlčových ciest (priemer 9–10 mm). Pankreas bol zväčšený na 3,5 cm, hypoechogénny bez evidentných ložísk. Následne bola doplnená magnetická retrográdna cholangio-pankreatografia (MRCP), kde bola popisovaná zväčšená hlava pankreasu s patologickým signálom, bez jednoznačných ložiskových zmien, so striktúrou pankreatického úseku ductus hepatocholedochus, s prestenotickou dilatáciou intra- aj extrahepatálnych žlčových ciest a hydropsom žlčníka. Ako vedľajší nález viacpočetné nešpecifikované ložiská na oboch obličkách (obr. 1). V diferenciálnej diagnostike sa predpokladala autoimunitná pankreatitída, menej pravdepodobný tumor pankreasu s metastázami v obličkách. Počas hospitalizácie v rajónnej nemocnici pacient schudol 10 kilogramov. Koncom novembra 2020 bol pacient preložený na Detskú kliniku Národného ústavu detských chorôb za účelom ďalšej diagnostiky a liečby. Známa stenóza pankreatickej časti ductus hepatocholedochus bola ošetrená zavedením duodenobiliárneho drénu (DBD) endoskopickou retrográdnou cholangiopankreatikografiou (ERCP). Po zavedení DBD dochádza k poklesu hyperbilirubinémie, hepatálnych transamináz, cholestatických enzýmov a úprave hemokoagulačných parametrov. Vyšetrené boli aj autoprotilátky, ktoré boli negatívne, z onkomarkerov bol zvýšený Ca19–9 (58,7 KIU/l). Pre pozitivitu D-diméru, boli realizované genetické vyšetrenia, u pacienta sa potvrdil trombofilný stav (heterozygot v dvoch mutáciách génu MTHFR). Pacientovi bola podávaná profylaktická dávka nízkomolekularného heparínu. V rámci diferenciálnej diagnostiky bolo doplnené endosonografické vyšetrenie s nálezom abnormálne zväčšenej hlavy a chvosta pankreasu a rozšíreným ductus Wirsungi (obr. 2, 3). Nález imponoval skôr ako difúzny zápal, etiologicky geneticky podmienená hereditárna pankreatitída, event. autoimunitná pankreatitída. Počas vyšetrenia bola realizovaná tenkoihlová biopsia pankreasu. Na PET-CT vyšetrení sa zobrazil hypermetabolický proces v oblasti hlavy a tela pankreasu s rozsiahlou hypermetabolickou regionálnou lymfadenopatiou, v parenchýme obličiek viacpočetné hypermetabolické ložiská rôznej veľkosti, v CT obraze prítomné aj hypodezné ložiská v dif. dg. infarkty, splenomegália, retroperitoneálna lymfadenopatia a drobné solitárne hypermetabolické ložisko v Th 6 stavci vs. kostnodreňová metastáza. Počas hospitalizácie bol zaznamenaný postupný pokles bilirubinémie, hepatálnych trans- amináz, normalizácia hladín cholestatických enzýmov, ale pretrvávajúce zvýšené hladiny CRP (33g/L). Po obdržaní výsledku histológie, kde nález imponoval ako zápal pankreasu (dif dg. aj IgG autoimunitná pankreatitída), prítomná aj atypická lymfoidná celulizácia fibrotických oblastí. Preparát bol zaslaný na ďalšie histologické posúdenie do Konzultačného centra bioptickej diagnostiky ochorení krvotvorby JLF UK v Martine. V druhom čítaní histologického preparátu prítomná inflitrácia CD20+/CD30+ blastických buniek B-NHL (obr. 4), vylúčený bol Burkittov lymfóm, blastická/blastoidná MCL a lymfoblastómový lymfóm. Stav bol záverovaný ako primárny (DLBCL – difúzny veľkobunkový lymfóm B-pôvodu, diffuse large B-cell lymphoma) lymfóm pankreasu. Pacient bol začiatkom decembra 2020 preložený na Kliniku detskej hematológie a onkológie NÚDCH. Tam realizovaná lumbálna punkcia, punkcia kostnej drene a trepanobiopsia, ktoré nepreukázali prítomnosť malígnych buniek. Pacient bol klasifikovaný do skupiny R2, stage III (postihnutie pankreasu hlava a telo, obličky, retroperitoneálne LU, splenomegália, mts v Th-6 stavci), laktátdehydrogenáza (LDH) bola negatívna, bez postihnutia CNS. Pacientovi bola podávaná liečba podľa protokolu B-NHL 2013, konkrétne 4 cykly chemoterapie a monoklonálna protilátka, anti CD20-rituximab. V apríli 2021 na kontrolnom MR brucha (po 4 cykloch chemoterapie) sa nezobrazili žiadne reziduálne zmeny pankreasu, na ľavej obličke drobné reziduum doplnené aj PET-CT, ktoré pre- ukázalo vs. drobné reziduum na ľavej obličke, pankreas bez presvedčivých ložísk, slezina zmenšená, lymfatické uzliny v okolí trunku a pankreasu stacionarného vzhľadu, skelet bez jednoznačnej patológie. Stav bol hodnotený ako klinická remisia ochorenia, v júni 2021 bol extrahovaný duodenobiliárny drén. V čase publikovania kazuistiky je pacient v remisii svojho ochorenia a v sledovaní klinického stavu, laboratórnych parametrov (krvný obraz, obličkové parametre, LDH) z hľadiska toxicity liečby.
Diskusia
Primárny lymfóm pankreasu patrí medzi zriedkavé ochorenia s incidenciou menej ako 1 % všetkých postihnutí pankreasu [9]. Dôkazom sú aj výsledky štúdie, do ktorej bolo zaradených 207 pacientov s tumoróznou masou pankreasu, len v troch prípadoch sa potvrdil primárny lymfóm pankreasu (1,5 %) [10]. Podobný výskyt bol zaznamenaný Volmarom et al, kde z 1 015 tenkoihlových biopsií tumorózných más pankreasu, len 14 prípadov preukázalo lymfóm pankreasu (1,3 %) [11]. Vzhľadom na klinickú manifestáciu tohto ochorenia a morfologické znaky na zobrazovacích modalitách, sa diagnóza častokrát zamieňa za chronickú pankreatitídu, prípadne autoimunitnú pankreatitídu alebo karcinóm pankreasu. Postihnutí sú prevažne muži (muži: ženy 7: 1). Manifestácia primárneho lymfómu pankreasu je podobná ako pri adenokarcinóme pankreasu medzi 5. a 6. dekádou života, raritnejšia v detskom veku [12]. Medzi najčastejšie prejavy PPL patria bolesti brucha, brušný dyskomfort, zvracanie, hnačky (83 %), rezistencia v dutine brušnej (58 %), strata hmotnosti (50 %), žltačka (37 %) a akútna pankreatitída (12 %) [13,14]. B-symptómy pri NHL, ako horúčka, nočné potenie sú skôr zriedkavé. V súčasnosti neexistujú laboratórne markery pre primárny lymfóm pankreasu. Vo väčšine prípadov a v nami predkladanej kazuistike sú zvýšené obštrukčné hepatálne enzýmy, konjugovaný a celkový bilirubín, amylázy, lipázy, v niektorých prípadoch aj beta-2 mikroglobulín a laktátdehydrogenáza (LDH) [12]. V diagnostike sa využívajú zobrazovacie modality, ako sú ultrasonografia brucha, CT brucha, hrudník a MR brucha, ich cieľom je potvrdenie lézie pankreasu a stanovenie rozsahu ochorenia [15]. Definitívna diagnóza sa stanovuje na základe histologického/cytologického vyšetrenia bioptických vzoriek pankreasu. Vzorka z tkaniva pankreasu sa získava či už prostredníctvom tenkoihlovej biopsie pod endosonografickou kontrolou, alebo ak to nie je možné, chirurgicky (laparoskopickou/laparotomickou metódou) [16,17]. Podľa histologického nálezu sa zvolí aj príslušná liečba. Liečba DLBCL (diffuse large B cell lymphoma) pozostáva z intenzívnej chemoterapie založenej na alkylačných látkach a antimetabolitoch (cytarabín, metotrexát) a cielená liečba monoklonálnou protilátkou – anti-CD20, rituximab [18].
Záver
Primárny lymfóm pankreasu je raritné ochorenie. Vzhľadom na klinickú podobnosť s adenokarcinómom pankreasu má dôležitú úlohu odber materiálu a histologické vyšetrenie s imunofenotypizáciou. Promptne stanovená diagnóza a podaná príslušná liečba je predpokladom lepšej prognózy ochorenia a nižšieho výskytu komplikácií liečby.
Doručené/Submitted: 1. 9. 2021
Prijaté/Accepted: 16. 9. 2021
MUDr. Zuzana Vrablicová
Gastroenterologické a hepatologické oddelenie
V. interná klinika LF UK a UN Bratislava
Ružinovská 6
826 06 Bratislava
leskova991@gmail.com
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. International Agency for Research on Cancer. WHO classification of tumours of haematopoietic and lymphoid tissues. Geneva, Switzerland: WHO press 2008.
2. Burkhardt B, Lenz G. XI. Management of paediatric and adult non-Hodgkin lymphoma: what lessons can each teach the other? Hematol Oncol 2015; 33(Suppl 1): 62–66. doi: 10.1002/hon.2219.
3. Burkhardt B, Zimmermann M, Oschlies I et al. The impact of age and gender on biology, clinical features and treatment outcome of non-Hodgkin lymphoma in childhood and adolescence. Br J Haematol 2005; 131(1): 39–49. doi: 10.1111/j.1365-2141.2005.05735.x.
4. Radaszkiewicz T, Dragosics B, Bauer P et al. Gastrointestinal malignant lymphomas of the mucosa-associated lymphoid tissue: factors relevant to prognosis. Gastroenterology 1992; 102(5): 1628–1638. doi: 10.1016/0016-5085 (92) 917 23-h.
5. Olszewska-Szopa M, Wróbel T. Gastrointestinal non-Hodgkin lymphomas. Adv Clin Exp Med 2019; 28(8): 1119–1124. doi: 10.17219/ acem/94068.
6. Haji AG, Sharma S, Majeed AK et al. Primary pancreatic lymphoma: report of three cases with review of literature. Indian J Med Paediatr Oncol 2009; 30(1): 20–23. doi: 10.4103/ 0971-5851.56331.
7. Behrns KE, Sarr MG, Strickler JG et al. Pancreatic lymphoma: is it a surgical disease? Pancreas 1994; 9 (5): 662–667.
8. Sadaf S, Loya A, Akhtar N et al. Role of endoscopic ultrasound-guided-fine needle aspiration biopsy in the diagnosis of lymphoma of the pancreas: A clinicopathological study of nine cases. Cytopathology 2017; 28(6): 536–541. doi: 10.1111/cyt.12442.
9. Rad N, Khafaf A, Mohammad Alizadeh AH. Primary pancreatic lymphoma: what we need to know. J Gastrointest Oncol 2017; 8(4): 749–757. doi: 10.21037/jgo.2017.06.03.
10. Reed K, Vose PC, Bruce S et al. Pancreatic cancer: 30 year review (1947 to 1977). Am J Surg 1979; 138(6): 929–933. doi: 10.1016/0002-9610(79)90324-6.
11. Volmar KE, Routbort MJ, Jones CK et al. Primary pancreatic lymphoma evaluated by fine-needle aspiration: findings in 14 cases. Am J Clin Pathol 2004; 121(6): 898–903. doi: 10.1309/UAD9-PYFU-A82X-9R9U.
12. Alzerwi N. Primary pancreatic lymphoma masquerading as carcinoma. Case Rep Oncol Med 2020; 2020: 5160545. doi: 10.1155/2020/5160545.
13. Facchinelli D, Boninsegna E, Visco C et al. Primary pancreatic lymphoma: recommendations for diagnosis and management. J Blood Med 2021; 12: 257–267. doi: 10.2147/JBM.S273095.
14. Qiu T, Li W, Geng H et al. Clinicopathological characteristics of primary pancreatic lymphoma: report of two cases. Int J Clin Exp Pathol 2017; 10(11): 10941–10946.
15. Boninsegna E, Zamboni GA, Facchinelli et al. CT imaging of primary pancreatic lymphoma: experience from three referral centres for pancreatic diseases. Insights Imaging 2018; 9(1): 17–24. doi: 10.1007/s13244-017-0585-y.
16. Jones H, Qiao J, Padilla O et al. Primary pancreatic diffuse large B-cell lymphoma, activated B-cell subtype, diagnosed by endoscopic ultrasound-guided fine needle aspiration-A case report and review of the literature. Clinical Case Rep 2020; 9(2): 669–672. doi: 10.1002/ccr3. 3605.
17. Baysal B, Kayar Y, Ince AT et al. Primary pancreatic lymphoma: a rare cause of pancreatic mass. Oncol Lett 2015; 10(3): 1701–1703. doi: 10.3892/ol.2015.3412.
18. Liu Y, Barta SK. Diffuse large B-cell lymphoma: 2019 update on diagnosis, risk stratification, and treatment. Am J Hematol 2019; 94(5): 604–616. doi: 10.1002/ajh.25460.