Primární leiomyosarkom colon transversum imitující periappendikální absces: kazuistika a přehled literatury
Jan Knap1,2
+ Pracoviště
Souhrn
Leiomyosarkom (LMS) gastrointestinálního traktu a zejména primární LMS kolon je extrémně vzácná, vysoce agresivní malignita se špatnou prognózou. Pětileté přežití se blíží 50 % u lokalizovaného onemocnění, v případě metastatického nepřesahuje 10 %. Manifestace bývá různorodá, může být jak akutní v případě krvácení či intususcepce, tak protrahovaná. Vzhledem k vzácnosti výskytu a absenci specifických markerů je předoperační diagnostika prakticky nemožná. Předmětem sdělení je kazuistika 67leté pacientky přijaté na naše pracoviště pod sugestivním klinickým obrazem periappendikálního infiltrátu/abscesu, jenž se finálně ukázal být primárním LMS dolichotransversa lokalizovaného v pravém podbřišku. Po endoskopické diagnostické resekci následovala chirurgická léčba s kurativním záměrem, neboť předoperačně nebyla zjištěna diseminace procesu.
Klíčová slova
koloskopie, leiomyosarkom, rakovina tlustého střeva
Úvod
Leiomyosarkom (LMS) je nádor vycházející z mezenchymální tkáně, konkrétně z tkáně hladké svaloviny. Nejčastější lokalitou LMS je retroperitoneum, velké cévy (zejména v. cava inferior) a dolní končetiny [1]. Primární LMS gastrointestinálního traktu jsou extrémně vzácné a vysoce agresivní [2]. Zahrnují jen 0,1–3 % všech gastrointestinálních malignit, v kolon pak 0,12 % malignit [3]. Ve srovnání s ostatními nádory kolon jsou primární leiomyosarkomy kolon (CLMS – colonic leiomyosarcoma) agresivnější a často recidivují, časté je rovněž hematogenní šíření do plic a jater, naproti tomu lymfatické šíření je méně časté [3]. Pětileté přežití pacientů v souboru celkem 29 pacientů dle Yamamoto et al. činilo 51,6 % [4]. U metastatického CLMS dle téhož autora v souboru 11 pacientů bylo 9,1 % [4]. Příznaky mohou být rozličné, avšak nespecifické. Nejčastěji jsou uváděny bolesti břicha, krvácení, intususcepce, hmatná rezistence na břiše, ileus. Záleží na velikosti nádoru, která bývá velmi variabilní od několika centimetrů až po jejich desítky [5]. Předoperační diagnostika CLMS je svízelná. Počítačová tomografie nebo magnetická rezonance může ukázat zesílení stěny kolon či intraluminální proces, obraz je však nespecifický, přestože dává podezření na maligní etiologii [6,7]. CLMS vyrůstá z muscularis propria nebo muscularis mucosae, a nádor je tak krytý normální sliznicí anebo i submukózou, tedy ani bioptické vyšetření při endoskopii nemusí malignitu verifikovat [7,8]. Rovněž chybí specifické tumorové markery, hladiny tradičních gastrointestinálních markerů CEA a CA19-9 bývají nezvýšené [7]. Přestože máme v České republice vytvořené srozumitelné doporučené postupy pro diagnostickou a terapeutickou koloskopii, k sarkomům tlustého střeva se vzhledem k vzácnosti jejich výskytu nevyjadřují [9]. Při stanovení gradingu tumoru je v Evropě nejčastěji používán systém Fédération Nationale des Centres de Lutte Contre le Cancer (FNCLCC 2009) (tab. 1) [10]. Nádory vysokého grade relabují častěji systémově, většinou během 2–3 let po léčbě. Nejčastějším místem relapsu jsou plíce [11].

Kazuistika
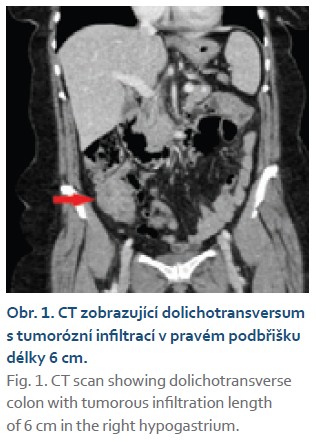
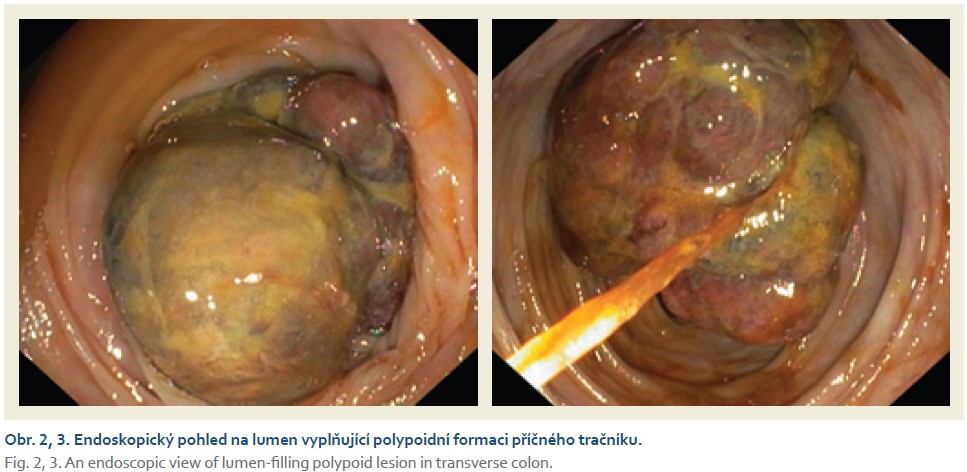
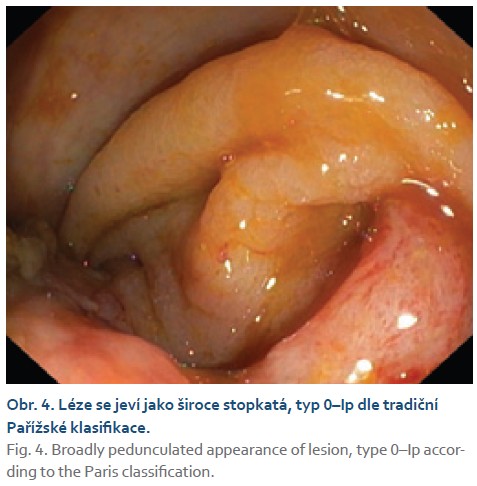
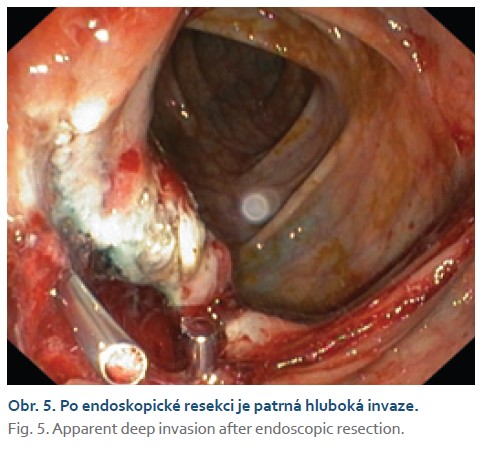
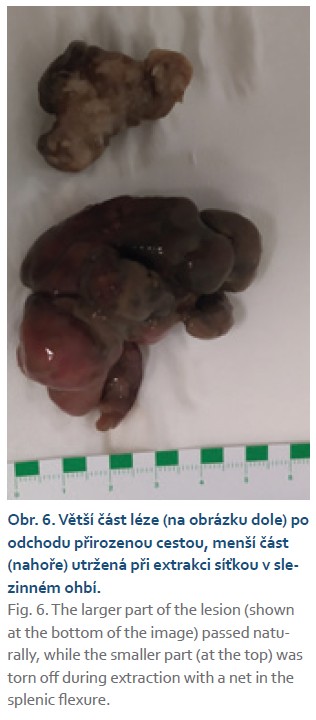
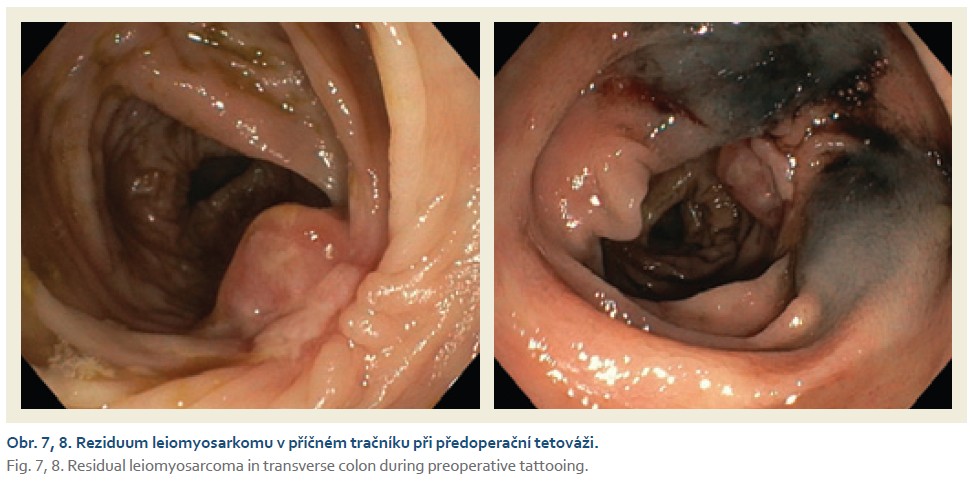
Na chirurgické oddělení byla přijata 67letá žena pro bolesti pravého mezo-hypogastria trvající 4 dny. Při klinickém vyšetření jsme nalezli hmatnou rezistenci v pravé jámě kyčelní, ostatní fyzikální nález v normě. UZ břicha popisuje hypo- až anechogenní formaci v pravém mezo-hypogastriu šíře 58 mm. Laboratorně CRP 120 mg/l, mírná leukocytóza (12 × 109/l), nádorové markery CEA, CA19-9 nezvýšené. Na základě těchto faktů zvažujeme na prvním místě periappendikální infiltrát či absces. Na kontrastním CT břicha je však patrné dolichotransverzum zasahující až do pánve a pravého podbřišku, kde je tumorózní infiltrace v délce 6 cm (obr. 1). Vzdálené metastázy plic ani jater nebyly prokázány. Provedli jsme koloskopické vyšetření v celkové anestezii (obtížná koloskopie) s nálezem lumen vyplňující polypoidní, nepravidelně kulovité infiltrace rozměru přibližně 6 × 5 cm v pravé polovině příčného tračníku (obr. 2, 3). Pit pattern nespecifický, v NBI módu neodpovídá žádnému z běžných typů neoplazií. Léze se jeví jako široce stopkatá, typ 0–Ip dle tradiční Pařížské klasifikace (obr. 4), je tedy s podpichem stopky odstraněna kličkou průměru 50 mm s cílem en bloc resekce. Po resekci léze je patrná v orálním okraji hluboká invaze (obr. 5). Spodinu jsme ošetřili hemostaticky celkem pěti klipy a od další endoskopické intervence jsme ustoupili. Velikost léze značně přesahovala průměr extrakční síťky. Uchopili jsme ji jen zčásti, při průchodu lienální flexurou se větší část léze oddělila, a extrahovali jsme tedy přibližně čtvrtinu resekátu. Většinovou část resekátu jsme finálně ponechali odejít per vias naturales a poté jsme oba resekáty odeslali společně na histologické vyšetření (obr. 6). Histologické a imunohistochemické vyšetření prokazuje leiomyosarkom, FNCLCC grading 3 (diferenciace 2 body, objem nekrózy 1 bod, mitotický počet 3 body). Dotyčná byla následně referována do komplexního onkologického centra k chirurgické resekci. Předoperačně ještě proběhla na našem pracovišti tetováž léze, kde je patrné reziduum CLMS velikosti kolem 15 mm (obr. 7, 8). V onkologickém centru byla provedena rozšířená pravostranná hemikolektomie s ileo-transverzo-anastomózou. Pooperační průběh byl bez komplikací. Výsledné histologické vyšetření resekátu potvrzuje leiomyosarkom G3, pT1pN0 L0 V0 R0. Onkologická komise vzhledem k vysokému gradingu tumoru doporučila adjuvantní chemoterapii v kombinaci doxorubicin + dacarbazin, která je toho času in cursu.
Diskuze
Mezi lety 1923 a 2019 literatura udává 41 případů primárního leiomyosarkomu kolon [12]. Naproti tomu Bananzadeh et al. [13] ve své recentní studii evidovali od roku 2000 do roku 2020 celkem 36 publikovaných případů CLMS potvrzených imunohistochemicky, neboť imunohistochemická heterogenita je klíčem v rozlišení mezi gastrointestinálním stromálním tumorem (GISTom) a LMS. Před rokem 1998 bylo možné tyto jednotky zaměnit, neboť histologický obraz je velmi podobný, a část LMS tak byla později reklasifikována na GIST [14]. Až tehdy byla publikována imunohistochemická rozdílnost obou nádorů, kdy Hirota et al. referovali o významu pozitivity mutace tyrosinkinázového receptoru KIT u GISTomů [15]. Později byly identifikovány další imunohistochemické markery a GISTomy, které vycházejí z intersticiálních Cajalových buněk a vykazují pozitivitu CD117 (c-KIT mutace), CD34 a DOG1, zatímco LMS vykazují negativitu, a navíc vykazují pozitivitu pro SMA (smooth muscle actin), desmin, calponin a h-caldesmon [1,4,6,7,16]. Rozdílná je rovněž léčebná strategie, neboť GISTomy reagují na tyrosinkinázový inhibitor imatinib [16]. U LMS má chemoterapie i radioterapie jen omezený význam a optimální léčbou je chirurgická resekce [13,14,16]. V současné době nepanuje jednotný názor na roli adjuvantní chemoterapie. Výsledky jednotlivých studií jsou často protichůdné [11]. Dle některých adjuvantní chemoterapie nezvyšuje přežití [3], naproti tomu neoadjuvantní chemoterapie může snížit riziko lokální rekurence v případě rektálního sarkomu [13]. Z užívaných cytostatik bývají v literatuře nejčastěji uváděny antracykliny v podobě doxorubicinu v kombinaci s dacarbazinem tak, jako bylo doporučeno onkologickou indikační komisí i v našem případě.
Závěr
K diagnostice a léčbě sarkomů máme dostupné klinické doporučené postupy. Vzhledem k vzácnému výskytu těchto nádorů v gastrointestinálním traktu je nutné je řešit v komplexním onkologickém centru, optimálně od prvního podezření na toto onemocnění. V našem případě šlo o extrémně vzácný výskyt primárního leiomyosarkomu v příčném tračníku u 67leté pacientky, jenž se iniciálně na podkladě fyzikálního, ultrazvukového a laboratorního vyšetření jevil jako periappendikální infiltrát či absces. Na základě počítačové tomografie, koloskopie a imunohistochemického vyšetření endoskopického resekátu byla stanovena správná diagnóza leiomyosarkomu, grade 3. Klešťová biopsie, ani opakovaná, nemusí leiomyosarkom potvrdit. Pokus o endoskopickou resekci z principu nemůže být kurativní, neboť origo nádoru je nejčastěji v muscularis propria kolon a provedená inkompletní endoskopická resekce ve své podstatě představovala extenzivní formu excizionální biopsie. Chirurgická resekce představuje zlatý standard léčby těchto vzácných malignit, zatímco chemo- i radioterapie má jen omezený význam.
Doručeno/Submitted: 25. 4. 2025
Přijato/Accepted: 18. 5. 2025
Korespondenční autor
MUDr. Jan Knap
Chirurgické oddělení
Nemocnice Vyškov, p. o.
Purkyňova 235/36
682 01 Vyškov
knap@nemvy.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Yahagi M, Ishii Y, Hara A et al. Laparoscopic surgery to treat leiomyosarcomas of the sigmoid colon: a case report and literature review. Surg Case Rep 2019; 5(1): 20. doi: 10.1186/s40792-019-0579-8.
2. Aichouni N, Ziani H, Karich N et al. Primary leiomyosarcoma of the sigmoid colon: case report and review of literature. Radiol Case Rep 2021; 17(1): 35–40. doi: 10.1016/j.radcr.2021.09.061.
3. Crystal JS, Korderas K, Schwartzberg D et al. Primary leiomyosarcoma of the colon: a report of two cases, review of the literature, and association with immunosuppression for IBD and rheumatoid arthritis. Case Rep Surg 2018; 2018: 6824643. doi: 10.1155/2018/6824643.
4. Yamamoto H, Handa M, Tobo T et al. Clinicopathological features of primary leiomyosarcoma of the gastrointestinal tract following recognition of gastrointestinal stromal tumours. Histopathology 2013; 63(2): 194–207. doi: 10.1111/his.12159.
5. Mackenzie DA, McDonald JR, Waugh JM. Leiomyoma and leiomyosarcoma of the colon. Ann Surg 1954; 139(1): 67–75. doi: 10.1097/00000658-195401000-00008.
6. Omameuda T, Koizumi M, Miyahara Y et al. A rare case of leiomyosarcoma with a pleomorphic component of the sigmoid colon. J Surg Case Rep 2024; 2024(7): rjae454. doi: 10.1093/jscr/rjae454.
7. Fickenscher M, Gvozdenovic N, Ponsel O. Diag- nostic and therapy of an early-stage primary leiomyosarcoma of the sigmoid colon: a case report. Clin Case Rep 2024; 12(7): e9178. doi: 10.1002/ccr3.9178.
8. Doan TT, Pham DT. Primary leiomyosarcoma of the colon: a report of two cases and review of literature. Ann Med Surg 2024; 86(8): 4865–4869. doi: 10.1097/MS9.000000000000 2277.
9. Falt P, Cyrany J, Kunovský L et al. Doporučené postupy České gastroenterologické společnosti ČLS JEP pro diagnostickou a terapeutickou koloskopii – aktualizované vydání 2024. Gastroenterol Hepatol 2024; 78(3): 197–235. doi: 10.48095/ccgh2024197.
10. Krška Z, Hoskovec D, Petruželka L. Chirurgická onkologie. Praha: Grada Publishing 2014.
11. Lischke R, Tomáš T, Kopečková K et al. Sarkomy měkkých tkání – diagnostika a léčba. 2021 [online]. Dostupné z: https: //kdp.uzis.cz/res/guideline/14-sarkomy-mekkych-tkani-diagnostika-lecba-final.pdf.
12. Wang Y, Wang H, Yuan ZL et al. A pooled analysis of risk factors of surgically treated leiomyosarcoma of the colon in adults. World J Surg Oncol 2020; 18(1): 61. doi: 10.1186/s12957- 020-01838-3.
13. Bananzadeh A, Mokhtari M, Sohooli M et al. Two cases of primary leiomyosarcoma of sigmoid colon treated with laparoscopic surgery: a case report and a review of literature. Int J Surg Case Rep 2021; 87: 106420. doi: 10.1016/j.ijscr.2021.106420.
14. Massaras D, Kontis E, Stamatis K et al. Primary leiomyosarcoma of the colon with synchronous liver metastasis. Rare Tumors 2022; 14: 20363613221080549. doi: 10.1177/20363613221080549.
15. Hirota S, Isozaki K, Moriyama Y et al. Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors. Science 1998; 279(5350): 577–580. doi: 10.1126/science.279.5350.577.
16. Nguyen C, Athigaman M, Qureshi A. Giant leiomyosarcoma of the transverse colon. BMJ Case Rep 2021; 14(12): e246646. doi: 10.1136/bcr-2021-246646.