Mezioborová spolupráce ve screeningu kolorektálního karcinomu. Čekací doba na kolonoskopii
Norbert Král Orcid.org 1, Bohumil Seifert Orcid.org 1
+ Pracoviště
Souhrn
Během 15 let trvání screeningu kolorektálního karcinomu v ČR získaly obě klíčové odbornosti, praktičtí lékaři a gastroenterologové, mnoho zkušeností. Mezioborové spolupráci dosud v literatuře nebyla věnována potřebná pozornost, a to lokálně ani v mezinárodním měřítku. Tento článek je věnován různým aspektům spolupráce mezi praktickými lékaři a gastroenterology, s důrazem na aktuální problém kolonoskopických kapacit ve screeningu v pozadí probíhajícího adresného zvaní. Metodika: Data byla získána telefonickým průzkumem, který proběhl v dubnu 2015. Byla zjišťována délka čekací doby na screeningovou kolonoskopii v gastroenterologických centrech pro screeningovou kolonoskopii. Průzkum byl zaměřen na zjištění rozdílů mezi regiony, resp. mezi ambulantním a nemocničním sektorem. Výsledky: K dispozici máme data ze 166 gastroenterologických center pro screeningovou kolonoskopii. Průměrná čekací doba ze všech oslovených center byla 64 dnů. V Čechách byla čekací doba v průměru delší (70,8 dnů) než na Moravě (53 dnů). Ostatní rozdíly (nemocnice vs. ambulance, regionální rozdíly) nebyly statisticky významné. Závěr: Délka čekací doby komplikuje mezioborovou spolupráci a ohrožuje funkčnost screeningu kolorektálního karcinomu v ČR. Situace vyžaduje opatření, a to odborně technické (zvýšení „cut-off“) i organizační (zvýšení kolonoskopických kapacit).
Klíčová slova
centrální zvaní, koloskopie, kolorektální karcinom, praktický lékař, screeningÚvod
ČR zaujímá ve screeningu kolorektálního karcinomu (CRC – colorectal cancer) významné místo, a to nejen s ohledem na epidemiologická data, ale také s ohledem na zkušenosti se screeningovým programem [1–6]. Jako druhá země na světě jsme zavedli screeningový program na národní úrovni, jako jedna z prvních zemí jsme uvedli do programu imunochemické testy a v oportunní formě programu jsme dosáhli relativně vysoké účasti. Zavedením adresného zvaní pro občany nenavštěvující screening od ledna 2014 jsme se připojili k Velké Británii, Nizozemsku, Francii, Finsku a Slovinsku – zemím, které díky systému individuálního zvaní dosahují účasti nad 50 % cílové populace. Ve výše uvedených zemích, s výjimkou Francie [7], na rozdíl od našeho programu, nejsou praktičtí lékaři (PL) do screeningu zapojeni [8,9]. Vyšetřovací kity testu na okultní krvácení (TOKS) jsou rozesílány buď přímo se zvacím dopisem, nebo následně. Pro tuto organizaci screeningu hovoří vyšší dosahovaná účast v reálně probíhajících programech, jistota jednotného přístupu k informaci o screeningu, úleva zatížení PL a výhoda pro občany, kteří v souvislosti se screeningem nemusí k lékaři.
Naopak role PL ve screeningu, jak je zakotvena v ČR, je podporována poskytováním vyrovnaných informací o screeningu občanům. Napomáhá správné identifikaci pacientů vhodných pro screening, dává možnost vydávat a vyhodnocovat test v prostředí, kde je poskytována péče, a reagovat na výsledek, negativní nebo pozitivní. Roli PL ve zvyšování účasti ve screeningu podporují také data z evropských studií [10–14].
PL kromě zajišťování účasti, poskytování informací, distribuce a vyhodnocování TOKS odpovídají za přípravu a odeslání pacienta s pozitivním testem na kolonoskopii, za další komunikaci výsledků vyšetření a podporu následného sledování na gastroenterologii.
Rostoucí účast ve screeningu, jako důsledek zavedení adresného zvaní, provází vyšší nároky pro všechny zúčastněné strany ve screeningovém programu. PL i gastroenterologové řeší celou řadu specifických otázek aktuálního provádění a dalšího rozvoje screeningu, nicméně shodně vnímají vzájemnou komunikaci a funkční spolupráci jako zásadní předpoklad efektivity screeningu. Světová literatura této oblasti nevěnuje potřebnou pozornost, a to lokálně ani v mezinárodním měřítku. Autoři se v této práci zabývají různými aspekty spolupráce mezi PL a gastroenterology s důrazem na aktuální problém kolonoskopických kapacit ve screeningu v pozadí probíhajícího adresného zvaní. Před zavedením adresného zvaní byla nejvíce diskutovanou oblastí kapacita gastroenterologických center pro screeningovou kolonoskopii (dále centra), a tedy čekací doba na kolonoskopické vyšetření. Očekávalo se její výrazné prodloužení [15]. V roce 2015 jsme provedli průzkum s ohledem na tuto problematiku, která měla ukázat, zda byly obavy opodstatněné.
Metodika
Délka čekací doby na screeningovou kolonoskopii v centrech byla zjišťována formou telefonického průzkumu. Telefonický průzkum prováděla jedna osoba z pozice pacienta během dvou po sobě jdoucích dnů v dubnu v roce 2015. V rámci telefonického rozhovoru jsme se dotazovali na první možný termín na screeningovou kolonoskopii. Průzkum byl dále zaměřen na zjištění rozdílů mezi regiony, resp. mezi ambulantním a nemocničním sektorem.
Analýza dat byla provedena na softwaru STATISTICA 10. Pro zjištění rozdílu čekací doby mezi centry s ambulantním lékařem a nemocnicí byl použit dvouvýběrový t-test. Pro zjištění rozdílu mezi jednotlivými kraji byl použit ANOVA test. Tento test odhalí, zda existuje alespoň jedna dvojice krajů, jejíž průměry se liší. Pokud vyjde test signifikantně, zajímá nás, které dvojice se liší. Pro tento účel byla použita Scheffého metoda vícenásobného porovnávání.
Výsledky
Data
Osloveno bylo 180 center podle seznamu na webu Ministerstva zdravotnictví ČR.
Do průzkumu jsme zařadili 166 center, ve kterých bylo uskutečněno telefonické objednání. Některá pracoviště se nepodařilo kontaktovat; ojediněle měla pracoviště stanovený harmonogram objednávání a bylo nutné se mu přizpůsobit (např. objednávala pacienty první týden v měsíci na následující měsíc). V telefonickém průzkumu byl ověřován i status (nemocniční/ambulantní centrum). Počet ambulantních center byl 89, nemocničních 90. U jednoho centra nebyl jeho status rozpoznán.
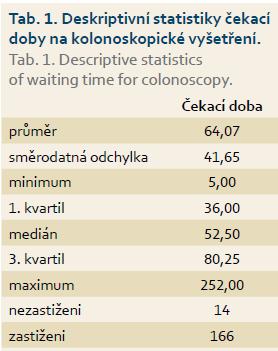
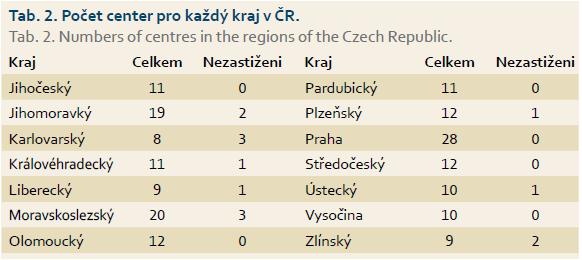
Průměrná čekací doba za všechna centra byla 64 dnů, minimální doba byla pět dnů a maximální 252 dnů (tab. 1). Počet center v krajích se pohyboval v rozmezí 8–28 (tab. 2). Praha měla v průzkumu největší zastoupení, naopak nejmenší měl Karlovarský kraj.
Rozdíly mezi ambulantními a nemocničními centry
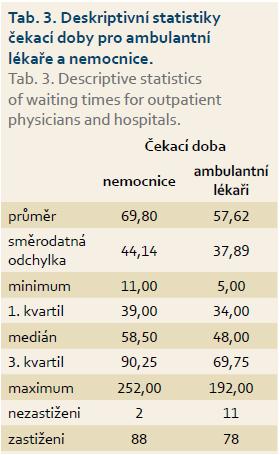
Průměrná čekací doba pro ambulantní centra byla 57,6 dne a pro nemocniční centra 69,8 dne (tab. 3). Průměr i medián čekací doby byl vyšší u nemocnic než u ambulantních lékařů. Pro posouzení významnosti rozdílu v čekací době u ambulantních a nemocničních center byl použit dvouvýběrový t-test. Dvouvýběrovým t-testem nebyla prokázána statistická významnost.
Rozdíly mezi kraji
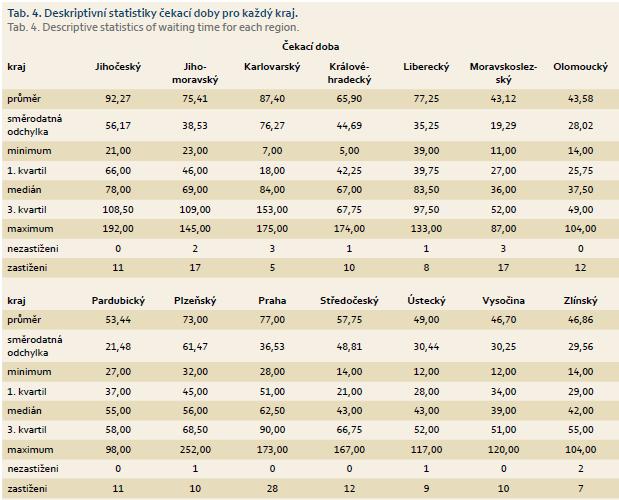
Výsledky ukázaly, že rozdíly existují, a např. medián čekací doby byl nejvyšší pro Karlovarský kraj a nejmenší pro Moravskoslezský kraj (tab. 4). Globální test naznačil, že rozdíly existují, ale Scheffého metoda z důvodu malého počtu center v jednotlivých krajích žádný rozdíl neobjevila. Při srovnání krajů z Moravy a Čech jsme zjistili, že v Čechách je čekací doba 70,8 dne a na Moravě 53 dnů. Statistické posouzení potvrdilo, že rozdíl mezi čekací dobou v Čechách a na Moravě je signifikantní a pacienti čekali déle v Čechách (p = 0,01). Konfrontovat Čechy a Moravu nebylo prvotním záměrem studie a rozdílnost v čekací době byla až vedlejším zjištěním při vyhodnocování výsledků.
Diskuze
Maximální doba od zjištění pozitivity TOKS k provedení kolonoskopie by neměla podle evropských doporučení přesáhnout 31 dnů [16]. V ČR při průměrné čekací době 64 dnů přesahujeme doporučený maximální časový interval přibližně 2×. Prodlužování intervalu mezi pozitivním TOKS a kolonoskopií vede ke snížení compliance [17,18], která až dosud byla v ČR na úrovni 90 % [1], tedy vyšší, než dosahují populační programy bez zapojení PL. Navíc prodlužování tohoto intervalu je neetické; pacient je stresován obavami. Přes snahu lékařů o vysvětlení principu TOKS a významu jeho pozitivity klade řada pacientů rovnítko mezi pozitivním testem a nádorovým onemocněním.
Při zadání průzkumu jsme očekávali významně kratší čekací dobu u ambulantních center oproti centrům nemocničním, ale to se nepotvrdilo. Naopak byl prokázán rozdíl mezi centry v Čechách a na Moravě.
Z výsledků vyplývá, že v některých oblastech ČR mají pacienti s pozitivním TOKS lepší dostupnost kolonoskopie, ale je nad rámec našeho průzkumu tyto rozdíly mezi kraji vysvětlit. Do určité míry může hrát roli rozložení center s ohledem na regionální populaci a zjištění mohou být použita k plánování sítě center.
Při pokračování adresného zvaní lze očekávat další nárůst účasti české populace a nárůst preventivních kolonoskopií. Vzhledem k vysokému procentuálnímu zastoupení polypektomií dojde také k nárůstu skupiny dispenzarizovaných pacientů s časnými kontrolami, a tedy k dalšímu nároku na kolonoskopickou kapacitu a dalšímu prodlužování čekací doby. Některé zahraniční studie ukazují i na příliš časné kontroly od provedené polypektomie [19]. V tomto ohledu existuje velká rozdílnost i v ČR. Situace vyžaduje řešení, a to v krátkém časovém horizontu.
Řešení čekacích dob zahrnuje standardizaci TOKS na vyšší hladině pozitivity, optimalizace nescreeningových indikací kolonoskopie a navýšení kolonoskopických kapacit [20,21]. Vyšší hodnota cut-off imunochemických testů (iTOKS) než v českém programu aktuálně navržená 75–100 ng/ml by znamenala zmírnění kolonoskopické zátěže při mírném snížení senzitivity pro záchyt kurabilních nádorů [22]. V některých evropských zemích řeší gastroenterologové požadavky screeningu rozšířením pracovní doby a dalšími organizačními opatřeními, např. rozdělením endoskopických sálů na terapeutické a screeningové. Z hlediska úhrad je důležité, aby screeningové kolonoskopie byly hrazeny mimo paušál ve zvláštním režimu.
Další aspekty mezioborové spolupráce
Účast ve screeningu CRC počala v ČR narůstat již po opatřeních přijatých v roce 2009. Zavedení iTOKS, uživatelsky příjemnějších jak pro probandy, tak pro lékaře, nejvýznamněji přispělo ke zvýšení pokrytí. Díky vyšší citlivosti iTOKS oproti guajakovým testům a používání různých druhů těchto testů se ovšem zdvojnásobila míra pozitivity se všemi důsledky. Dále narůstal podíl žen. Do screeningu vstoupili gynekologové, z hlediska mezioborové spolupráce značně vzdálení gastroenterologům. Procento TOKS poskytnutých gynekology ve screeningu u žen v roce 2010 dosáhlo 14,1 %; nejvyšší bylo ve věkové skupině 50–60 let, ale v dalších letech nerostlo nebo se dokonce snížilo. Primární screeningové kolonoskopie postupně tvořily až 19 % všech kolonoskopií ve screeningu CRC, v roce 2014 se zavedením adresného zvaní se jejich podíl zvýšil až na 24 %. Na pozvání na screening CRC v roce 2014 zareagovalo 17,3 % osob z těch, kteří dříve screening ignorovali. Účast ve screeningu přesáhla 30 % a spolu s vyšší pozitivitou testů, která dosáhla v roce 2013 v průměru 7,9 %, to přineslo velký nápor jak na PL komunikující pozitivní TOKS, tak na centra pro screeningovou kolonoskopii [23].
Autoři, kteří mají možnost mezinárodního srovnání, považují spolupráci PL a gastroenterologů v ČR v evropském měřítku za nadstandardní. Nicméně existuje prostor pro zlepšení. Obraz úspěšné spolupráce je odrazem očekávání obou odborností.
Gastroenterolog očekává informova- ného a kvalitně připraveného pacienta na endoskopické vyšetření. Průsečíkem obou odborností je např. dohoda na vhodné přípravě (konkrétní volbě laxativa) nebo na odběrech před vyšetřením. Samotná příprava bývá pacienty charakterizována jako nejnepříjemnější část celého procesu [24]. Rutinními odběry jsou krevní obraz a koagulace, mnohdy však gastroenterolog nevyžaduje žádné laboratorní vyšetření, event. má celou přípravu ve své režii. Shoda je třeba také v otázce vysazení nebo nevysazení warfarinu před kolonoskopií.
PL očekává, že lékař centra poskytne pacientovi srozumitelnou informaci o výsledku kolonoskopie, případně o plánu dalšího sledování, a PL včas dodá lékařskou zprávu, vč. výsledku biopsie s plánem následné kontroly.
PL odesílají obvykle pacienty na pracoviště, se kterými již dlouhodobě spolupracují a s jehož zvyklostmi a požadavky jsou již obeznámeni. Organizace a zajištění kvality screeningu však vyžaduje odesílání pacientů do gastroenterologických center pro screeningovou kolonoskopii. To může v některých oblastech vyvolávat problémy, event. nestandardní postupy. Centra by měla být s ohledem na tuto skutečnost iniciativní ve své spádové oblasti a s lékaři komunikovat na individuální i regionální úrovni a organizovat setkávání nad organizačními i odbornými tématy.
Tato spolupráce je podpořena spoluprací na úrovni odborných společností.
Závěr
Spolupráce PL a gastroenterologa je zásadní především v péči o individuálního pacienta. Dobrá komunikace mezi PL a konkrétním centrem pro screeningovou kolonoskopii, flexibilita při objednávání a možnost konzultace přípravy komplikovaných pacientů se jeví jako priorita ve spolupráci obou odborností.
Délka čekací doby komplikuje mezioborovou spolupráci a ohrožuje funkčnost screeningu CRC v ČR. Situace vyžaduje opatření, a to odborně technické (zvýšení cut-off) i organizační (zvýšení kolonoskopických kapacit).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Doručeno/Submitted: 21. 1. 2016
Přijato/Accepted: 5. 5. 2016
MUDr. Norbert Král
Ústav všeobecného lékařství
1. LF UK v Praze
Albertov 7
120 00 Praha 2
norbert.kral@seznam.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Seifert B, Zavoral M, Fric P et al. The role of primary care in colorectal cancer screening: experience from Czech Republic. Neoplasma 2008; 55(1): 74– 80.
2. Zavoral M, Suchanek S, Zavada F et al. Colorectal cancer screening in Europe.
World J Gastroenterol 2009; 15(47): 5907– 5915.
3. Král N, Seifert B, Suchánek Š et al. Pří stup populace ke screeningu kolorektálního
karcinomu v České republice. Epidemiol Mikrobiol Imunol 2015; 64(1): 41– 46.
4. Májek O, Danes J, Zavoral M et al. Czech national cancer screening programmes
in 2010. Klin Onkol 2010; 23(5): 343– 353.
5. Král N, Seifert B, Dušek L et al. Změny ve screeningu kolorektálního karcinomu –
krok správným směrem? Onkologie 2010; 4(4): 251– 255.
6. Majek O, Danes J, Skovajsova M et al. Breast cancer screening in the Czech Republic:
time trends in performance indicators during the first seven years of the organised
programme. BMC Public Health 2011; 11(1): 288. doi: 10.1186/ 1471-2458-11- 288.
7. Viguier J, Calazel-Benque A, Eisinger F et al. Organized colorectal cancer screening programmes:
how to optimize efficiency among general practitioners. Eur J Cancer Prev 2011; 20 (Suppl 1): 26– 32.
doi: 10.1097/ 01.cej.0000391567.49006.af.
8. Denters M, Deutekom M, Fockens P et al. Implementation of population screening for colorectal cancer by repeated fecal occult blood test in the Netherlands. BMC Gastroenterol 2009; 9(1): 28. doi: 10.1186/1471-230X-9-28.
9. Lo SH, Halloran S, Snowball J et al. Colorectal cancer screening uptake over three biennial invitation rounds in the English bowel cancer screening programme. Gut 2015; 64(2): 282– 291. doi: 10.1136/ gutjnl-2013-306144.
10. Steel RJ, Kostorou I, McClements P et al. Effect of repeated invitations on uptake of colorectal cancer screening using faecal occult blood testing: analysis of prevalence and incidence screening. BMJ 2010; 341: c5531. doi: 10.1136/ bmj.c5531.
11. Zajac IT, Whibley AH, Cole SR et al. Endorsement by the primary care practitioner consistently impoves particitation in screening for colorectal cancer: a longitudinal analysis. J Med Screen 2010;17(1): 19– 24. doi: 10.1258/ jms.2010.009 101.
12. Senore C, Armaroli P, Silvani M et al. Comparing different strategies for colorectal cancer screening in Italy: predictors of patient’s participation. Am J Gastroenterol 2010; 105(1): 188– 198. doi:10.1038/ ajg.2009.583.
13. van Roon AH, Hol L, Wilschut JA et al. Advance notification letters increase adherence in colorectal vcancer screening: a population-based randomized trial. Prev Med 2011; 52(6): 448– 451. doi: 10.1016/ j.ypmed.2011.01.032.
14. Giorgi Rossi P, Grazzini G, Anti M et al. Direct mailing of feacal occult blood tests for colorectal cancer screening: a randomized population study from Central Italy. J Med Screen 2011; 18(3): 121– 127. doi:10.1258/ jms.2011.011009.
15. Zorzi M, De Ra F, Mantellini P et al. Screening for colorectal cancer in Italy: 2011– 2012 survey. Epidemiolo Prev 2015; 39 (3 Suppl 1): 93– 107.
16. Segnan N, Patnick J, von Karssa L. European guidelines for quality assurance in colorectal cancer screening and diagnosis. 1st ed. Luxembourg: Publications Office of the European Union 2010.
17. Binefa G, García M, Milà N. Colonoscopy quality assessment in a mass population screening programme based on faecal occult blood test. Rev Esp Enferm Dig 2013; 105(7): 400– 408.
18. Chauvin P, Josselin JM, Heresbach D. The influence of waiting times on costeffectiveness: a case study of colorectal cancer mass screening. Eur J Health Econ 2014; 15(8): 801– 812. doi: 10.1007/s10198-013-0525-9.
19. Bobridge A, Cole S, Schoeman M et al. The National Bowel Cancer Screening Program – consequences for practice. Aust Fam Physician 2013; 42(3): 141– 145.
20. Berchi C, Guittet L, Bouvier V et al. Costeff ectiveness analysis of the optimal thresholdof an automated immunochemical test for colorectal cancer screening: performances of immunochemical colorectal cancer screening. Int J Technol Assess Health Care 2010; 26(1): 48– 53. doi:10.1017/ S0266462309990808.
21. Kuipers EJ, Rösch T, Bretthauer M et al. Colorectal cancer screening-optimizing current strategies and new directions. Nat Rev Clin Oncol 2013; 10(3): 130– 142. doi:10.1038/ nrclinonc.2013.12.
22. Terhaar sive Droste JS, Oort FA, van der Hulst RW et al. Higher fecal immunochemical test cutoff levels: lower positivity rates but still acceptable detection rates for early-stage colorectal cancers.Cancer Epidemiol Biomarkers Prev 2011;20(2): 272– 280. doi: 10.1158/ 1055-9965.EPI-10-0848.
23. Zavoral M, Vojtěchová G, Májek O et al. Populační screening kolorektálního karcinomu v České republice. Cas Lek Ces 2016;155(1): 7– 12.
24. Denters M, Deutekom M, Bossuyt P et al. Patient burden of colonoscopy after positive fecal immunochemical testing for colorectal cancer screening. Endoscopy 2013; 45(5): 342– 349. doi: 10.1055/s-0032-1326238.