Ketoanaloga esenciálních aminokyselin u pacientů s idiopatickými střevními záněty (IBD) a chronickým onemocněním ledvin (CKD) v přípravě na transplantaci ledviny
Vladimír Teplan Orcid.org 1,2,3
+ Pracoviště
Souhrn
V posledních desetiletích se významně zvýšil počet nemocných s idiopatickými střevními záněty (IBD) a současným závažným onemocněním ledvin, kteří musí být léčeni s ohledem na současné postižení obou orgánů. Při stabilizaci IBD se dostává po popředí otázka dalšího postupu léčby chronické renální insuficience a následně náhrady funkce ledvin (dialýza, transplantace ledviny). Tento postup v sobě zahrnuje konzervativní léčbu modifikovanou dietou s redukcí příjmu proteinů spolu s podáváním ketoanalog esenciálních aminokyselin, který umožnuje dlouhodobou přípravu k nejefektivnější léčbě selhání funkce ledvin – preemptivní transplantaci ledviny (tj. transplantace ledviny před zahájením pravidelné dialyzační léčby při úrovni měřené glomerulární filtrace < 0,16 ml/s) ze živého či kadaverózního dárce, a to při pokračující biologické léčbě. U pacientů s extenzivní ileocékální resekcí a ileostomií je třeba monitorovat parametry vodní a elektrolytové bilance, jejíž poruchy by závažně přispěly s progresi renální insuficience. V našich předchozích studiích u více než 3 000 renálních nemocných bylo prokázáno, že pacienti mohou velmi dobře a dlouhodobě tolerovat modifikovanou dietu doplněnou ketoanalogy esenciálních aminokyselin. Při současném postižení gastrointestinálního traktu je však třeba v závislosti na dynamice onemocnění volit individuální postup, abychom předešli riziku skryté malnutrice.
Klíčová slova
idiopatické střevní záněty, chronické onemocnění ledvin, ketoanaloga esenciálních aminokyselin, transplantace ledviny
Úvod
V současné době přibývá pacientů s idiopatickými střevními záněty (IBD) se současným onemocněním ledvin. Zánětlivá onemocnění střev (IBD – inflammatory bowel disease) jsou řazena mezi imunitně mediované choroby. IBD zahrnují Crohnovu chorobu (CN), ulcerózní kolitidu (UC) a blíže neklasifikované IBD [1,2]. Jde o choroby, které jsou často doprovázeny extraintestinálními komplikacemi; mezi nejčastější mimostřevní postižené lokality patří kůže, oči, klouby, játra a žlučové cesty [3], ale také ledviny a močové cesty [4,5].
U komplikované formy CN s postižením terminálního ilea a následnou malabsorbcí žlučových solí a mastných kyselin dochází ke zvýšené absorpci oxalátů ze střeva (enterická hyperoxalurie) a spolu se změněnou permeabilitou střevní sliznice a opakovanými atakami průjmů (s nízkým objemem moči a ztrátami magnezia) se zvyšuje riziko tvorby močových kamenů [6,7]. Mohou být přítomny renální koliky, blokády močovodu s průvodní infekcí močových cest a močové píštěle. Velmi významné je i posouzení vlivu dlouhodobého podávání mesalazinu (5-ASA) na rozvoj tubulointersticiální nefritidy (TIN), ať již toxoalergické, či nefrotoxické etiologie, které může být spojeno se závažným poškozením renální funkce. Relativně častý je i nález AA amyloidózy při dlouhodobém zánětlivém procesu. V současné době se dostává do popředí zájmu výskyt různých forem glomerulonefritid (GN) při IBD v přímé souvislosti s imunitní aktivitou onemocnění. Nejfrekventnější je mesangioproliferativní GN s depozity imunoglobulinu A (IgA nefropatie Berger). Není vyloučeno ani poškození typu akutní GN při akutní exacerbaci střevního zánětlivého procesu. Poškození ledvin se může projevovat sníženou funkcí ledvin (glomerulární filtrace, koncentrační a acidifikační funkce ledvin) a rozvojem proteinurie, někdy až nefrotického charakteru. Specifická situace je u nemocných s IBD na biologické léčbě se současně závažným postižením ledvin (včetně TIN), kdy je z nefrologického hlediska indikována imunosupresivní léčba kalcineurinovými inhibitory (cyklosporin, tacrolimus), mykofenolát mofetilem či azatioprinem a kortikoidy [8,9].
Ledvinné onemocnění může dospět do stadia chronické renální insuficience či dokonce chronického selhání ledvin s řadou průvodních metabolických poruch. Významně k této situaci může ale přispět i dysbalance vodní a elektrolytové rovnováhy při průjmech či ztrátě tekutin a iontů ze stomie. Zde se jedná o mechanizmus nasedajícího akutního ledvinného poškození vedoucího při delším působení též k akcentaci poškození chronického či jeho vzniku de novo [10].
Postižení střev u chorob ledvin
Chronické selhání ledvin patří mezi nejčastější akutní i chronické stavy související s porušenou strukturální i funkční integritou intestinální epiteliální bariéry [11]. Intestinální mikroflóra není v posledním desetiletí chápána jen jako potenciální hrozba, ale spíše jako nezbytná součást střevní bariéry. Střevní mikroflóra má funkci ochrannou (vytěsnění patogenů, tvorba antimikrobiálních látek), strukturní (posílení těsných spojení, indukce tvorby sIgA) a metabolickou (syntéza vitaminů K, B12, niacin, biotin, kyselina listová). Za normálních okolností není možný transcelulární průnik bakterií přes mechanickou ochranu hlenové vrstvy. Střevní sliznici tvoří lamina propria a vrstva polarizovaných epiteliálních buněk spojených apikálním junkčním komplexem. Apikální junkční komplex sestává z tzv. těsných spojení (TJ – tight junctions) na luminální straně bariéry, na které naléhají adherenční apikální junkce. Těsná spojení jsou svými proteiny (klaudin, occludin) zakotvena do intracelulární aktinomyozinové intracelulární sítě. Některé typy klaudinu představují receptory pro bakteriální enterotoxiny – např. klaudin 3 a 4 pro enterotoxiny Clostridium perfringens [12]. V chronickém selhání ledvin dochází k porušení dynamické rovnováhy intestinální epiteliální bariéry, epiteliální buňky produkují prozánětlivé cytokiny a reaktivní formy kyslíku, což vede k otevření paracelulárních TJ a k aktivaci subepiteliálních imunitních buněk [13]. Příčinou postižení střev vznikajícího při chronickém onemocnění ledvin je porušená imunita, která znamená zvýšené riziko zánětlivých a infekčních střevních komplikací a poruchy hemokoagulace, které při ledvinném selhání spolu s opakovanou heparinizací nutnou při hemodialýze znamenají zvýšené riziko krvácení do dolních partií GIT i při nevelké střevní lézi, ať už je to zánět, slizniční eroze, či vředy.
Některá onemocnění střev jsou vázána na dobu vzniku závažné chronické renální insuficience. Jsou to onemocnění, která vídáme i v běžné populaci ve vyšším věku. Souvisí s ischemickým poškozením střevní sliznice při změnách cév zásobujících příslušnou oblast. Vzhledem k tomu, že věk nemocných s chronickým onemocněním ledvin se stále zvyšuje, a to u nás i celosvětově, je pravděpodobné, že se na zvýšeném výskytu ischemických střevních lézí podílí oba faktory – věk nemocného i ledvinné selhání.
Některá onemocnění tenkého a tlustého střeva jsou u nemocných s chronickou renální insuficiencí častější než u běžné populace. Je to především divertikulóza tračníku, která se vyskytuje především ve spojení s polycystickou chorobou ledvin. Závažnou komplikací je divertikulitida, jejíž diagnóza je někdy obtížná, zvláště u seniorů vyšších věkových kategorií. Výskyt ischemického postižení střev má v posledních desetiletích stoupající tendenci. Toto zjištění není nijak překvapivé, vezmeme-li v úvahu stoupající věk nemocných. Věk a chronické onemocnění ledvin tak představují rizikové faktory pro akcelerovaný rozvoj aterosklerózy a kardiovaskulárních komplikací, zvláště pak u diabetiků. Ischemická kolitida je dávána do souvislosti i se změnami TK a možnými hypotenzemi při hemodialýze, zejména při preexistující ateroskleróze. Nejcitlivější místo pro poškození cévního zásobení je lienální flexura a sigmoideum [8].
Tito nemocní mohou být úspěšně léčeni biologickou terapií, ale současně je třeba respektovat léčebný postup pro nemocné s významně sníženou funkcí ledvin. Údobí tzv. konzervativní léčby chronického onemocnění ledvin ve stadiu CKD 3–5 je dlouhodobé a vyžaduje dietní i léčebnou strategii, která se vzájemně doplňuje. Pacienti tak mohou být včas připraveni na další léčebný postup, který bývá završen úspěšnou transplantací ledviny [14]. Významnou součástí léčby chronického onemocnění ledvin je dlouhodobé podávání ketoanalog esenciálních aminokyselin. O léčebném efektu této modifikace bylo opakovaně referováno a sami jsme dlouhodobě sledovali více než 3 000 nefrologických pacientů s touto léčbou. V současné době však nejsou dostatečně známa data o dlouhodobém podávání ketoanalog esenciálních aminokyselin a biologické léčby u nemocných s IBD. Při současném postižení gastrointestinálního traktu je však třeba v závislosti na dynamice onemocnění volit individuální postup, abychom předešli riziku skryté malnutrice.
Konzervativní léčení chronické renální insuficience
Konzervativním léčením rozumíme postupy spočívající v úpravě či příznivém ovlivňování metabolických a funkčních odchylek při chronické renální insuficienci a selhání ledvin cestou dietní a medikamentózní (v časných stadiích především léčba hypertenze).
Je důležité zahájit konzervativní léčebné postupy již v časném stadiu snížení renálních funkcí v době, kdy hladina sérového kreatininu je jen lehce zvýšena (dosáhne hodnoty kolem 150 µmol/l, stadium G3) tak, aby všemi dostupnými léčebnými postupy byla zpomalena progrese chronického renálního onemocnění a byly upraveny již přítomné metabolické odchylky spojené se sníženou funkcí ledvin. Měla by být také objasněna etiologie základního onemocnění, které by mohlo být přímo léčebně ovlivnitelné [15].
Dříve než se nemocní dostanou do pokročilého stadia, je třeba rozhodnout o dalším léčebném postupu, a tedy k zařazení do dialyzačně-transplantačního programu, u IBD mladších pacientů přednostně formou preemptivní transplantace. V souladu s legislativou ČR je možné indikovat k transplantaci ledviny pacienty s chronickým selháním ledvin stadia G5, kteří mají úroveň měřené glomerulární filtrace (GF) < 0,16 ml/s, ale kteří ještě nemusí být v pravidelném dialyzačním programu. Transplantaci lze provést ledvinou získanou od živého dárce či v rámci čekací listiny (waiting list) od dárce kadaverózního.
Konzervativní léčba tak prodlužuje čas přípravy nutný k založení AV zkratu či peritoneálního katétru (v případě hemodialýzy či peritoneální dialýzy), ale především čas pro přípravu k zařazení do čekací listiny k transplantaci ledviny včetně preemptivní transplantace ze živého či kadaverózního dárce [16,17].
Hlavní zásady dietoterapie
Dietologická úprava příjmu bílkovin a energie je určována individuálně podle stupně snížení renálních funkcí a metabolického stavu nemocného (tab. 1, 2).
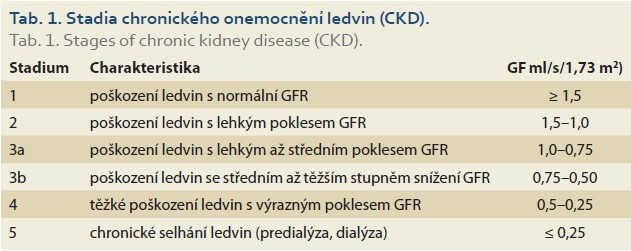
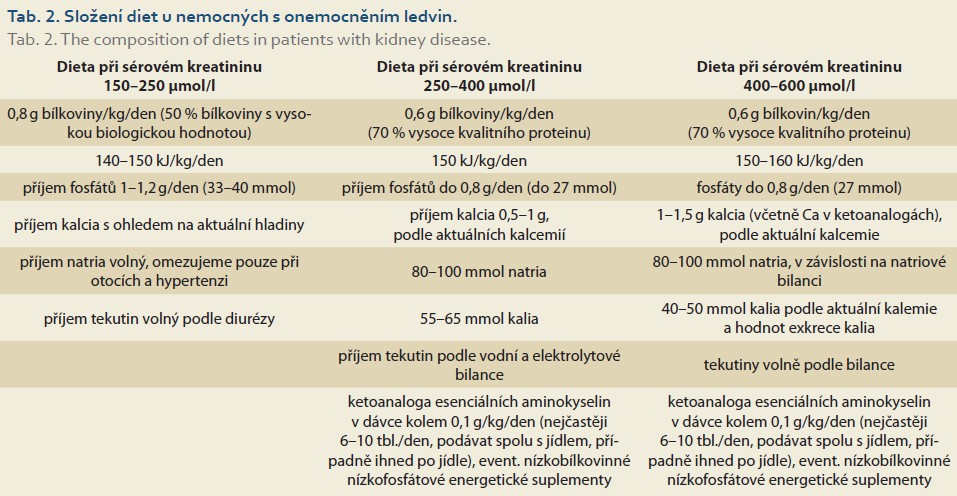
Množství přijímaného proteinu se zvyšuje o hodnotu přítomné proteinurie.
Metabolický účinek diet se sníženým příjmem proteinů
Je zřejmé, že příznivý účinek adekvátní redukce příjmu proteinů se odehrává ve více rovinách. První je vliv na progresi renální insuficience. Další velmi významnou rovinou je metabolický účinek nízkobílkovinné diety – především individuálně sestavené – na metabolické poruchy provázející chronickou renální insuficienci. S tím souvisí i příznivý vliv takto sestavené diety na další metabolické poruchy již přímo nesouvisející s renální insuficiencí. V neposlední řadě představuje dietní režim i významnou složku edukační, kdy pacient aktivně spolupracuje s lékařem a nutriční terapeutkou, která je nezbytně nutná pro dlouhodobou adherenci k dietě [18,19].
Důležité je poznání, že účinnou a adekvátní modifikaci nízkobílkovinné diety je třeba zahájit dříve, než nemocný dospěje do dekompenzovaného terminálního renálního selhání. O charakteru nízkobílkovinné diety rozhoduje vedle množství obsažené bílkoviny také její složení. Z tohoto hlediska má velký význam zastoupení bílkovin s vysokou biologickou hodnotou (živočišné bílkoviny). Tyto bílkoviny obsahují vysoké procento esenciálních aminokyselin a měly by tvořit v závislosti na celkovém příjmu proteinů 50–70 % z celkového zastoupení bílkovin. Rostlinné bílkoviny obsahují značné množství méně kvalitního proteinu (s nízkým zastoupením esenciálních aminokyselin a relativně vysokým zastoupením neesenciálních aminokyselin) [20].
Metabolické studie opakovaně prokazují, že pro dlouhodobou dietní léčbu nemocných v chronické renální insuficienci je nutné zajistit denní příjem bílkovin minimálně kolem 0,6–0,7 g/kg/den s vysokým zastoupení bílkovin s vysokou biologickou hodnotou. Pojem biologická hodnota bílkovin vyjadřuje podíl, v jakém je použitá bílkovina využita pro syntézu tkáňových proteinů. Biologická hodnota je tedy úměrná poměru esenciálních a neesenciálních aminokyselin. Zároveň musí být přítomny všechny nezbytné neesenciální bílkoviny a koncentrace každé esenciální aminokyseliny musí odpovídat její minimální denní potřebě. Nejvyšší biologickou hodnotu mají bílkoviny vajec, mléka, masa a brambor. Minimální denní potřeba esenciálních aminokyselin byla stanovena pro zdravé osoby a z tohoto schématu vycházejí některé suplementační přípravky esenciálních aminokyselin a jejich ketoanalog.
Pro efektivní podávání nízkobílkovinných diet je nezbytné zajistit adekvátní energetický příjem, který činí u seniorů kolem 130 kJ/kg/den (min. 30 kcal/kg/den). Tyto nálezy byly potvrzeny nepřímou kalorimetrií při dlouhodobé studii nemocných v chronické renální insuficienci. Při výpočtu je třeba respektovat ideální tělesnou hmotnost nemocných.
Příliš nízký energetický příjem je častější příčinou proteino-energetické malnutrice než samotná redukce příjmu bílkovin. Při katabolizujícím onemocnění stoupá potřeba energie a dosahuje 140–150 kJ/kg/den. Též hladina plazmatických aminokyselin, především esenciálních, je úzce závislá na adekvátním příjmu energie. Pozorovaný pokles plazmatické hladiny aminokyselin při zvýšeném příjmu energie je přechodného charakteru a souvisí se zvýšeným anabolizmem. Energetická potřeba nemocných v chronické renální insuficienci odpovídá přibližně zdravým jedincům [21].
Velmi důležitou roli v působení nízkobílkovinné diety má tzv. compliance. Pojmem compliance rozumíme dobrou prosperitu nemocných při daném typu diety.
Compliance je podmíněna složkou objektivní danou typem nízkobílkovinné diety s ohledem na stupeň renální insuficience, její klinické a laboratorní projevy a habitus nemocného. Stejně je ovlivněna složkou subjektivní, to je aktivní spoluprací nemocného při dlouhodobém dodržování dietologického režimu.
Zásadní význam hrají i psychologické faktory, především zájem nemocného na dietě (oddálení ledvinného selhání, podpora rodiny, odborné vedení nutriční terapeutkou a erudovaným lékařem).
Kontraindikace pro dlouhodobé podávání nízkobílkovinné diety jsou [22]:
- dekompenzovaní nemocní (malnutrice, kardiální selhávání, hepatorenální postižení apod.);
- nemocní s již přítomnými uremickými komplikacemi (polyneuropatie, perikarditida, medikamentózně nekorigovatelná hypertenze, těžká metabolická acidóza);
- nemocní s těžkými známkami dysbalance vody a elektrolytů;
- nemocní se špatnou compliancí k dietní léčbě.
Podávání esenciálních aminokyselin a jejich ketoanalog
V chronické renální insuficienci byly opakovaně dokumentovány nálezy abnormálních hladin některých aminokyselin v plazmě a kosterním svalu. Bývají zjišťovány nízké koncentrace především esenciálních aminokyselin, zatímco hladina některých neesenciálních bývá zvýšena [23].
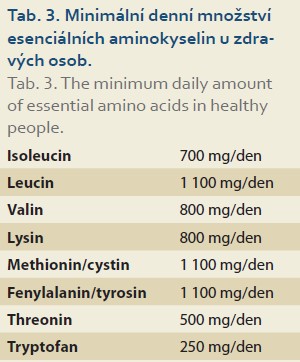
Použití esenciálních aminokyselin a jejich ketoanalog v klinické praxi je těsně spojeno se stanovením minimálního denního potřebného množství esenciálních aminokyselin u zdravých osob. Zjištěné hodnoty jsou uvedeny v tab. 3.
Významným pokrokem bylo nahrazení plnohodnotných esenciálních aminokyselin jejich keto- a hydroxyanalogy (KA). Uskutečněné studie využily mechanizmu reverzibilní transaminace vybraných esenciálních aminokyselin. Podáváním bezdusíkatých „uhlíkových skeletů“ esenciálních aminokyselin ve formě jejich keto- a hydroxynalogů vedlo jak k výraznému snížení příjmu exogenního dusíku do organizmu, tak k využití části dusíku retinované močoviny k aminaci těchto aminokyselin [24,25].
U nás dostupné přípravky mají keto- analoga vázána ve formě kalciových solí, což znamená při obsahu např. 50 mg kalcia v 1 tbl. nezanedbatelný přísun kalcia.
Velikost dávky ketoanalog a esenciálních aminokyselin je závislá na bílkovinném složení diety, hmotnosti nemocného a jeho nutričním stavu. Při neselektivní nízkobílkovinné dietě obsahující 0,6 g bílkovin/kg/den se udává dávka 0,1–0,2 g aminokyselin/kg/den. Minimální dávka nezbytná k udržení dusíkové rovnováhy při naší dietě činila 4,8 g/den [26].
Celkový příjem bílkovin (net protein intake) včetně aminokyselin nesmí dlouhodobě klesnout < 0,7 až 0,8 g/kg TH/den.
Kontraindikace v podávání ketoanalog jsou hyperkalcemie, uremická gastrointestinální symptomatologie a těžká jaterní léze. Pro nedostatek klinických zkušeností se nedoporučuje podávat přípravek v těhotenství.
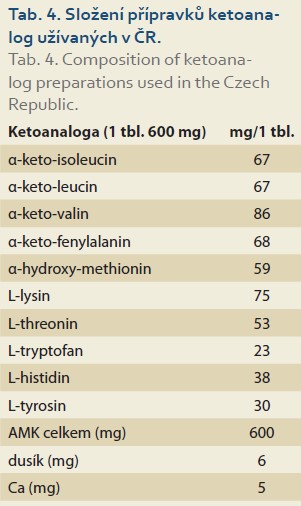
Složení ketoanalog je uvedeno v tab. 4.
Při metabolizaci aminokyselin je prvním krokem transaminace na odpovídající ketokyseliny, který probíhá v játrech. Tento pochod je reverzibilní, což má zásadní význam při užití ketoanalog esenciálních aminokyselin. Umožnuje tak příslušným ketokyselinám nahradit základní aminokyseliny v bílkovinách diety. Konečným produktem oxidace leucinu a izoleucinu je acetyl CoA, který může sloužit jako základní zdroj pro syntézu mastných kyselin. Při neúplné oxidaci leucinu vzniká hydroxymetyl-glutaryl-CoA, základní prekurzor cholesterolu. Valin se metabolizuje na sukcinyl CoA – intermediální metabolit Krebsova cyklu, který má glykogenní účinek. Důležitý je zejména vztah alaninového a glutaminového metabolizmu k metabolizmu rozvětvených aminokyselin. Rozvětvené aminokyseliny jsou zdrojem alfa-amino-dusíku pro syntézu glutaminu a alaninu. Alanin je přenašečem aminoskupin mezi kosterními svaly a játry, takže je možno říci, že rozvětvené aminokyseliny regulují sekundárně přenos alfa-amino-dusíku mezi periferními a viscerálními tkáněmi. Glutamin je přenašečem aminoskupin mezi kosterními svaly a ledvinami. Alanin a glutamin jsou také klíčovými substráty pro glukoneogenezi. Všechny tři rozvětvené aminokyseliny mají regulační vliv na proteinový metabolizmus ve smyslu poklesu katabolizmu a tendenci k proteosyntéze. Největší protein šetřící účinek byl popsán u ketoanalogu leucinu. Vysoké koncentrace rozvětvených aminokyselin inhibují glukogenezi.
Významným pokrokem bylo nahrazení plnohodnotných esenciálních aminokyselin jejich keto- a hydroxyanalogy (KA). Uskutečněné studie využily mechanizmu reverzibilní transaminace vybraných esenciálních aminokyselin. Podáváním bezdusíkatých „uhlíkových skeletů“ esenciálních aminokyselin ve formě jejich keto- a hydroxyanalogů vedlo jak k výraznému snížení příjmu exogenního dusíku do organizmu, tak k využití části dusíku retinované močoviny k aminaci těchto aminokyselin. Formou ketoanalog byly podávány aminokyseliny leucin, izoleucin, valin, fenylalanin a methionin. Ostatní esenciální aminokyseliny byly podávány ve své L-formě (lyzin, treonin a tryptofan), neboť jejich aminace v organizmu byla metabolicky náročná a méně efektivní. V sestavě aminokyselin byly doplněny histidin a tyrozin. V našich podmínkách nebyly většinou prokázány snížené hladiny histidinu, ale jeho využitelnost vázne. Histidin významně zlepšuje dusíkovou bilanci a podílí se i na stabilizaci krevního obrazu.
Zatímco minimální denní potřeba esenciálních aminokyselin pro zdravé osoby byla stanovena již před 40 lety, není otázka adekvátní úhrady esenciálních aminokyselin u nemocných v chronické renální insuficienci dodnes zcela vyřešena.
Vedle ketoanalog lze podávat u nemocných v chronické renální insuficienci při nízkobílkovinné dietě též přípravky esenciálních aminokyselin. Podání samotných aminokyselin se však dlouhodobě příliš neosvědčilo, neboť stejného účinku lze dosáhnout při menších nákladech přidáním malého množství biologicky vysoce hodnotné bílkoviny či lépe oligopeptidů (navíc je příjem většího množství aminokyselin spojen s nebezpečím prohloubení metabolické acidózy). Podáváme je krátkodoběji především tam, kde je porušena metabolická aktivace ketoanalog (aminace) – u nemocných s jaterní lézí, v těžkém metabolickém stavu, u diabetiků apod. Také tyto přípravky obsahují vedle osmi esenciálních aminokyselin histidin a tyrozin. Neobsahují kalcium [27].
Snížená funkce ledvin a metabolizmus aminokyselin
Poznatek o existenci poruchy metabolizmu bílkovin u nemocných s chronickým selháním ledvin má dlouholetou historii. V souladu s historickou tezí Giordana lze predikovat: pokud organizmus dostává denně dostatečné množství esenciálních aminokyselin, stává se limitujícím faktorem pro udržení dusíkové rovnováhy dusík pocházející z neesenciálních aminokyselin. Za těchto podmínek může být využito ke stavbě bílkovin i dusíku pocházejícího z močoviny. Utilizace dusíku urey u nemocných v chronické renální insuficienci může být relativně vysoká (30–40 %). Lepší využití aminokyselin při nedostatečném příjmu bílkovin je umožněno zvýšenou aktivitou proteosyntetických enzymů v játrech, snížením jejich oxidace a snížením aktivity enzymů ureového cyklu. Pro přepočet vyloučeného množství urey v moči na příjem bílkovin či aminokyselin je nutno vědět, že z 1 g bílkovin vzniká přibližně 5,5 mmol urey a 80 % vytvořené urey se vylučuje močí. K prakticky snadno dosažitelným indikátorům intenzity proteinového metabolizmu patří výpočet množství metabolizovaného (a za předpokladu vyrovnané metabolické bilance i přijatého) proteinu na podkladě množství urey vyloučené do moči v mmol za 24 hodin: (Uurea.V). 0,25 (za předpokladu, že se fekálně vylučuje u těchto nemocných kolem 0,031 g N/kg/den).
Spektrum aminokyselin v séru se při renální insuficienci zásadně mění. Snižují se koncentrace esenciálních aminokyselin (EAK) s výjimkou fenylalaninu. Koncentrace neesenciálních aminokyselin (NEAK) se většinou naopak zvyšuje. Snižuje se také poměr EAK: NEAK. Toto snížení je však výrazně ovlivňováno stavem nutrice. Vylučování aminokyselin do moči se při renální insuficienci podstatně nemění, což je způsobeno – při snížené glomerulární filtraci – zvýšenou frakční exkrecí aminokyselin [23].
Koncentrace aminokyselin v séru závisí na jejich intracelulárním metabolizmu. Koncentrace volných aminokyselin je v intracelulární tekutině podstatně vyšší, než je v tekutině extracelulární. Tyto aminokyseliny pak mohou být transportovány do extracelulárního prostoru (např. při poklesu sérových hladin aminokyselin při ztrátách vyvolaných hemodialýzou). Snížené hladiny rozvětvených esenciálních aminokyselin jsou jedním z typických nálezů u nemocných v chronické renální insuficienci. Také hladina serinu může být významně snížena, neboť ledviny jsou hlavním místem jeho tvorby. Mohou být ovlivněny hladiny dalších hydroxyaminokyselin (glycin a threonin). Hladina alaninu a glutaminu bývá většinou normální a tyto aminokyseliny představují v postdigestční fázi hlavní zdroj dusíku pro ledviny a splanchnické orgány. Jejich hladina je výrazně ovlivňována dietou stejně jako stupněm vychytávání (metabolizace) v uvedených orgánech [28].
Stejně tak se zvyšují hladiny některých aminokyselin ureového cyklu (především citrulinu, zatímco arginin zůstává většinou normální), aminokyselin obsahujících síru (cystinu, homocysteinu, event. cysteinu, zatímco hladina methioninu zůstává normální), prolinu, hydroxyprolinu a 3-metylhistidinu.
Pro malnutrici je typický pokles tělesné hmotnosti, tělesného tuku, svalové hmoty a intracelulární vody. Klesají hladiny albuminu, transferinu, cholinesterázy, komponent komplementového systému, především C3 složky. Stejně se snižují hladiny valinu, leucinu, izoleucinu, tryptofanu a tyrozinu, poměr celkových esenciálních aminokyselin k neesenciálním, valinu ke glycinu a tyrozinu k fenylalaninu, hladina glycinu je často zvýšena.
Tryptofan je jediná aminokyselina vázaná na bílkoviny séra a je mimořádně významná z hlediska zahájení proteosyntézy. Koncentrace tryptofanu v séru při CHRI bývá normální nebo lehce snížená. Mění se však poměr volného a vázaného tryptofanu. Koncentrace vázaného tryptofanu se snižuje, zvyšuje se koncentrace volného tryptofanu. Tryptofan je zdrojem indolových látek, jejichž koncentrace se v renální insuficience zvyšuje. Porucha metabolizmu fenylalaninu a tyrozinu je známa již delší dobu. Uvádí se, že zvýšená hladina fenylalaninu, jeho zpomalená metabolizace a snížený poměr tyrozinu k fenylalaninu může být způsobena jak snížením hladiny ledvinné fenylalaninhydroxylázy, tak změnou intra-extracelulární distribuce.
Je známou skutečností, že histidin je esenciální aminokyselinou pro nemocné v chronické renální insuficienci. Jeho plazmatické koncentrace bývají nízké buď pro sníženou syntézu jeho prekurzoru (kyselině imidasolpyrohroznové), nebo sníženou schopnost transaminovat tuto ketokyselinu (snížená aktivita transketolázy v chronické renální insuficienci).
Závažný příspěvek v hodnocení metabolického stavu nemocných v chronické renální insuficienci přinesly studie zabývající se intracelulární koncentrací aminokyselin, především ve svalové hmotě. Jak známo, kosterní svaly představují hlavní zásobní zdroj volných aminokyselin. V chronické renální insuficienci se mění extra-intracelulární distribuce některých aminokyselin, takže plazmatické hladiny nejsou odpovídajícím odrazem hladin intracelulárních. Tato skutečnost se např. týká pro metabolizmus velice důležitých tzv. rozvětvených aminokyselin, leucinu, izoleucinu a valinu. Při snížené plazmatické hladině těchto tří aminokyselin byly popsány normální intracelulární koncentrace leucinu a izoleucinu (valin byl snížen) a tyto rozdíly přetrvávaly i při dlouhodobé nízkobílkovinné dietě doplněné esenciálními aminokyselinami. Selektivní deplece valinu, a to přes vysoký příjem, ukazovala, že tato aminokyselina byla zvýšeně katabolizována a při uvedené suplementaci esenciálních aminokyselin vznikl mezi valinem a leucinem s izoleucinem tzv. aminokyselinový antagonizmus. Podobně byla zjištěna výrazně snížená intracelulární hladina tyrozinu při relativně zvýšené hladině plazmatické. Threonin byl nalezen snížený jak v plazmě, tak ve svalu. Naproti tomu aminokyseliny ureového cyklu – citrulin, ornitin a arginin – byly nalezeny zvýšené jak ve svalu, tak v séru.
Tryptofan je jediná aminokyselina vázaná na bílkoviny séra a je mimořádně významná z hlediska zahájení proteosyntézy. Koncentrace tryptofanu v séru při CHRI bývá normální nebo lehce snížená. Mění se však poměr volného a vázaného tryptofanu. Koncentrace vázaného tryptofanu se snižuje, zvyšuje se koncentrace volného tryptofanu. Tryptofan je zdrojem indolových látek, jejichž koncentrace se v renální insuficience zvyšuje.
Je tedy zřejmé, že syntéza bílkovin v chronické renální insuficienci může být výrazně limitována intracelulárním obsahem aminokyselin, především pak nízkou koncentrací valinu, threoninu a tyrozinu a u neléčených též histidinu.
Kontrola nemocných při dlouhodobém podávání modifikovaných nízkobílkovinných diet
Na úspěšnosti nízkobílkovinných diet (NB) diet se nepochybně podílí dlouhodobě vyrovnaná metabolická bilance nemocných, účinná léčba hypertenze a pravidelné kontroly konané v této fázi onemocnění lékařem nejméně jednou měsíčně.
Vedle základních laboratorních parametrů – kreatinin, urea, glomerulární filtrace, krevní obraz, sideremie, feritin či saturace transferinu, Na, K, Ca, P, kyselina močová, Astrup, glykemie, cholesterol, triacylglyceroly, močový sediment, bakteriurie, proteinurie/24 hodin – musíme pravidelně kontrolovat základní parametry nutrice, tj. albumin, transferin, event. aminogram (resp. Whiteheadův kvocient, tj. poměr neesenciálních aminokyselin gly+glu+ser+tau a esenciálních aminokyselin leu+ileu+val+met).
K základním údajům patří subjektivní pocit nemocného a jeho celková prosperita měřená antropometricky. Vedle tzv. adherence k dietě, kterou můžeme ověřit anamnesticky či lépe formou dotazníku, hodnotíme při nízkobílkovinné dietě tzv. compliance podle odpadu urey a fosfátů do moči za 24 hodin.
Nízkobílkovinná dieta, event. doplněná ketoanalogy esenciálních aminokyselin, představuje opakovaně deklarovanou součást konzervativní léčby u nemocných s chronickým onemocněním ledvin. Její realizace však vyžaduje nejen zkušený nutriční tým s nabídkou přijatelného dlouhodobého jídelníčku, ale i aktivní spolupráci pacientů motivovaných výsledkem zlepšení metabolického stavu a oddálení terminálního selhání ledvin. Motivace nemocných může být snížena neúplnou informací některých lékařů, především dialyzačních středisek, a také nedostatkem kvalifikovaných nutričních terapeutek. Také dlouhodobé dodržování omezující diety, i když individuálně upravené podle chuťových zvyklostí nemocných, může představovat u některých nemocných překážku v jejich životní prioritě plného žaludku. Pozitivní výsledky dietních studií byly získány v zemích, kde jsou stravovací kultura a kulinářství na vysoké úrovni (Francie, Itálie, Čína, Indie, Thajsko, Malajsie, Mexiko, Brazílie, Maďarsko, ale i ČR). Naopak v zemích fastfoodů (USA, UK) či velkých steaků (Austrálie, Nový Zéland, Argentina) se nízkobílkovinná, částečně vegetariánská dieta příliš neujala.
V našich předchozích studiích bylo prokázáno, že nemocní mohou velmi dobře tolerovat nízkobílkovinnou dietu doplněnou ketoanalogy esenciálních aminokyselin, která pomáhá dlouhodobě stabilizovat metabolický stav nemocných. Navíc při většinou dobré compliance je riziko skryté malnutrice nízké [18].
Naše zkušenosti v dietoterapii (reanalýza studie CEKAD)
V prospektivní randomizované, dvojitě slepé, placebem kontrolované multicentrické studii CEKAD (Central European Keto Amino Acid Diet) bylo sledováno po dobu 3 let celkem 300 nemocných ve stadiu CKD 3–4, diabetiků a nediabetiků, z čehož 100 nemocných bylo z ČR. Průměrný věk souboru činil 62 ± 6 let. Z těchto pacientů ve věku > 65 let pouze 7 mělo gastrointestinální onemocnění (1× CN, 2× UC, 4× divertikulární nemoc).
Následně byla provedena reanalýza dat s ohledem na diagnózu a věkové složení [15]. Soubor byl rozdělen na skupinu I (nemocní ve věku ≥ 65 let) a skupinu II kontrolní (nemocní < 65 let). Obě skupiny měly srovnatelnou vstupní úroveň GF 0,57–0,71 ± 0,32 ml/s. Při 3letém sledování jsme u skupiny I prokázali signifikantně vyšší pokles proteinurie a snížení TK ve srovnání s kontrolní skupinou II (p < 0,025). Bylo zachyceno i zpomalení progrese GF měřené Ckr a úprava parametrů sacharidového a lipidového metabolizmu (p < 0,05). Gastrointestinální onemocnění bylo stabilní bez specifické léčby. Compliance nemocných byla dobrá a adherence k dietě přesahovala 80 % (p < 0,02).
U sledovaných pacientů bylo při standardní nutriční kontrole dlouhodobé podávání modifikované nízkobílkovinné diety s ketoanalogy esenciálních aminokyselin bezpečné a účinné, a představuje tak alternativní léčebný postup (ve srovnání s dialyzační léčbou) u nemocných vyšších věkových kategorií se současným stabilním onemocněním GIT.
Diskuze
Komplexní léčebný program pacientů s IBD a chronickým onemocněním ledvin by měl zahrnovat v první fázi snížení funkce ledvin od úrovně G3b (při různých diagnózách) konzervativní postup spojený s dietní úpravou a dlouhodobým podáváním ketoanalog esenciálních aminokyselin. Současně je s ohledem na rychlost progrese renálního onemocnění pacient připravován do programu dialyzačně-transplantačního. Nejvýhodnější postup znamená přípravu k preemptivní transplantaci ledviny, a to ze živého dárce, která má nejlepší výsledky i díky tomu, že lze proces vyšetření a odběru dárce a transplantace příjemce nejlépe časově sladit. Dle současné legislativy lze preemptivně transplantovat i ledvinu odebranou u kadaverózního dárce za předpokladu stabilního příjemce s hodnotou GF < 0,16 ml/s. Jednoznačně upřednostňujeme postup včasné přípravy IBD příjemců k transplantaci před zahájením dialyzační léčby s teprve následným řešením přípravy pacienta k transplantaci. Postup přípravy může zahrnovat i operativní úpravu, např. ileostomie i IC anastomózy.
Data pojednávající o přípravě IBD pacientů na biologické léčbě k dialyzačně-tranplatačnímu programu jsou zatím ojedinělá. Dle nečetných publikovaných dat je výskyt IBD pacientů se závažným chronických onemocněním ledvin kolem 2 %.
Naprostou většinu renálních pacientů představují pacienti s CN [29]. V rakouské retrospektivní studii u 775 nemocných mělo chronické onemocnění ledvin ve fázi renální insuficience 11 nemocných s CN a žádný pacient s UC. Významným rizikovým faktorem byl rozsah resekce tenkého střeva a rekurentní urolitiáza s infekcí. V další studii u 251 nemocných s IBD, u kterých byla renální insuficience definována hodnotou GF < 60 ml/min (1 ml/s; 1,73 m2; stadium CKD 2–5), byl výskyt postižených pacientů s chronickou renální insuficiencí 10,34 % a akutního poškození ledvin (AKI) 5,56 % [30]. Signifikantními rizikovými faktory byly délka trvání IBD, přítomnost extraintestinálního postižení (především kloubní nálezy a primární sklerotizující cholangoitida), urolitiáza a věk nemocných.
V jihokorejské národní studii u 38 812 pacientů s IBD bylo ukázáno, že IBD představuje závažný rizikový faktor progrese renálního postižení [31]. Přítomné renální postižení je významně zhoršováno dehydratací a iontovou dysbalancí, malnutricí a možným nefrotoxickým účinkem užité léčby. Výskyt renální insuficience byl 5krát vyšší než u kontrolního souboru bez IBD. Z předpokládaných rizikových faktorů hraje u pacientů s CN významnou roli chronický systémový zánět při imunologickém postižení střevní stěny včetně infekce při střevních píštělích, urolitiáza s průvodní infekcí močových cest, glomerulopatie s akcentem na nejčastěji se vyskytující IgA GN (osa střevo–ledvina, genetická predeterminance DR 1) a rozvoj sekundární AA amyloidózy při chronické systémovém zánětu. Významně se může uplatňovat též rozvoj nealkoholické steatózy jater (NAFLD) spojený s proteinurií a progresí glomerulárního poškození.
Pacienti s další progresí renální insuficience jsou ve stadiu renálního selhání hemodialyzováni (peritoneální dialýza je spíše výjimečná) a při stabilizaci střevního nálezu připravováni k transplantaci ledviny [32]. V transplantované ledvině při trvající primární imunologické příčině vedoucí k renálnímu onemocnění se může objevit relaps onemocnění (např. IgA GN) [33]. U pacientů s UC je významně častěji prováděna transplantace jater (průvodní primární sklerotizující cholangoitida) či transplantace kombinovaná játra a ledvina [34].
Pro dlouhodobou funkci transplantovaných orgánů je velmi důležitá stabilizace IBD. Exacerbace průjmů spojené s dehydratací, iontovou dysbalancí, malnutricí a hypotenzí spojené s poruchou perfuze ledviny vždy významně ohrozí funkci ledviny transplantované (denervovaná ledvina s chybějící nervově-cévní autoregulací). Navíc se může uplatnit nefrotoxický vliv dlouhodobě podávaných léků (cyklosporin A, tacrolimus), jejichž koncentrace se při dehydrataci mnohonásobně zvyšují a mohou vést až k akutnímu selhání funkce štěpu.
U většiny transplantovaných nemocných s IBD při stabilním klinické stavu pokračuje biologická léčba při nezbytné léčbě imunosupresivní. Je doporučována záměna infliximabu či adalimumabu na vedolizumab či ustekinumab [2]. Standardní imunosupresivní léčba transplantovaného orgánu zahrnuje vedle redukované dávky kortikoidů kombinaci kalcineurinových inhibitorů cyklosporinu A, nyní většinou tacrolimu, mykofenolát mofetilu či historicky azatioprinu a v úvodní fázi basiliximabu. U imunologicky rizikových nemocných je podáván antithymocytární globulin. Při rejekčních epizodách vyšší dávky kortikoidů a monoklonálních protilátek.
Souběžná imunosupresivní a biologická léčba zvyšuje u IBD pacientů po transplantaci ledviny riziko závažné infekce systémové, a to jak bakteriální (včetně tuberkulózy), tak virové (cytomegalovirus, virus Epsteina a Barrové, BK nefropatie), mykotické či atypické (mykoplazma, pneumocysta). Proto musí být všichni pacienti s IBD po orgánové transplantaci pravidelně mikrobiologicky kontrolováni [35].
Ve studii zahrnující 1 537 IBD pacientů bylo 31 pacientů transplantováno (22 UC, 9 CN, 2 %), z nichž 24 mělo transplantaci jater, 6 z nich ledviny a 1 transplantaci srdce. Všichni byli léčeni kombinací kalcineurinových inhibitorů (tacrolimus či cyklosporin) a mykofenolát mofetilem. Následně dva pacienti s UC a jeden s CN byli léčení infliximabem, resp. adalimumabem a steroidy s azatioprinem pro relaps IBD. Při stabilním IBD nálezu jsou výsledky transplantací srovnatelné s pacienty bez IBD. Při relapsu onemocnění však je prognóza zhoršena [36,37].
Závěr
Konzervativní postup léčby pacientů v chronické renální insuficienci s IBD na biologické léčbě zahrnuje vedle dietních opatření i dlouhodobé podávání ketoanalog esenciálních aminokyselin, které významně přispějí ke stabilizaci metabolického stavu nemocných. Prodlouží a stabilizují renální funkci, umožní včasnou kvalitní přípravu k optimální preemptivní transplantaci ledviny. Klinicky jsou dobře tolerována a nikterak neinterferují s pokračující biologickou léčbou. U pacientů se ztrátami elektrolytů a vody průjmy je nutné dlouhodobě stabilizovat elektrolytovou a vodní bilanci. V indikovaných případech podáváme renální formule enterální výživy. To je zvláště důležité u pacientů s ileostomií, kdy musí být situace včas individuálně posouzena, včetně možné operativní úpravy již předtransplantačně.
ORCID autora
V. Teplan ORCID 0000-0001-7717-6686.
Doručeno/Submitted: 8. 3. 2022
Přijato/Accepted: 15. 3. 2022
prof. MUDr. Vladimír Teplan, DrSc.
Klinické a výzkumné centrum pro střevní záněty
Klinické centrum ISCARE a. s. a 1. LF UK v Praze
Českomoravská 2510/19
190 00 Praha
teplan@iscare.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Lukáš M, Bortlík M, Ďuricová D et al. Pokroky v diagnostice a léčbě idiopatických střevních zánětů. Praha: Galen 2019.
2. Teplan V, Honsová E, Lukáš M. Renální onemocnění pacientů s idiopatickými střevními záněty. Gastroent Hepatol 2020; 74(3): 256–266. doi: 10.14735/amgh2020256.
3. Marečková O. Poruchy gastrointestinálního traktu u chorob ledvin. In: Teplan V. Metabolismus a ledviny. Praha: Grada 2000: 147–157.
4. Garber A, Regueiro M. Extraintestinal manifestastions of inflammatory bowel disease: epidemiology, etiopathogenesis, and management. Curr Gastroenterol Rep 2019; 21(7): 31. doi: 10.1007/s11894-019-0698-1.
5. Annese V. A review of extraintestinal manifestation and complications of inflammatory bowel disease. Saudi J Med Med Sci 2019; 7(2): 66–73. doi: 10.4103/sjmms.sjmms_81_18.
6. Teplan V. Nefrologické komplikace idiopatických střevních zánětů. In: Lukáš M, Andrášová M, Ďuricová D et al. Idiopatické střevní záněty. Nové trendy a mezioborové souvislosti. Praha: Grada 2020: 117–135.
7. Teplan V, Marečková O, Lukáš M. Onemocnění gastrointestinálního traktu a choroby ledvin. Gastroent Hepatol 2018; 72(1): 50–57. doi: 10.14735/amgh201850.
8. Corica D, Romano C. Renal involvement in inflamatory bowel diseases. J Crohns Colitis 2016; 10(2): 226–235. doi: 10.1093/ecco-jcc/jjv138.
9. Ambruzs JM, Larsen CP. Renal manifestation of inflammatory bowel disease. Rheum Dis Clin North Am 2018; 44(4): 699–714. doi: 10.1016/j.rdc.2018.06.007.
10. Marečková O. Gastroenterologické komplikace u seniorů s onemocněním ledvin. In: Teplan V, Honsová E, Horáčková M et al. Nefrologie vyššího věku. Praha: Mladá fronta 2015: 177–191.
11. Wang F, Jiang H, Shi K et al. Gut bacterial traslocation is associated with microinflammation in end-stage renal disease patiens. Nephrology (Carlton) 2012; 17(8): 733–738. doi: 10.1111/j.1440-1797.2012.01647.x.
12. Polak P, Jurankova J, Husa P. Struktura a funkce intestinální epiteliální bariery. Gastroenterol Hepatol 2013; 67(6): 494–497.
13.Vaziri ND, Goshtasbi N, Yuan J et al. Uremic plasma impairs barrier function and depletes the tight junction protein constituents of intestinal epithelium. Am J Nephrol 2012; 36(5): 438–443. doi: 10.1159/000343886.
14. Teplan V, Valkovský I, Teplan V Jr et al. Nutritional consequences of renal transplantation. J Ren Nutr 2009; 19(1): 95–100. doi: 10.1053/ j.jrn.2008.10.017.
15. Druml W, Cano N, Teplan V. Nutritional support in renal disease. In: Sobotka L. Basics in clinical nutrition. Praha: Galen 2019: 422–433.
16. Toigo G, Aparicio M, Attman PO et al. Consensus report: Expert Working Group report on nutrition in adult patients with renal insufficiency (part 1 of 2). Clin Nutr 2000; 19(3): 197–207. doi: 10.1054/clnu.1999.0130.
17. Toigo G, Aparicio M, Attman PO et al. Consensus report: Expert Working Group report on nutrition in adults patients with renal insufficiency (part 2 of 2). Clin Nutr 2000; 19(4): 281–291. doi: 10.1054/clnu.2000.0129.
18. Teplan V. Suplementované restriktivní diety u nemocných vyššího věku s onemocněním ledvin. Vnitř Lék 2016; 62(Suppl 6): 88–96.
19. Ikizler TA, Cano NJ, Franch H et al. Prevention and treatment of protein energy casting in chronic kidney disease patiens: a consensus statement by the International Society of Renal Nutrition and Metabolism. Kidney Int 2013; 84(6): 1096–1107. doi: 10.1038/ki.2013.147.
20. Kalantar-Zadeh K, Cano MJ, Budde K et al. Diets and enteral supplements for improving outcomes in chronic kidney disease. Nat Rev Nephrol 2011; 7(7): 369–384. doi: 10.1038/nrneph.2011.60.
21. Teplan V, Mengerová O. Dieta a nutriční opatření u chorob ledvin a močových cest. Praha: Mladá Fronta 2010.
22. Teplan V. Klinická výživa u pacientů s onemocněním ledvin. In: Kohout P, Havel E, Matějovič M et al. Klinická výživa. Praha: Galen 2021: 663–684.
23. Aparicio M, Bellizzi V, Chauveau P et al. Keto acid therapy in predialysis chronic kidney disease patiens: final consensus. J Ren Nutr 2012; 22(Suppl 2): S22–24. doi: 10.1053/j.jrn.2011.09.006.
24. Teplan V. Pharmacological features of a keto amino acids. Am J Nephrol 2005; 25(Suppl 1): S13–S14.
25. Fouque D, McKenzie J, Mutsert R et al. Use of a renal specific oral suplement by hemodialysis patiens with low protein intake does not increased the need for fosphate binders and my prevent a decline in nutritional status and quality of life. Nephrol Dial Transplant 2008: 23(9): 2902–2910. doi: 10.1093/ndt/gfn131.
26. Teplan V. Keto/Amino acids in the treatment of chronic kidney disease patients: 30 years experience in 3.000 patients. Am J Nephrol 2005; 25(Suppl 1): S8–S10.
27. Teplan V. Metabolismus a ledviny. Praha: Grada 2000.
28. Holeček M. Aminokyseliny ve zdraví a nemoci. Praha: Grada 2022.
29. Primas C, Novacek G, Schweiger K et al. Renal insufficiency in IBD – prevalence and possible pathogenetic aspects. J Crohns Colitis 2013; 7(12): 630–634. doi: 10.1016/j.crohns. 2013.05.001.
30. Lewis B, Mukewar S, Lopez R et al. Frequency and risk factors of renal insufficiency in inflammatory bowel disease in patients. Inflamm Bowel Dis 2013; 19(9): 1846–1851. doi: 10.1097/MIB.0b013e31828a661e.
31. Park S, Chun J, Han KD et al. Increased end-stage renal disease risk in patients with inflammatory bowel disease: a nationwide population-based study. World J Gastroenterol 2018; 24(42): 4798–4808. doi: 10.3748/wjg.v24.i42.4 798.
32. Chiba M, Tsuda S, Tsuji T et al. Crohn disease successfully treated with Infliximab in a patient receiving hemodialysis. Medicine 2014; 93(7): e54. doi: 10.1097/MD.0000000000000054.
33. Hasegawa M, Sasaki H, Takahashi K et al. Reccurent IgA nephropathy complicated with Crohn’s disease after renal tranplantation. CEN Case Rep 2014; 3(2): 167–171. doi: 10.1007/s13730-014-0111-8.
34. Indriolo A, Ravelli P. Clinical management of inflammatory bowel disease in the organ recipient. World J Gastroenterol 2014; 20(13): 3525–3533. doi: 10.3748/wjg.v20.i13.3 525.
35. Grupper A, Schwartz D, Baruch R et al. Kidney transplantation in patients with inflammatory bowel disease (IBD): analysis of transplantation outcome in IBD activity. Transpl Int 2019; 32(7): 730–738. doi: 10.1111/tri.13415.
36. Schnitzler F, Friedrich M, Stallhofer J et al. Solid organ transplantation in patients with inflammatory bowel disease (IBD): analysis of transplantation outcome and IBD activity in a large single center cohort. PLoS One 2015; 10(8): e0135807. doi: 10.1371/journal.pone.0135 807.
37. Pittman ME, Jessurun J, Yantiss RK. Differentiating posttransplant inflammatory bowel disease and other colitides in renal transplant patients. Am J Surg Pathol 2017; 41(12): 1666–1674. doi: 10.1097/PAS.0000000000000921.