Imunoablační léčba a autologní transplantace hematopoetických kmenových buněk u pacienta s agresivní formou Crohnovy nemoci refrakterní na medikamentózní terapii
Veronika Hrubá1, Dana Ďuricová Orcid.org 1, Šárka Rahmatová2, Naděžda Machková Orcid.org 1, Martin Bortlík Orcid.org 1,3,4, Martin Lukáš Orcid.org 1, Milan Lukáš Orcid.org 1, Katarína Mitrová Orcid.org 1,5, Martin Horák Orcid.org 6, Tomáš Kozák Orcid.org 7, Jan Novák Orcid.org 8,9
+ Pracoviště
Souhrn
I přes pokroky v léčbě Crohnovy nemoci stále existují případy nemocných refrakterních na imunosupresivní a biologickou terapii. Mezi nové metody léčby pro refrakterní případy se řadí imunoablační terapie s autologní transplantací hematopoetických kmenových buněk. Případ prvního pacienta, který v České republice podstoupil tuto léčbu, popisuje naše kazuistika. Pacient, 37letý muž, v minulosti po čtyřech resekčních výkonech, s přetrvávající aktivitou nemoci i přes intenzifikovanou protizánětlivou terapii, podstoupil v květnu až červenci 2014 na Interní hematologické klinice 3. LF UK a FN Královské Vinohrady imunoablační terapii s transplantací hematopoetických kmenových buněk.
Klíčová slova
Crohnova nemoc, autologní transplantace hematopoetických kmenových buněkCrohnova nemoc (CN) je chronické zánětlivé onemocnění, které může postihnout libovolnou část trávicího traktu s řadou střevních i mimostřevních projevů. Patogeneze onemocnění dosud nebyla zcela objasněna, předpokládá se patologická odpověď imunitního systému geneticky predisponovaného jedince na faktory zevního prostředí.
I když v současnosti existuje řada účinných protizánětlivých léků, jako jsou kortikoidy, imunosupresiva a hlavně biologická terapie, zhruba 10 % nemocných je refrakterních nebo netoleruje uvedenou léčbu. Chronický charakter onemocnění s častými relapsy, nutností opakované chirurgické intervence s rizikem vzniku syndromu krátkého střeva či s mimostřevními projevy zhoršují kvalitu života, vyžadují časté hospitalizace, mohou vést k podvýživě či poruše růstu u dětí a v neposlední řadě k invaliditě nemocného.
Vysokodávkovaná chemoterapie s podporou autologních hematopoetických kmenových buněk (autologous hematopoietic stem cell transplantation – ASCT) je standardní metodou v léčbě některých hematologických malignit a byla popsána jako účinná léčba u některých nenádorových autoimunitních onemocnění, jako je např. roztroušená skleróza, systémová sklerodermie, systémový lupus erythematodes či diabetes mellitus I. typu. Při použití této metody u autoimunitních onemocnění se vžil název „imunoablační terapie“. Myšlenka ASCT u pacientů s CN vznikla na základě pozorování nemocných s CN, kteří podstoupili ASCT pro hematologické maligní onemocnění a současně u nich došlo k dlouhodobé remisi jejich střevního onemocnění. V posledních 15 letech bylo touto metodou v zahraničí úspěšně léčeno několik desítek pacientů, nicméně transplantace hematopoetických kmenových buněk se stále řadí mezi experimentální metody léčby refrakterní CN.
V následujícím sdělení se budeme věnovat prvnímu případu provedení ASCT u nemocného s komplikovanou CN v České republice.
Kazuistika
Pacient, 37letý muž, má diagnostikovanou CN od roku 1989, tj. od svých 12 let. Kromě střevního onemocnění vážněji nestonal, je nekuřák. V době diagnózy bylo zjištěno postižení terminálního ilea a pravostranné části tračníku (cékum až c. transversum). Zpočátku byl léčen systémovými glukokortikoidy a mesalazinem, později mesalazinem v monoterapii.
V roce 1995 došlo k rozvoji nitrobřišního abscesu s enterokutánní a ileosigmoidální píštělí. Při operaci byla provedena resekce distálního ilea a ileokolická resekce. Po operaci byl pacient léčen mesalazinem a intermitentně systémovými glukokortikoidy.
V květnu 2004 došlo opět ke vzniku retroperitoneálního abscesu a byla indikována další chirurgická intervence, při které bylo resekováno asi 15 cm neoterminálního ilea a doplněna pravostranná hemikolektomie. Po operaci byla zavedena profylaktická léčba mesalazinem až do relapsu v říjnu 2004, kdy byly endoskopicky zjištěny vředy v análním kanále a vícečetné vředy v neoterminálním ileu se stenózou 12 cm nad anastomózou. Nemocný byl indikován k zahájení biologické léčby infliximabem v indukční dávce (listopad‑ prosinec 2004) a současně byla zavedena léčba azathioprinem (AZA). Po dokončení indukční fáze biologické léčby bylo dosaženo klinické remise a pacient pokračoval v udržovací léčbě monoterapií azathioprinem.
V prosinci 2006 byl zaznamenán další relaps choroby a potvrzena stenóza neoterminálního ilea cca v 15 cm nad anastomózou, s postižením dalších 15 cm střeva nad stenózou. Byla provedena endoskopická balonová dilatace stenózy a podány opět pouze tři dávky infliximabu, po kterých došlo k navození remise a následně se pokračovalo v udržovací léčbě azathioprinem v dávce 2 mg/ kg.
V lednu 2008 došlo k novým známkám klinického relapsu CN navíc s postižením análního kanálu a rekta. Na tračníku a neoterminálním ileu byl zjištěn normální nález. Bylo zahájeno podávání adalimumabu, po kterém však nedošlo k jakémukoli zlepšení klinického stavu, a proto byla tato léčba v květnu 2008 ukončena. Klinické remise bylo dosaženo po změně terapie na kombinaci systémovými glukokortikoidy a imunosupresivně působícím pyrimidinovým antagonistou leflunomidem.
Další průběh choroby byl v srpnu 2008 komplikován masivní enteroragií s hlubokou posthemoragickou anémií (Hb 78 g/ l) a nutností opakovaných krevních převodů. Při endoskopii byly nalezeny fisury v análním kanále, aftózní léze v rektu a sigmatu, stenóza tenkého střeva asi 20 cm nad anastomózou s hlubokými vředy. Na CT enterografii byly popsány tři tzv. „skip“ léze se stenózami v distálním a neoterminálním ileu. Nemocný musel být indikován ke třetímu resekčnímu výkonu (resekce anastomózy a distálního ilea). Po operaci byla zahájena terapie infliximabem v dávce 5 mg/ kg.
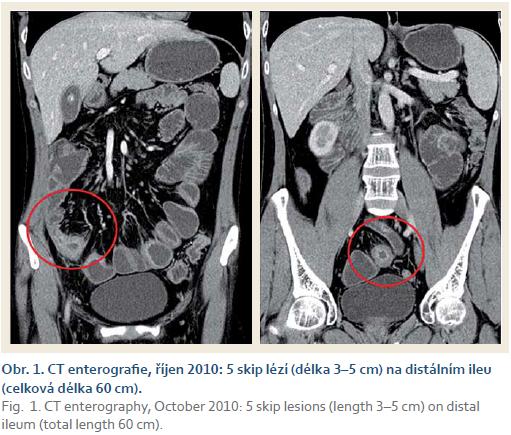
I přes zahájenou biologickou léčbu infliximabem došlo v dubnu 2009 k novému relapsu choroby. Při koloskopickém vyšetření byl zjištěn vřed v análním kanále, aftózní léze v rektu, sigmatu a v neoterminálním ileu. Terapie infliximabem byla ukončena, ke zlepšení klinického stavu došlo až po znovuzavedení terapií systémovými glukokortikoidy. Od července 2009 byl nemocný zařazen k léčbě vedolizumabem (antiintegrinové protilátky α4β7) v rámci klinické studie Millennium 13007, což umožnilo krátkodobé vysazení glukokortikoidů. Nicméně pro další těžký relaps CN v říjnu 2010 (perianální absces s píštělí, dle CT mnohočetné skip léze na distálním ileu – obr. 1) byla léčba vedolizumabem předčasně ukončena a pacient byl převeden opět na léčbu glukokortikoidy. Od prosince 2010 byl léčen intenzivní protizánětlivou terapií (infliximab 5– 10 mg/ kg v intervalu 6– 8 týdnů v kombinaci s AZA a systémovými glukokortikoidy v dávkách 2,5– 30 mg prednisonu dle stavu pacienta). Dosažená klinická remise byla jen přechodná, od července 2011 se stav pacienta postupně horšil, docházelo k úbytku na váze, anemizaci, progresi klinických příznaků a elevaci hodnot zánětlivých ukazatelů (CRP).
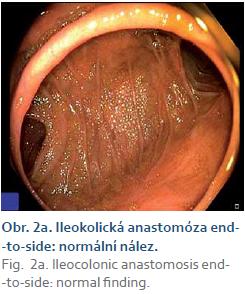
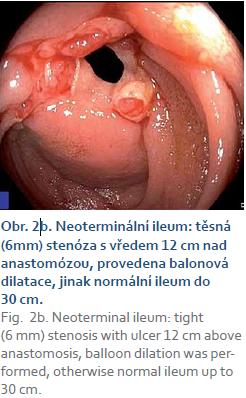
V červnu 2012 byl nemocný počtvrté operován pro perforaci neoterminálního ilea s nitrobřišním abscesem. Bylo resekováno dalších 80 cm neoterminálního ilea, zbývající délka tenkého střeva byla 125 cm. Po operaci pokračovala terapie infliximabem 5 mg/ kg v intervalu osmi týdnů. Od srpna 2013 musela být biologická léčba intenzifikována na 10 mg/ kg po šesti týdnech pro promptní zhoršování klinického stavu a endoskopické známky aktivity nemoci (vředy v análním kanále a stenóza s vředy v 8 cm neoterminálního ilea). V dubnu 2014 musela být provedena endoskopická balonová dilatace stenózy pro recidivující poruchy střevní průchodnosti (obr. 2). MR enterografie provedená v dubnu 2014 neprokázala další nápadnější zánětlivé změny na jiných částech trávicí trubice.
Vzhledem k agresivní formě onemocnění, které bylo refrakterní na intenzivní imunosupresivní i biologickou terapii, recidivujícím stenózám, opakovaným střevním perforacím s nutností opakovaných chirurgických intervencí a resekcí tenkého střeva nyní již s kritickou reziduální délkou tenkého střeva (cca 125 cm) byla nemocnému nabídnuta možnost provedení ASCT na hematologické klinice 3. LF UK a FN Královské Vinohrady. Terapie infliximabem byla přerušena. Výkon byl schválen Etickou komisí a pacient podepsal informovaný souhlas.
Ve dnech 3.– 17. 5. 2014 byla provedena mobilizace hematopoetických kmenových buněk do periferní krve podáním cyklofosfamidu 2,5 g/ m2 a granulocyty stimulujícího faktoru (G‑CSF) s následnou separací a in vitro selekcí CD34+ buněk. V časovém odstupu jednoho měsíce byla zahájena imunoablace podáním vysoké dávky cyklofosfamidu 200 mg/ kg. Periferní kmenové buňky byly transplantovány dne 25. 6. 2014 formou nitrožilní infuze. Převod byl komplikován pouze lehkou nauzeou, po dobu neutropenie a trombocytopenie (11, resp. 12 dnů) nedošlo ke vzniku žádných těžkých infekčních komplikací ani k projevům krvácení.
Po propuštění užíval nemocný jen profylaktickou terapii infekcí (cotrimoxazol, aciklovir, fluconazol) a nepodávali jsme žádnou léčbu CN. Subjektivně se cítil dobře, po střevní stránce byl zcela bez obtíží.
Kontrolní koloskopie v září 2014, tj. necelé tři měsíce od provedené transplantace, prokázala zánětlivé změny v anorektální oblasti a vícečetné vředy a náznaky stenózy v neoterminálním ileu. Rozhodli jsme se proto pro znovuzavedení biologické terapie infliximabem od října 2014 v indukčním a následně udržovacím režimu. V současné době je pacient nadále bez klinických obtíží na udržovací terapii infliximabem 5 mg/ kg po osmi týdnech, v plánu je kontrolní endoskopické a MR enterografické vyšetření v průběhu jara 2015.
Diskuze
ASCT se zdá být relativně efektivní a bezpečnou léčbou u komplikované, na medikamentózní terapii refrakterní CN, umožňující nastolit remisi a svým imunomodulačním efektem vrátit citlivost na imunosupresivní a biologickou léčbu, která v minulosti u těchto pacientů selhala. Nicméně se stále jedná o metodu potenciálně využitelnou pouze u velmi závažných forem onemocnění, u kterých všechna dostupná léčba selhala a jejíž místo v léčbě je třeba ověřit dalšími klinickými zkušenostmi a studiemi. Podle znalostí autorů se jedná o první publikovaný případ autologní transplantace hemopoetické kmenové buňky u nemocného s CN v České republice.
V uvedené kazuistice mladého muže je nutné zdůraznit několik aspektů, které se mohly podílet na nepříznivém průběhu nemoci. Mladý věk v době diagnózy (12 let), perforující typ nemoci, postižení tenkého střeva a nutnost podávat glukokortikoidy v krátké době od stanovení diagnózy jsou nejvýznamnější nepříznivé parametry, které v uvedené kazuistice můžeme nalézt. Je zcela zřejmé, že současný přístup k medikamentózní léčbě u CN se výrazně odlišuje od léčebných opatření, která byla u tohoto pacienta aplikována, včetně dlouhodobého podávání mesalazinu nebo jen indukčních fází beztak již pozdě zavedené biologické léčby. Na počátku minulého decenia se tento přístup označoval jako „bridging strategie“ a spočíval v podání indukční fáze biologické léčby infliximabem s následným dlouhodobým podáváním azathioprinu. Zůstane nevysvětleno, zda neodpovídavost na intenzivní terapii infliximabem v posledních letech v dávce 10 mg/ kg byla ovlivněna opakovaným a krátkodobým podáváním pouze indukčního režimu v časných fázích nemoci. Velmi brzy provedená endoskopická kontrola necelé tři měsíce po transplantaci kmenové buňky potvrdila přítomnost vředů v tenkém a tlustém střevě navzdory tomu, že pacient neměl střevní klinickou symptomatologii, neměl žádné známky infekce ani teploty a přibýval na váze. Je otázkou, zda se jednalo o změny spadající do obrazu aktivity CN nebo zda se jednalo o projevy tzv. „mukositidy“ po proběhlé transplantaci a vysokodávkované terapii cyklofosfamidem. Na zahraničních pracovištích se endoskopické kontroly u asymptomatických jedinců provádějí nejdříve jeden rok po transplantaci (osobní sdělení prof. Hawkey). Nicméně opětovné zavedení terapie infliximabem u tohoto extrémně těžkého pacienta považujeme za nutné a opodstatněné.
Předpokládaným mechanizmem účinku ASCT je ablace kostní dřeně použitím vysokodávkové chemoterapie, při které dochází mimo jiné i k ablaci autoreaktivních T lymfocytů. Následnou infuzí periferních kmenových buněk dochází k regeneraci naivních T lymfocytů. Tímto procesem dojde k tzv. „resetu“ imunitního systému po ASCT a obnovení ztracené odpovídavosti na imunosupresivní nebo imunomodulační léčbu [1,2]. Navíc, samotné podání vysokodávkované chemoterapie (např. cyklofosfamidu) může působit jako účinná imunosuprese u refrakterní CN [3].
ASCT u pacientů s CN byla popsána několika zahraničními autory [1– 8]. Zatím největší soubor publikoval Burt et al z Chicaga [4,5], kde transplantovali 24 pacientů s aktivní CN, z nichž 18 bylo sledováno po dobu pěti a více let po transplantaci. Všichni pacienti po ASCT dosáhli remise (CDAI < 150, vstupní CDAI > 250). Nicméně u většiny pacientů (n = 15, 62,5 %) došlo v dalším průběhu k relapsu nemoci s nutností zahájení protizánětlivé terapie, u osmi z nich však jen krátkodobě. Kumulativní pravděpodobnost udržení remise bez obnovení medikamentózní léčby CN po ASCT byla 91 % v prvním roce, 57 % ve třech letech a 19 % v pěti letech. Žádný pacient v souvislosti s léčbou nezemřel.
Hasselblatt et al z Freiburgu v Německu [1] sledoval 12 nemocných s CN po ASCT v průměru 3,1 roku (rozmezí 0,5– 10,3 roku). Obdobně jako v předchozí studii většina pacientů (n = 7, 58 %) relabovala v mediánu 10,9 měsíců (rozmezí 7– 15 měsíců) po transplantaci, ale všichni pacienti dobře reagovali na standardní léčbu CN (KS a imunosupresiva), u jednoho pacienta byla zahájena biologická léčba.
Hasselblatt a Hommes (AMC, Amsterdam) [3] popisují navození remise CN po samotné mobilizaci. Odpověď na otázku efektu mobilizace na aktivitu CN by mohla najít studie ASTIC (Autologous Stem Cell Transplantation for Crohn‘s Disease), prospektivní randomizovaná multicentrická studie, ve které pacienti s CN podstoupí ASCT buď časně (za měsíc), nebo pozdně (za 12 měsíců) po mobilizaci. Tato studie vznikla z iniciativy společností ECCO a EBMT (European Group for Blood and Marrow Transplantation) [9]. Výsledky této studie zatím byly publikovány jen ve formě abstraktů jako výsledky předběžné. Dle předběžných dat u 17 pacientů, kteří podstoupili mobilizaci i ASCT, byl pozorován větší pokles v klinickém i endoskopickém indexu aktivity oproti skupině 17 pacientů, kteří podstoupili pouze mobilizaci. Počet hlášených závažných nežádoucích příhod byl u obou skupin pacientů přibližně stejný (3,2, resp. 3,3 příhod na jednoho pacienta). Jeden pacient zemřel dva týdny po ASCT, příčina úmrtí nebyla specifikována [9].
Některá centra během imunoablace používají antithymocytární globulin (ATG), např. výše zmíněná skupina z Chicaga. ATG cíleně snižuje počet T lymfocytů příjemce, což může snížit pravděpodobnost relapsu nemoci, na druhé straně nese riziko vzniku alergických reakcí, prodlužuje fázi těžké imunosuprese, a tím zvyšuje riziko závažných infekcí [1]. Tento režim byl použit také ve výše zmíněné randomizované studii ASTIC.
Kromě rizika závažných infekčních komplikací spojených s touto metodou bylo popsáno několik případů vzniku sekundárních autoimunitních procesů po transplantaci primárního autoimunitního onemocnění jiného než CN [6]. Podobný případ uvádí také Hasselblatt [1] u pacientky s CN, která nikdy v minulosti neměla extraintestinální postižení a po ASCT u ní proběhly dvě těžké ataky artritidy, které ustoupily po léčbě systémovými KS.
Poděkování
Nadační fondy IBD‑ Comfort a NF Janele poskytly finanční dar na pokrytí části nákladů popsané metody.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Doručeno/Submitted: 5. 1. 2015
Přijato/Accepted: 2. 2. 2015
MUDr. Veronika Hrubá
Klinické a výzkumné centrum
pro střevní záněty ISCARE I.V.F. a.s.
Jankovcova 1569/ 2c, 170 00 Praha 7
vhruba06@email.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Hasselblatt P, Drognitz K, Potthoff K et al. Remission of refractory Crohn‘s disease by high‑dose cyclophosphamide and autologous peripheral blood stem cell transplantation. Aliment Pharmacol Ther 2012; 36(8): 725– 735. doi: 10.1111/ apt.12032.
2. Al‑ Toma A, Nijeboer P, Bouma G et al.
Hematopoietic stem cell transplantation for non‑malignant gastrointestinal diseases. World J Gastroenterol 2014; 20(46): 17368– 17375. doi: 10.3748/ wjg.v20.i46. 17368.
3. Hommes DW, Duijvestein M, Zelinkova Z
et al. Long‑term follow‑up of autologous hematopoietic stem cell transplantation for severe refractory Crohn‘s disease. J Crohns Colitis 2011; 5(6): 543– 549. doi: 10.1016/ j.crohns.2011.05.004.
4. Burt RK, Craig RM, Milanetti F et al. Autologous nonmyeloablative hematopoietic stem cell transplantation in patients with severe anti‑TNF refractory Crohn disease: long‑term follow‑up. Blood 2010; 116(26): 6123– 6132. doi: 10.1182/ blood‑ 2010‑ 06‑ 292391.
5. Oyama Y, Craig RM, Traynor AE et al.
Autologous hematopoietic stem cell transplantation in patients with refractory Crohn’s disease. Gastroenterology 2005; 128(3): 552– 563.
6. Daikeler T, Labopin M, Di Gioia M et al. Secondary autoimmune diseases occurring after HSCT for an autoimmune disease: a retrospective study of the EBMT Autoimmune Disease Working Party. Blood 2011; 118(6): 1693– 1698. doi: 10.1182/ blood‑ 2011‑ 02‑ 336156.
7. Cassinotti A, Annaloro C, Ardizzone S et al.
Autologous haematopoietic stem cell transplantation without CD34+ cell selection in refractory Crohn‘s disease. Gut 2008; 57(2): 211– 217.
8. Clerici M, Cassinotti A, Onida F et al.
Immunomodulatory effects of unselected haematopoietic stem cells autotransplantation in refractory Crohn‘s disease. Dig Liver Dis 2011; 43(12): 946– 952. doi: 10.1016/ j.dld.2011.07.021.
9. Hawkey C, Allez M, Ardizzone S et al. OC‑ 014 clinical and endoscopic improvement following hemopoietic stem cell transplantation vs mobilisation alone in Crohn’s disease. Gut 2013; 62 (Suppl 1): A6.