Doporučené postupy České gastroenterologické společnosti ČLS JEP pro kapslovou endoskopii
Ilja Tachecí1, Štěpán Suchánek2, Pavel Drastich Orcid.org 3, Přemysl Falt Orcid.org 4, Michal Voška Orcid.org 2, Tomáš Douda Orcid.org 5, Ondřej Urban Orcid.org 6,7, Jan Bureš Orcid.org 1, Miroslav Zavoral Orcid.org 2, Marcela Kopáčová Orcid.org 1
+ Pracoviště
Podpořeno z programového projektu Ministerstva zdravotnictví ČR s reg. č. 16-29614A.
Doporučené postupy České gastroenterologické společnosti ČLS JEP pro kapslovou endoskopii vznikly jako konsenzus autorského kolektivu na základě vědeckých dat aktuálně dostupných v době jeho tvorby. Text nahrazuje starší, dříve publikované doporučené postupy [1] a je v souladu s platnými guidelines Evropské společnosti gastrointestinální endoskopie (ESGE) [2–4].
Kapslová endoskopie je v současné době standardní součástí diagnostických algoritmů onemocnění tenkého střeva a potenciálně také některých onemocnění tračníku. Dostupnost vyšetření je v ČR vysoká, limitující zůstává jeho cena.
Ačkoli je k dispozici také kapsle k vyšetření jícnu, nemůže být dosud z mnoha důvodů pro běžnou klinickou praxi doporučena (dostupnost, kvalita a cena standardní gastroskopie, nemožnost odběru biopsií).
Cílem doporučeného postupu je racionální použití kapslové endoskopie v běžné klinické praxi, umožňující efektivní diagnostiku a léčbu některých závažných onemocnění trávicí trubice.
1.Terminologie a technické aspekty vyšetření
1.1. Enteroskopická kapsle
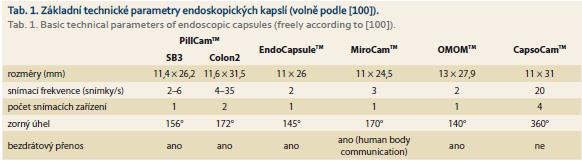
Kapslová enteroskopie (synonymum: kapslová endoskopie tenkého střeva) je diagnostická metoda určená k vyšetření tenkého střeva. Enteroskopická kapsle je bezdrátový endoskop ve tvaru kapsle o velikosti cca 11 × 26 (25) mm, který je po polknutí dále posunován peristaltikou a je bez přímého (kabelového) spojení se zařízením umístěným mimo tělo pacienta (tab. 1). Jedná se o digitální snímací zařízení uzavřené v obalu z bioplastu (odolného vůči změnám teploty a pH v gastrointestinálním traktu (GIT)), obsahující optickou soustavu/y, videočip (CMOS – Complementary Metal-Oxide Semiconductor nebo CCD – Complementary Charge Device), zdroje studeného světla (diody LED – Light Emitting Diode), baterie, event. vysílač s anténou. Většina kapslí disponuje jednou optickou soustavou (PillCamTM SB3, EndoCapsuleTM, MiroCamTM). Kapsle snímají endoskopický obraz jako sérii statických obrázků s konstantní (2–5 snímků/s) nebo proměnlivou snímací frekvencí (2–35 snímků/s), měnící se v závislosti na poloze a rychlosti pohybu kapsle. Endoskopický obraz je bezdrátově přenášen do přijímače (přímý přenos signálu využívající lidské tkáně jako vodiče pomocí tzv. human body communication technologie poskytují kapsle MiroCamTM). Přijímač, někdy také označovaný jako datarekordér, je multifunkční zařízení umožňující uložení obrazových dat a zobrazování endoskopického obrazu v reálném čase (prohlížeč – real-time viewer). Po ukončení vyšetření (vybití baterií endoskopické kapsle po 8–15 hod) jsou získaná data stažena do počítače s diagnostickým softwarem umožňujícím vyhodnocení nálezů.
Technologicky poněkud odlišné jsou kapsle s boční optikou (CapsoCamTM). Jedná se o kapsli o rozměrech 11 × 31 mm obsahující soustavu 4 kamer a 16 LED diod umístěných na boku, schopných snímání až 5 snímků/s na 1 kameru a umožňujících záznam slizničního povrchu v rozsahu 360° (panoramatické boční zobrazení). Tato zařízení snímaný obraz nevysílají, přímo ho ukládají do datového úložiště uvnitř, a vyžadují tedy zachycení kapsle po opuštění těla per vias naturales a následné stažení dat.
Zvláštní typ kapsle představuje tzv. retenční kapsle (PillCamTM Patency Capsule), částečně biodegradabilní kapsle shodných rozměrů s kapslovým endoskopem (bez snímacího zařízení) složená z laktózy a barya a obsahující radiofrekvenční jádro. Kapsle je kryta nepropustnou membránou s výjimkou dvou propustných oken umožňujících (po kontaktu se střevním obsahem) její postupný rozpad v průběhu 72 hod. Tato kapsle slouží k testování průchodnosti GIT před vlastním vyšetřením (viz část textu Komplikace vyšetření).
1.2. Kolonická kapsle
Kolonická kapsle je zařízení určené k vyšetření tračníku (kapslová koloskopie: PillCamTM COLON2). Je stejného tvaru jako kapsle k vyšetření tenkého střeva, liší se od ní délkou (12 × 32 mm) a přítomností dvou optických soustav v pólech. Kolonická kapsle má dále ve srovnání s tenkostřevní některá významná technická vylepšení. Jsou to především široké zorné úhly (2× 172°), proměnlivá snímací frekvence s automatickou úpravou podle rychlosti posunu kapsle peristaltikou a její lokalizace (před dosažením tenkého střeva zůstává kapsle v „baterie šetřicím režimu“: 14 snímků/min, teprve poté je nastavena standardní frekvence: 4–35 snímků/s) a pokročilý datarekordér umožňující obousměrnou komunikaci a asistenci nemocnému v průběhu vyšetření (zobrazováním komentářů a alarmů).
2. Příprava k vyšetření
2.1. Kapslová enteroskopie
Před vyšetřením jsou doporučována dietní opatření založená na bezezbytkové dietě (24 hod), pití čirých tekutin a 12hod lačnění. Přehlednost sliznic je přesto často výrazně snižována přítomností tmavé žluči, bublin či zbytků nestrávené potravy. Výsledky randomizovaných, kontrolovaných studií a metaanalýz jsou stále poměrně nejednoznačné [5–12], převážně prokazují zvýšení přehlednosti sliznic po podání střevní přípravy [13,14]. Zda je tento fakt spojen také se zvýšením diagnostické výtěžnosti a počtu kompletních vyšetření, zůstává nejasné. Přetrvává vysoká heterogenita studií v typu a načasování přípravy. Některá data naznačují lepší výsledky při podání nízkého objemu přípravy až po dosažení tenkého střeva [14,15]. V současnosti doporučujeme (především u vyšetření kapslovou enteroskopií s očekávaným fokálním nálezem – krvácení, tumory tenkého střeva) přípravu střeva 2 l polyethylenglykolu (PEG), který preferujeme před fosfátovými solemi vzhledem k množství jejich potenciálních komplikací a kontraindikací [16,17]. Přesné časování přípravy nelze dle dostupných dat jednoznačně určit, na základě vlastních zkušeností a některých studií [18] doporučujeme celkovou dávku PEG rozdělit na večer v den před vyšetřením a 4 hod před vyšetřením. Před vyšetřením vysazujeme medikaci s potenciálním vlivem na přehlednost sliznic tenkého střeva (preparáty železa 5 dní před vyšetřením), nezbytné léky (antihypertenziva, antikonvulziva apod.) užívá nemocný nejméně 2 hod před polknutím kapsle (nebo 2 hod po polknutí).
Podání simetikonu v dávce mezi 80 a 200 mg p. o. 20 min před vyšetřením redukuje množství bublin především v orální části GIT [6,19,20] a je také doporučováno.
2.2. Kapslová koloskopie
Vzhledem k absenci možnosti insuflace a oplachu jsou kvalita zobrazení a výsledek vyšetření tračníku endoskopickou kapslí vysoce závislé na kvalitě přípravy střeva. Úlohou přípravy je nejen adekvátní očista střevní sliznice, naplnění lumen čirou tekutinou, ale také urychlení pohybu kapsle tak, aby dosáhla anu ještě před vybitím baterií.
Příprava tračníku je ve většině studií založena na kombinaci PEG před polknutím endoskopické kapsle a podáním jedné nebo dvou dávek roztoků fosfátových solí po dosažení tenkého střeva (tzv. boosteru). Vzhledem ke kontraindikacím a riziku závažných komplikací v souvislosti s podáváním fosfátových solí bylo publikováno několik studií se snahou o nalezení alternativy [21,22], bez jednoznačného výsledku.
V současné době doporučujeme dietní opatření zahrnující 5 dní nízcezbytkové diety (s omezením nestravitelné vlákniny, semínek apod.), tekutou dietu den před vyšetřením a přípravu tračníku podáním 4 l PEG (3 l večer v den před vyšetřením a 1 l hod před vyšetřením).
3. Průběh vyšetření
Vyšetření lze provést ambulantně, za pobytu na stacionáři, nebo při krátkodobé hospitalizaci – podle aktuálního klinického stavu a přání pacienta. Obecně je ambulantní provedení preferováno také vzhledem k vyššímu riziku nekompletního vyšetření u hospitalizovaných nemocných [23,24].
Lékař poučí pacienta o průběhu vyšetření a nemocný podepíše informovaný souhlas s vyšetřením (mimo jména, rodného čísla pacienta a data vyšetření musí obsahovat základní informace o metodě, jejích přínosech a komplikacích, způsobech řešení komplikací, alternativních diagnostických metodách a kontaktní telefonní čísla či postup v případě pozdějších obtíží či komplikací).
Vlastní vyšetření (obsluhu systému a asistenci) může provádět vyškolená endoskopická sestra. Před vyšetřením jsou základní data identifikující vyšetření a pacienta nahrána do datarekordéru. Na odmaštěnou a oholenou kůži břicha jsou vyšetřované osobě připevněny samolepicí antény v přesné lokalizaci podle schématu (neplatí v případě použití pásu se zabudovanými senzory, tzv. Sensor Belt). Pacient se oblékne (doporučujeme volné, pohodlné oblečení, nejlépe s předním rozepínáním) a do opasku se umístí datarekordér, který se následně propojí s anténami (pásem). U systému bez přenosu dat (CapsoCamTM) se datarekordér ani antény nepoužívají.
3.1. Kapslová enteroskopie
Po aktivaci kapsle ji pacient spolkne s douškem vody. Riziko nekompletního vyšetření (ukončení vyšetření v tenkém střevě) je vyšší u hospitalizovaných pacientů, nemocných s anamnézou předchozího chirurgického výkonu, s poruchou evakuace žaludku, diabetickou viscerální neuropatií, těžkou hypotyreózou, renální insuficiencí, užívajících opiáty apod. Vzhledem k tomu doporučujeme monitorování polohy enteroskopické kapsle pomocí prohlížeče za 60 min po zahájení vyšetření (polknutí kapsle) a při průkazu perzistence kapsle v žaludku podání prokinetika (10 mg metoklopramidu i.v.), event. zavedení kapsle do duodena pomocí gastroskopu. Rutinní použití prokinetik u všech nemocných podíl kompletních vyšetření nezvyšuje a není doporučeno [25].
Po polknutí kapsle může pacient pít za 2 hod (vodu) a sníst lehké jídlo za 4 hod. Intervaly lze zkrátit po dosažení tenkého střeva (prokázaném prohlížečem nebo po endoskopickém zavedení kapsle).
V průběhu vyšetření se pacient vyhýbá zdrojům silného elektromagnetického pole, vyšetření magnetickou rezonancí (MR) je před vyloučením kapsle z těla kontraindikováno. Vyšetřovaná osoba se může volně pohybovat a vykonávat běžné aktivity.
Po ukončení vyšetření (většinou signalizováno přímo na datarekordéru za 8–12 hod) je systém rozpojen a antény odlepeny (sundány). Při použití systému bez přenosu dat (CapsoCamTM) je pacient vybaven magnetickou tyčí, kterou musí kapsli zachytit ve stolici a odeslat zpět na endoskopické pracoviště ke stažení dat. Data jsou po ukončení vyšetření stažena z datarekordéru nebo přímo z kapsle do počítače.
Pacient je poučen o předpokládané době odchodu kapsle per vias naturales (1–7 dní).
3.2. Kapslová koloskopie
Po aktivaci kapsle ji pacient spolkne s douškem vody. Polohu kolonické kapsle ověřujeme pomocí prohlížeče za 60 min po polknutí. Prokinetika (metoklopramid 10 mg i.v.) používáme, pokud kapsle perzistuje v žaludku > 1 hod.
Po průchodu kapsle do tenkého střeva podáváme 1. booster (30 ml fosfátových solí s 1 l vody). Druhý booster podáváme, pouze pokud nedojde za další 3 hod k vyloučení kapsle (25 ml fosfátových solí s 1 l vody). U pacientů starších 70 let, s hypovolemií, renální insuficiencí, aktivní kolitidou a pacientů léčených medikací s potenciálním vlivem na ledvinnou perfuzi doporučujeme nahradit fosfátové soli jinými preparáty, jejich efektivita je však vzhledem k nedostatku dat nejistá (např. Moviprep®, Eziclen®) [21,26]. Pokud nedojde po 8 hod k exkreci kolonické kapsle a dle prohlížeče je suspektní její poloha v aborální části tračníku, podáváme čípek s bisacodylem.
4. Vyhodnocení vyšetření
Vlastní vyhodnocení vyšetření provádí lékař (endoskopista se zkušeností s vyšetřením tenkého a tlustého střeva) pomocí diagnostického softwaru, který umožňuje přehrávání endoskopických videosekvencí, v klidném prostředí umožňujícím dostatečnou koncentraci.
Studie prokazují srovnatelnou výtěžnost kapslové endoskopie hodnocené lékařem a sestrou [27], iniciální vyhodnocení záznamu (pre-reading) proškolenou endoskopickou sestrou je akceptovatelné, zodpovědnost za definitivní zhodnocení vyšetření a stanovení diagnózy však vždy zůstává na lékaři.
Prohlížení nálezů probíhá v jednom či více oknech (single – multiple view), jako optimální doporučujeme rychlost 10–12 snímků/s (s použitím nižší rychlosti v orálních partiích GIT a úpravou dle rychlosti peristaltiky, dle stavu přípravy střeva a zkušeností endoskopisty). Pokud software umožňuje tzv. rychlé vyhodnocení (fast reading), mělo by být používáno pouze při iniciálním vyhodnocení (např. při snaze identifikovat oblasti s krvácením) nebo při onemocnění s difuzním postižením tenkého střeva s následným odečtením nálezů standardní rychlostí. Rutinní použití metod virtuální chromoendoskopie implementovaných do jednotlivých typů diagnostického softwaru (Flexible Spectral Imaging Color Enhancement: FICE, Blue Mode, Augmented Live-body Image Color spectrum Enhancement: ALICE) nedoporučujeme vzhledem k nedostatku dat prokazujících jejich přínos v kapslové endoskopii [28,29].
Identifikované patologické nebo suspektní nálezy by měly být označeny a exportovány jako statické snímky nebo krátké videosekvence. Systém zobrazuje přibližnou aktuální pozici kapsle (trajektorii průchodu kapsle ve dvojrozměrném schématu či kvadrantovou lokalizaci), indikátor červené barvy označuje lokalizace suspektní z krvácení, všechny tyto funkcionality mají pouze pomocnou roli. K dispozici jsou atlasy nálezů kapslové endoskopie v tištěné podobě [30] i implementované přímo do diagnostického softwaru.
5. Zpráva o vyšetření
5.1. Závěrečná zpráva o vyšetření kapslovou enteroskopií
Závěrečná zpráva o vyšetření kapslovou enteroskopií by měla vždy obsahovat tyto údaje:
- a) data pacienta (jméno a příjmení, rodné číslo, kód zdravotní pojišťovny);
- b) údaje o vyšetření (zdravotnické zařízení, jméno lékaře a sestry, datum vyšetření);
- c) informace o diagnostickém systému (typ použité enteroskopické kapsle, identifikační číslo kapsle);
- d) indikaci k vyšetření;
- e) základní anamnestická data (vč. alergií, medikace, přehledu dosud provedených relevantních vyšetření);
- f) typ přípravy;
- g) přehlednost sliznice v jednotlivých segmentech tenkého střeva (duodenum, jejunum, ileum);
- h) kompletnost vyšetření (dosažení céka);
- ch) nálezy a jejich lokalizace (proximální, střední a distální třetina tenkého střeva, event. kvadrantová lokalizace) popsané pomocí standardní terminologie pro vyšetření kapslovou endoskopií [31], čas, odhad velikosti léze;
- i) základní časové charakteristiky vyšetření (čas pasáže kapsle žaludkem, tenkým střevem, dosažení céka, celková doba vyšetření);
- j) komplikace vyšetření (technické, klinické);
- k) diagnostický souhrn;
- l) doporučení dalšího postupu vč. návrhu způsobu řešení komplikací.
5.2. Závěrečná zpráva o vyšetření kapslovou koloskopií
Závěrečná zpráva o vyšetření kapslovou koloskopií by měla vždy obsahovat tyto údaje:
- a) data pacienta (jméno a příjmení, rodné číslo, kód zdravotní pojišťovny);
- b) údaje o vyšetření (zdravotnické zařízení, jméno lékaře a sestry, datum vyšetření);
- c) informace o diagnostickém systému (typ použité endoskopické kapsle, identifikační číslo kapsle);
- d) indikaci k vyšetření;
- e) základní anamnestická data (vč. alergií, medikace, přehledu dosud provedených relevantních vyšetření);
- f) typ přípravy;
- g)přehlednost sliznice v jednotlivých segmentech tračníku (pravý tračník, colon transversum, levý tračník);
- h) kompletnost vyšetření (odchod kapsle konečníkem);
- ch)nálezy a jejich lokalizace (pravý tračník, colon transversum, levý tračník), čas, velikost (s využitím měření pomocí softwaru), při nálezu polypu či ploché léze je popisujeme zvlášť, uvádíme přítomnost signifikantních nálezů (polypy ≥ 6 mm nebo ≤ 3 neoplastické léze);
- i) základní časové charakteristiky vyšetření (čas pasáže kapsle žaludkem, tenkým střevem, tračníkem, dosažení céka, hepatická flexura, lienální flexura, poslední obrázek rekta, celková doba vyšetření);
- j) komplikace vyšetření (technické, klinické);
- k) diagnostický souhrn;
- l) doporučení dalšího postupu vč. návrhu způsobu řešení komplikací.
6. Indikace k vyšetření
6.1. Kapslová enteroskopie
Základní indikace vyšetření tenkého střeva kapslovou endoskopií jsou: krvácení do tenkého střeva, nádory tenkého střeva, vyšetření polypózních syndromů, Crohnova choroba (CD – Crohn’s disease) tenkého střeva, komplikace celiakie, abnormální nález na předchozím zobrazovacím vyšetření tenkého střeva a poškození tenkého střeva léky (nesteroidní antiflogistika).
6.1.1. Krvácení do tenkého střeva
U nemocných s recidivujícím nebo přetrvávajícím krvácením do trávicí trubice a negativním gastroskopickým a koloskopickým vyšetření (cca 5 % krvácení do GIT) preferujeme použití termínu „suspektní krvácení do tenkého střeva“ před dříve běžně užívaným „krvácení z neurčeného zdroje“ [32]. Díky dostupnosti endoskopických metod (vč. kapslové enteroskopie) se dnes již většinu zdrojů u krvácení tohoto typu daří identifikovat a termín „z neurčeného zdroje“ by měl být rezervován pro situace s negativním endoskopickým vyšetřením tenkého střeva. Alternativně lze krvácení do tenkého střeva také označovat jako krvácení do střední části trávicí trubice (middle gastrointestinal bleeding), označujícím krvácení, jehož zdroj je lokalizován mezi Vaterovou papilou a ileocekální chlopní.
Krvácení se manifestuje melénou, enteroragií nebo hematemézou (akutní – zjevné) nebo pozitivním testem stolice na okultní krvácení (TOKS) a/nebo sideropenickou anémií (chronické – okultní).
Přes poměrně vysoké riziko přehlédnutí zdroje krvácení v průběhu vstupní gastroskopie a koloskopie (okolo 20 % [33,34]) nelze opakování standardní endoskopie rutinně doporučit, je ho ale potřeba individuálně zvažovat podle kvality předchozích vyšetření (kompletnost, přehlednost sliznic do D2 duodena a sondáž terminálního ilea, obrazová dokumentace).
Nejčastějšími zdroji krvácení do tenkého střeva jsou u nemocných starších 40 let angiektazie, eroze či enteropatie z nesteroidních antiflogistik, u nemocných mladších 40 let nádory tenkého střeva, Meckelův divertikl a Dieulafoyova léze.
Kapslová enteroskopie je indikována jako vyšetření první volby u nemocných se zjevným suspektním krvácením do tenkého střeva. Problematika nemocných se suspektním krvácením do tenkého střeva a sideropenickou mikrocytární anémií je diskutována níže. Při srovnání s intraoperační enteroskopií je senzitivita kapslové endoskopie tenkého střeva v této indikaci 95 % a specificita 75 % [35], diagnostická výtěžnost se pohybuje mezi 61 a 62 % [36,37]. Předchozí radiologické zobrazení tenkého střeva (pasáž, enteroklýza, CT/MR enterografie) má významně nižší diagnostickou výtěžnost, je spojeno s rizikem opožděné diagnostiky a adekvátní terapie, a není tedy z medicínského hlediska rutinně indikováno. Kapslová enteroskopie má srovnatelnou diagnostickou výtěžnost s hlubokou enteroskopií, která má však vyšší riziko nekompletních vyšetření a je invazivní. Diagnostická výtěžnost metody je nejvyšší v intrahemoragické fázi (resp. do 48 hod), poté dochází k jejímu trvalému poklesu. Proto kapslovou enteroskopii provádíme u zjevného krvácení co možná nejdříve, ne však déle než za 14 dní [38,39] od poslední epizody krvácení. Vyšší diagnostická výtěžnost je u zjevného než u okultního krvácení [40].
Za optimální považujeme rozdělení nálezů podle potenciálu ke krvácení, kdy pouze nález lézí s vysokým hemoragickým potenciálem (angiektazie, ulcerace, tumory a varixy) lze označit jako diagnostický [41]. Význam kapslové enteroskopie obecně spočívá v kombinaci vysoké diagnostické výtěžnosti a nízké invazivity (riziko retence kapsle se u krvácení do tenkého střeva pohybuje okolo 1 % [37]). Vyšetření umožňuje včasné a cílené provedení dalších terapeutických endoskopických (jedno-/dvojbalonová, spirální enteroskopie či intraoperační enteroskopie) nebo rentgenologických (RTG) metod (CT angiografie), případně indikuje přímo chirurgické řešení. Lokalizace léze (určená pomocí diagnostického softwaru jako procento tranzitního času kapsle tenkým střevem nebo procento vyšetřené části tenkého střeva) umožňuje správnou volbu přístupu při následné hluboké enteroskopii. Orálním přístupem dosáhneme těch nálezů, které jsou lokalizovány do 42 % tranzitního času kapsle tenkým střevem (do 50 % vyšetřené části tenkého střeva) [42].
V případě negativního nálezu kapslové enteroskopie je (v případě pacienta bez pokračujícího zjevného krvácení či potřeby hemosubstituce) riziko opětovného krvácení relativně nízké a prognóza příznivá [43], což umožňuje konzervativní postup („watch and wait strategie“, a/nebo substituce preparáty železa).
U pacientů s recidivou či pokračujícím zjevným krvácením (či potřebou hemosubstituce) a negativní kapslovou endoskopií je potřeba individuálně zvažovat další diagnostický postup (v případě nízkého rizika přehlédnutí zdroje krvácení v průběhu předchozích standardních endoskopií je to opakování kapslové endoskopie tenkého střeva či provedení hluboké enteroskopie). Opakovaná kapslová enteroskopie má vysokou diagnostickou výtěžnost při klinických známkách zvýšení intenzity krvácení (změně z okultního na zjevné či při poklesu hemoglobinu o více než 40 g/l) [44].
Sideropenická mikrocytární anemie je relativně častý důvod konzultace gastroenterologa a postihuje v rozvinutých zemích až 5 % mužů a postmenopauzálních žen [45]. Vyšší diagnostická výtěžnost kapslové enteroskopie je pozorována v těchto případech u selektované populace nemocných s negativní gastroskopií a koloskopií. Součástí endoskopických vyšetření musí být také sondáž terminálního ilea (k vyloučení CD) a duodena s biopsií (k vyloučení celiakie). U nemocných se sideropenickou anemií je dále nutno provést sérologické vyšetření k vyloučení celiakie, ultazvuk břicha, gynekologické vyšetření (v případě premenopauzálních žen) a v anamnéze je nutné se zaměřit na rizikovou medikaci (antikoagulanci apod.) a komorbidity. Stanovení pozitivity TOKS před kapslovou endoskopií není pro indikaci vlastního vyšetření přínosné [46].
U nemocných s pozitivitou TOKS bez anemie a jiné symptomatologie není (po negativní gastroskopii a koloskopii) vyšetření tenkého střeva kapslovou enteroskopií rutinně indikováno.
U mladších nemocných a pacientů s další přidruženou gastrointestinální symptomatologií doporučujeme provést dále přímo kapslovou enteroskopii. U ostatních pacientů (především starších, oligosymptomatických a antikoagulovaných) lze před vyšetřením endoskopickou kapslí provést terapeutický pokus se substitucí preparáty železa a vyšetření tenkého střeva doplnit teprve po jeho selhání.
Alternativní vyšetření u pacientů se suspektním krvácením do tenkého střeva
Vzhledem k horší zobrazitelnosti perivaterské oblasti endoskopickou kapslí s přímou optikou (předpokládá se zvýšení diagnostické výtěžnosti v této oblasti při použití kapsle s boční optikou) doplňujeme v případě podezření na krvácení do duodena vyšetření duodenoskopem. V případě krvácení u pacientů po operacích žaludku a střev s vytvořenými bypassy a slepými kličkami (Roux-en-Y gastroenteroanastomóza) je vyšetřením první volby hluboká enteroskopie (jedno-/dvojbalonová, spirálová enteroskopie).
Pokud je krvácení závažné, s rychlou progresí do hemodynamické nestability či šoku, je potřeba zvažovat (jako alternativu ke kapslové endoskopii) vyšetření s terapeutickým potenciálem (hluboká enteroskopie či angiografie).
6.1.2. Crohnova choroba
Kapslová enteroskopie má vyšší diagnostickou výtěžnost pro slizniční léze (zarudnutí sliznice, eroze, afty, menší ulcerace) než klasické RTG metody vyšetření tenkého střeva (enteroklýza, CT/MR) enterografie) u pacientů se suspektní nebo známou nestenozující CD tenkého střeva (při srovnání s MR enterografií je superiorita kapslové enteroskopie pozorována především v orálních partiích tenkého střeva) [47–49]. Hlavními limitacemi metody jsou nemožnost odběru biopsií a zobrazení změn slizničního povrchu bez možnosti hodnocení postižení střevní stěny a okolí.
Vyšetření endoskopickou kapslí by mohlo být v budoucnu teoreticky vhodnou neinvazivní metodou pro sledování slizničního hojení u pacientů s idiopatickými střevními záněty (IBD – inflammatory bowel disease) tenkého střeva i tračníku. S nově zavedenou kapslí (konstrukčně vycházející z kolonické kapsle) dedikovanou pro vyšetření trávicí trubice u CD (PillCamTM Crohns) nejsou v současné době větší zkušenosti [50].
Suspektní Crohnova choroba tenkého střeva
Kapslová enteroskopie je indikována u pacientů se suspektní CD tenkého střeva, u kterých nebylo vyšetření terminálního ilea v průběhu koloskopie a RTG vyšetření tenkého střeva (CT/MR enterografie) diagnostické.
Diagnóza CD nemůže být založena pouze na enteroskopickém obrazu, ale je postavena na kombinaci endoskopických, RTG, laboratorních a klinických nálezů. Negativní kapslová enteroskopie má vysokou negativní prediktivní hodnotu pro aktivní CD tenkého střeva, specificita a pozitivní prediktivní hodnota jsou ale významně nižší než specificita RTG vyšetření (CT enterografie) a ileoskopie [51]. Endoskopické nálezy kompatibilní s CD (aftózní léze, eroze, ulcerace, zánětlivé polypy, stenózy) jsou nespecifické a je nutné vždy vylučovat další příčiny postižení tenkého střeva, především nesteroidními antiflogistiky [52]. Některé slizniční „abnormality“ lze navíc nalézt i u významné části zdravých jedinců (slizniční zarudnutí u 7–12 %, drobné eroze u 5 %) vyšetřených kapslovou endoskopií [52,53]. Vzhledem k tomu doporučujeme provést kapslovou endoskopii u nemocného se suspektní CD po 1měsíčním vysazení nesteroidních antiflogistik. Specificitu nálezů kapslové enteroskopie zvyšuje vyšetřování selektované populace se suspektní CD a současně hmotnostním úbytkem [54], perianální chorobou [55], zvýšenými markery zánětu [56] a zvýšeným fekálním kalprotektinem [57]. Naopak diagnostická výtěžnost kapslové enteroskopie je velmi nízká u pacientů se suspektní CD a hodnotou fekálního kalprotektinu < 50 μg/g [58].
Známá Crohnova choroba tenkého střeva
Kapslová enteroskopie je u pacientů se známou CD tenkého střeva indikována, pokud jsou výsledky ostatních endoskopických (ileoskopie) nebo RTG vyšetření (CT/MR enterografie) nejasné a pokud průkaz aktivity choroby v tenkém střevě povede ke změně léčby. Před vlastním vyšetřením endoskopickou kapslí je nutné vyloučení klinicky významné stenózy tenkého střeva.
K popisu endoskopických nálezů lze použít také endoskopická skóre CD (The Capsule Endoscopy Crohn’s Disease Activity Index: CECDAI a Lewis score [59,60]). Skóre nejsou dosud ověřena na větších souborech nemocných a v současnosti jsou využitelná především v klinických studiích.
U pacientů s podezřením na postoperační rekurenci CD v tenkém střevě je kapslová enteroskopie indikována, pokud je standardní endoskopické vyšetření (ileoskopie při koloskopii) kontraindikováno či neúspěšné.
Potenciální role kapslové enteroskopie v identifikaci slizničního hojení po léčbě musí být ještě upřesněna. Lite-rární data naznačují limitovanou korelaci signifikantních zánětlivých změn detekovaných v tenkém střevě kapslovou endoskopií s C-reaktivním proteinem a/nebo fekálním kalprotekti-nem [61,62] a klinickou symptomatologií [63] a významný vliv nálezů kapslové enteroskopie na změnu terapie (52 % nemocných) [61].
Neklasifikovaný střevní zánět
Kapslová enteroskopie se může uplatnit také v rámci diferenciální diagnostiky neklasifikovaného střevního zánětu a při reklasifikaci chybně diagnostikované ulcerózní kolitidy. Ačkoli negativní kapslová endoskopie tenkého střeva CD nevyloučí, pozitivní nález umožní stanovení správné diagnózy (až 25 % nemocných s neklasifikovaným střevním zánětem má na kapslové endoskopii nález v oblasti tenkého střeva kompatibilní s diagnózou CD [64]).
6.1.3. Nádory tenkého střeva
Maligní nádory tenkého střeva tvoří cca pouze 2 % všech malignit GIT. Většina nádorů tenkého střeva diagnostikovaných kapslovou endoskopií je zjištěna v rámci vyšetřování pro suspektní krvácení do tenkého střeva (často manifestovaného sideropenickou anémií). Nejčastěji jsou zjišťovány adenokarcinom tenkého střeva, gastrointestinální stromální tumor, neuroendokrinní tumor, lymfom a metastázy melanomu [65–67]. Diagnostika nádorů tenkého střeva je často opožděna vzhledem k nespecifickým a pozdním symptomům.
Kapslová enteroskopie (mimo vyšetřování pro krvácení do tenkého střeva) je indikována u pacientů s nejasným nálezem na předchozím zobrazovacím vyšetření (CT nebo CT/MR enterografie) nevylučujícím nádor. Pokud je však nález těchto vyšetření vysoce suspektní z nádoru tenkého střeva, doporučujeme upřednostnit hlubokou enteroskopii a histologickou verifikaci.
Při nálezu nádoru tenkého střeva primárně při kapslové endoskopii doplňujeme dále (podle charakteru nálezu) RTG zobrazovací metody (CT nebo CT/MR enterografii) a gastroskopii či hlubokou enteroskopii s odběrem histologie nebo indikujeme přímo chirurgické řešení (případně v kombinaci s intraoperační enteroskopií).
Vyšetření hlubokou enteroskopií zvažujeme také (vzhledem k riziku falešně negativních nálezů u tumorů v oblasti duodena a proximálního jejuna a submukozních lézí [68,69]) u pacientů s negativním výsledkem kapslové enteroskopie, u kterých přetrvává vážné podezření na nádorové postižení tenkého střeva.
Vzhledem k absenci dat a nutnosti histologické verifikace není kapslová enteroskopie doporučována jako metoda dispenzarizace po léčbě tenkostřevních lymfomů.
Náhodný nález malých polypů tenkého střeva benigního vzhledu není u pacientů bez polypozního syndromu indikací k dalšímu vyšetřování. V těchto případech doporučujeme provedení kontrolní kapslové endoskopie tenkého střeva v čase (po 1 roce) k vyloučení změny jejich charakteru či progrese velikosti.
6.1.4. Familiární polypózy s postižením tenkého střeva
Riziko vzniku nádorových i nenádorových komplikací polypů tenkého střeva u pacientů postižených familiárními polypózami snižuje pravidelná dispenzarizace tenkého střeva. Klasická enteroklýza je pro dispenzarizaci těchto pacientů (vzhledem ke kumulativní radiační zátěži a relativně nízké senzitivitě) nevhodná. MR enterografie a kapslová enteroskopie mají dle limitovaných literárních údajů srovnatelnou senzitivitu především pro polypy > 10–15 mm a vyšší senzitivitu pro polypy menší [70–72]. MR enterografie je schopna přesněji určovat velikost a lokalizaci polypů.
U pacientů s Peutz-Jeghersovým syndromem stoupá riziko invaginace vyžadující chirurgické řešení s velikostí polypů, signifikantní riziko existuje pro polypy > 15 mm [73]. Zařazení kapslové enteroskopie do dispenzárního programu pomáhá optimálnímu načasování enteroskopie (intraoperační či hluboké) a určení způsobu provedení hluboké enteroskopie (orální nebo anální přístup) s následným endoskopickým či chirurgickým odstraněním rizikových polypů (větších než 15 mm). U nemocných s Peutz-Jeghersovým syndromem doporučujeme provedení vstupní kapslové enteroskopie (nebo MR enterografie) ve věku 10 a 18 let a další dispenzární kapslové enteroskopie (nebo MR enterografie) při průkazu polypózy v intervalu 1–3 let [74].
U pacientů s familiární adenomatózní polypózou jsou součástí dispenzárního programu pravidelná vyšetření duodena. Vzhledem k horší přehlednosti oblasti Vaterovy papily a perivaterské oblasti není kapslová endoskopie tenkého střeva vhodná k detekci ampulomů či adenomů duodena. Vyšetření tenkého střeva kapslovou endoskopií je indikováno individuálně, pro přesnější doporučení chybí vědecká data.
6.1.5. Enteropatie z nesteroidních antiflogistik
Vysoká diagnostická výtěžnost kapslové enteroskopie pro drobné a povrchové léze umožňuje její využití také v identifikaci endoskopických projevů enteropatie z nesteroidních antiflogistik (NSAID – non-steroidal anti-inflammatory drugs). Postižení tenkého střeva u nemocných chronicky užívajících NSAID je relativně časté (45 %), signifikantní nálezy (mnohočetné eroze či ulcerace) lze očekávat u 5 % nemocných [53]. Indikací k vyšetření kapslovou endoskopií je u těchto pacientů především suspektní krvácení do tenkého střeva (zjevné nebo okultní) a nejasná hypoproteinemie. Kromě diafragmatických stenóz (koncentrické prstence, u kterých je vazivová membrána kryta normální sliznicí) je endoskopický obraz enteropatie relativně nespecifický (zarudnutí, eroze, ulcerace, krvácení) a diferenciálně diagnosticky musí být vyloučena především CD tenkého střeva.
6.1.6. Celiakie
Přestože má kapslová enteroskopie vysokou senzitivitu i specificitu pro identifikaci typických endoskopických znaků celiakie [75], není vzhledem ke klíčovému postavení histologického vyšetření v její primární diagnostice indikována. Významnější je podle našeho názoru možnost využití metody v identifikaci komplikací celiakie (lymfom, adenokarcinom, ulcerózní jejunoileitida).
Kapslovou endoskopii indikujeme u nemocných s celiakií a relapsem obtíží či při známkách suspektního krvácení do tenkého střeva přes dobrou adherenci k bezlepkové dietě. U pacientů s refrakterní sprue doporučujeme zvažovat kontrolní vyšetření endoskopickou kapslí každý rok a provedení kontrolního histologického vyšetření z duodena vždy při podezření na komplikaci, event. 1× za 2 roky. Hluboká enteroskopie je indikována následně selektivně na základě nálezu kapslové enteroskopie.
6.2. Kapslová koloskopie
6.2.1. Detekce neoplastických lézí
Koloskopie zůstává zlatým standardem vyšetření tlustého střeva u nemocných zařazených do screeningových a dispenzárních programů neoplazií tračníku. U části osob indikovaných z těchto důvodů ke koloskopickému vyšetření pozorujeme často obavy z průběhu vyšetření, které vedou u některých z nich k jeho odmítání. U další skupiny vyšetřovaných je koloskopie z technických či anatomických příčin neúspěšná (nekompletní – bez hluboké intubace céka). Oběma skupinám je nutné nabídnou alternativní neinvazivní diagnostický test s dostatečnou senzitivitou i specificitou.
Jednou z možností je provedení CT kolografie, kterou preferujeme u nemocných s organickou překážkou v oblasti tračníku (stenóza, stenozující tumor). Nevýhodami metody jsou nedostatečná senzitivita pro ploché neoplastické a pokročilé pilovité léze [76,77] a radiační zátěž.
Druhou možností je provedení kapslové koloskopie. V současnosti dostupné srovnávací studie využívající kapsli druhé generace (PillCamTM COLON 2) prokazují senzitivitu 79–89 % a specificitu 64–97 % pro signifikantní léze (definované pro nemožnost odběru histologického vzorku jako ≥ 6 mm) [78–86]. Relativně nižší specificita v některých studiích je způsobena spíše nepřesností v určování velikostí neoplastických lézí, a tedy diskrepancí mezi kapslovou koloskopií a koloskopií, než skutečnou falešnou negativitou. Studie srovnávající kapslovou koloskopii a CT kolografii neprokazují významnou superioritu některé z metod v identifikaci kolorektální neoplazie [78,87], kapslová koloskopie je pravděpodobně senzitivnější pro ploché léze, ačkoli má stále nižší senzitivitu pro pravostranné a sesilní pilovité léze ve srovnání s koloskopií. Významnými limitacemi kapslové koloskopie zůstávají cena a fakt, že vyšetření není v ČR hrazeno zdravotními pojišťovnami, extenzivní příprava a nutnost provedení koloskopie v případě patologického nálezu. Kapslovou koloskopii doporučujeme zvažovat jako alternativu k CT kolografii u nemocných v průměrném riziku kolorektální neoplázie, bez stenózy trávicí trubice, kteří nechtějí nebo nemohou absolvovat pankoloskopické vyšetření (v závislosti na lokální dostupnosti a zkušenostech s metodami).
6.2.2. Idiopatické střevní záněty
V současnosti nelze vyšetření kapslovou koloskopií doporučit jako alternativu koloskopie u nemocných s IBD.
7. Kontraindikace
Absolutní kontraindikací vyšetření endoskopickou kapslí obecně jsou odmítnutí vyšetření svéprávným pacientem, mechanický ileus a perforace trávicí trubice. Mezi relativní kontraindikace patří těhotenství (kapslová endoskopie je teoreticky proveditelná se souhlasem a po podrobném poučení pacientky při stavu přímo ohrožujícím její život; byly publikovány pouze kazuistiky dokumentující tento přístup [88]).
Mezi další relativní kontraindikace patří stenózy a píštěle tenkého střeva, polykací obtíže, Zenkerův divertikl, divertikulóza tenkého střeva a celkově špatný klinický stav pacienta. V případě neschopnosti nemocného endoskopickou kapsli polknout, při Zenkerově divertiklu nebo při jiných anatomických abnormalitách orálního GIT lze kapsli zavést do jícnu a duodena s využitím dedikovaného zavaděče či pomocí košíku endoskopicky. V průběhu vyšetření je kontraindikováno provedení MR.
Dříve zvažované interference mezi kapslovým endoskopem (využívajícím bezdrátový přenos obrazu) a kardiostimulátorem/implantabilním kardioverter defibrilátorem (ICD – implantable cardioverter-defibrillator) nebyly opakovaně potvrzeny, byla pozorována interference systémů levokomorové srdeční podpory (LVAD – left ventricle assist device) s obrazem endoskopické kapsle [89–91]. Přítomnost ICD nebo kardiostimulátoru tedy není kontraindikací vyšetření endoskopickou kapslí.
8. Komplikace, jejich prevence a řešení
Závažné komplikace vyšetření kapslovou endoskopií jsou výjimečné a lze jim často úspěšně předcházet. Zásadní je identifikace rizikových skupin pacientů ještě před indikací vyšetření, event. modifikace jeho průběhu.
Retence endoskopické kapsle (definovná jako zadržení kapsle v GIT – nejčastěji v tenkém střevě – po dobu delší než 2 týdny) se vyskytuje u 2–8 % vyšetření [92]. Retenci je nutné odlišovat od lokálních abnormalit pasáže, což je přetrvávání kapsle v jednom segmentu střeva nejméně 60 min. Retence kapsle je většinou asymptomatická (symptomy jsou pozorovány u cca 3 % retencí [92]) a nevyžaduje akutní intervenci. Při nejistotě o vyloučení kapsle ve stolici po uplynutí 14 dní a současně neúplném vyšetření tenkého střeva (záznam ukončen před dosažením céka) diagnostikujeme tuto komplikaci pomocí skiaskopie či nativního RTG snímku břicha.
Před vlastním vyšetřením je vhodné vytipovat pacienty s vyšším rizikem retence (CD, tumory tenkého či tlustého střeva, postiradiační či ischemická enteritida, břišní operace v anamnéze, chronické užívání nesteroidních antiflogistik v anamnéze nebo známá stenóza trávicí trubice). Riziko retence endoskopické kapsle je významně zvýšeno především u známé CD (až na 13 %) [93]. U suspektní CD bez obstruktivních symptomů nebo známé stenózy tenkého střeva je riziko retence kapsle na druhou stranu podobné jako u nemocných se suspektním krvácením do tenkého střeva a pohybuje se okolo 1 % [93–95]. U nemocných se subileózními stavy v anamnéze, známou stenózou tenkého střeva či vyšším rizikem retence endoskopické kapsle (viz výše) obecně preferujeme CT/MR enterografii před kapslovou enteroskopií.
Určitou limitací zobrazovacích metod je tendence k nadhodnocování významnosti stenóz (vysoká negativní prediktivní hodnota a senzitivita, nízká specificita pro retenci endoskopické kapsle [96]). Pokud tedy trvá indikace k vyšetření kapslovou enteroskopií a dle předchozího RTG zobrazovacího vyšetření je přítomna stenóza tenkého střeva nejasného klinického významu (bez symptomů obstrukce, bez prestenotické dilatace), lze zvažovat hlubokou enteroskopii nebo kapslovou enteroskopii po předchozím úspěšném průchodu tzv. retenční kapsle (PillCam™ Patency Capsule). Kapslovou enteroskopii lze provést tam, kde retenční kapsle opustí trávicí trakt do 30 hod, RTG vyšetření prokazuje její přítomnost v tračníku, nebo odchází stolicí ještě po 30 hod neporušená [97]. Pokud dojde k její retenci v oblasti stenózy, dochází k její dezintegraci a odchodu fragmentů v průběhu 72 hod.
Pokud je diagnostikována retence endoskopické kapsle, indikujeme podle příčiny konzervativní protizánětlivou léčbu (zánětlivé stenózy především u CD), endoskopickou extrakci a balonovou dilataci stenózy (při symptomatické retenci nebo při selhání konzervativní terapie) či chirurgickou extrakci (při selhání endoskopické extrakce či indikaci chirurgického řešení). Gastroskopicky lze řešit situaci, kdy kapsle uvázne v orálnějších partiích traktu (porucha evakuace žaludku). V případě včasné identifikace takové komplikace lze ještě aktivní endoskopickou kapsli zavést do duodena pomocí košíku.
Další závažné komplikace vyšetření jako aspirace či rozpad retinované kapsle jsou raritní [98,99].
9. Návaznost dalších vyšetření
Pracoviště provádějící kapslovou enteroskopii musí provádět nebo mít bezprostřední návaznost na pracoviště provádějící intraoperační a hlubokou enteroskopii (jedno-/dvojbalonová, spirální enteroskopie). Nezbytností je také těsná spolupráce s chirurgem.
10. Evidence vedlejších příhod a komplikací
Každá nestandardní situace (subjektivně vnímaná pacientem či objektivně zjistitelná) vzniklá v příčinné či časové souvislosti s endoskopickým vyšetřením musí být zaznamenána. Mezi závažné komplikace patří ty, které vyžadují zvláštní léčebný zákrok, hospitalizaci či prodloužení hospitalizace. Závažné komplikace vyžadují archivaci a statistické vyhodnocování.
Závěr
Kapslová enteroskopie představuje spolu s hlubokou (jedno-/dvojbalonovou či spirální) enteroskopií základní endoskopickou techniku vyšetření tenkého střeva. Kapslová koloskopie může být v úzce definovaných indikacích vyšetření komplementární ke koloskopii.
Technický rozvoj a nárůst informací o metodice, indikacích, kontraindikacích a rizicích s sebou přináší množství nových poznatků, které jsme se snažili přehledně včlenit do výše uvedeného textu s cílením na praktické využití metody. Další medicínský i technický pokrok může v blízké době významně tato doporučení měnit a modifikovat.
Doručeno/Submitted: 15. 10. 2019
Přijato/Accepted: 18. 10. 2019
doc. MUDr. Ilja Tachecí, Ph.D.
II. interní gastroenterologická klinika
LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
tachecii@lfhk.cuni.cz

Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Tacheci I, Suchánek Š, Drastich P et al. Standard ČGS pro kapslovou endoskopii tenkého střeva. Gastroent Hepatol 2011; 65(4): 195–201.
2. Pennazio M, Spada C, Eliakim R et al. Small-bowel capsule endoscopy and device-assisted enteroscopy for diagnosis and treatment of small-bowel disorders: European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline. Endoscopy 2015; 47(4): 352–376. doi: 10.1055/s-0034-1391855.
3. Rondonotti E, Spada C, Adler S et al. Small-bowel capsule endoscopy and device-assisted enteroscopy for diagnosis and treatment of small-bowel disorders: European Society of Gastrointestinal Endoscopy (ESGE) Technical Review. Endoscopy 2018; 50(4): 423–446. doi: 10.1055/a-0576-0566.
4. Spada C, Hassan C, Galmiche JP et al. Colon capsule endoscopy: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2012; 44(5): 527–536. doi: 10.1055/s-0031-1291717.
5. Gkolfakis P, Tziatzios G, Dimitriadis GD et al. Meta-analysis of randomized controlled trials challenging the usefulness of purgative preparation before small-bowel video capsule endoscopy. Endoscopy 2018; 50(7): 671–683. doi: 10.1055/s-0043-125207.
6. Kotwal VS, Attar BM, Gupta S et al. Should bowel preparation, antifoaming agents, or prokinetics be used before video capsule endoscopy? A systematic review and meta-analysis. Eur J Gastroenterol Hepatol 2014; 26(2): 137–145. doi: 10.1097/MEG.0b013e328365b9d4.
7. Niv Y. Efficiency of bowel preparation for capsule endoscopy examination: a meta-analysis. World J Gastroenterol 2008; 14(9): 1313–1317. doi: 10.3748/wjg.14.1313.
8. Oliva S, Cucchiara S, Spada C et al. Small bowel cleansing for capsule endoscopy in paediatric patients: a prospective randomized single-blind study. Dig Liver Dis 2014; 46(1): 51–55. doi: 10.1016/j.dld.2013.08.130.
9. Park SC, Keum B, Seo YS et al. Effect of bowel preparation with polyethylene glycol on quality of capsule endoscopy. Dig Dis Sci 2011; 56(6): 1769–1775. doi: 10.1007/s10620-010-1500-2.
10. Pons Beltrán V, González Suárez B, González Asanza C et al. Evaluation of different bowel preparations for small bowel capsule endoscopy: a prospective, randomized, controlled study. Dig Dis Sci 2011; 56(10): 2900–2905. doi: 10.1007/s10620-011-1693-z.
11. Rokkas T, Papaxoinis K, Triantafyllou K et al. Does purgative preparation influence the diagnostic yield of small bowel video capsule endoscopy?: a meta-analysis. Am J Gastroenterol 2009; 104(1): 219–227. doi: 10.1038/ajg.2008.63.
12. Wu S, Gao YJ, Ge ZZ. Optimal use of polyethylene glycol for preparation of small bowel video capsule endoscopy: a network meta-analysis. Curr Med Res Opin 2017; 33(6): 1149–1154. doi: 10.1080/03007995.2017.1308922.
13. Hosono K, Endo H, Sakai E et al. Optimal approach for small bowel capsule endoscopy using polyethylene glycol and metoclopramide with the assistance of a real-time viewer. Digestion 2011; 84(2): 119–125. doi: 10.1159/000323225.
14. Ito T, Ohata K, Ono A et al. Prospective controlled study on the effects of polyethylene glycol in capsule endoscopy. World J Gastroenterol 2012; 18(15): 1789–1792. doi: 10.3748/wjg.v18.i15.1789.
15. Xavier S, Rosa B, Monteiro S et al. Bowel preparation for small bowel capsule endoscopy – the later, the better! Dig Liver Dis 2019; 51(10): 1388–1391. doi: 10.1016/j.dld.2019.04.014.
16. Choi NK, Lee J, Chang Y et al. Acute renal failure following oral sodium phosphate bowel preparation: a nationwide case-crossover study. Endoscopy 2014; 46(6): 465–470. doi: 10.1055/s-0034-1365419.
17. Belsey J, Epstein O, Heresbach D. Systematic review: adverse event reports for oral sodium phosphate and polyethylene glycol. Aliment Pharmacol Ther 2009; 29(1): 15–28. doi: 10.1111/j.1365-2036.2008.03837.x.
18. Magalhães-Costa P, Carmo J, Bispo M et al. Superiority of the split-dose PEG regimen for small-bowel capsule endoscopy: a randomized controlled trial. J Clin Gastroenterol 2016; 50(7): e65–70. doi: 10.1097/MCG.0000000000000460.
19. Wu L, Cao Y, Liao C et al. Systematic review and meta-analysis of randomized controlled trials of Simethicone for gastrointestinal endoscopic visibility. Scand J Gastroenterol 2011; 46(2): 227–235. doi: 10.3109/00365521.2010.525714.
20. Albert J, Göbel CM, Lesske J et al. Simethicone for small bowel preparation for capsule endoscopy: a systematic, single-blinded, controlled study. Gastrointest Endosc 2004; 59(4): 487–491. doi: 10.1016/s0016-5107(04)00003-3.
21. Hartmann D, Keuchel M, Philipper M et al. A pilot study evaluating a new low-volume colon cleansing procedure for capsule colonoscopy. Endoscopy 2012; 44(5): 482–486. doi: 10.1055/s-0031-1291611.
22. Kakugawa Y, Saito Y, Saito S et al. New reduced volume preparation regimen in colon capsule endoscopy. World J Gastroenterol 2012; 18(17): 2092–2098. doi: 10.3748/wjg.v18.i17.2092.
23. Shibuya T, Mori H, Takeda T et al. The relationship between physical activity level and completion rate of small bowel examination in patients undergoing capsule endoscopy. Intern Med 2012; 51(9): 997–1001. doi: 10.2169/internalmedicine.51.6581.
24. Yazici C, Losurdo J, Brown MD et al. Inpatient capsule endoscopy leads to frequent incomplete small bowel examinations. World J Gastroenterol 2012; 18(36): 5051–5057. doi: 10.3748/wjg.v18.i36.5051.
25. Koulaouzidis A, Giannakou A, Yung DE et al. Do prokinetics influence the completion rate in small-bowel capsule endoscopy? A systematic review and meta-analysis. Curr Med Res Opin 2013; 29(9): 1171–1185. doi: 10.1185/03007995.2013.818532.
26. Kroijer R, Dyrvig AK, Kobaek-Larsen M et al. Booster medication to achieve capsule excretion in colon capsule endoscopy: a randomized controlled trial of three regimens. Endosc Int Open 2018; 6(11): e1363–e1368. doi: 10.1055/a-0732-494.
27. Dokoutsidou H, Karagiannis S, Giannakoulopoulou E et al. A study comparing an endoscopy nurse and an endoscopy physician in capsule endoscopy interpretation. Eur J Gastroenterol Hepatol 2011; 23(2): 166–170. 10.1097/meg.0b013e3283433abf.
28. Yung DE, Boal Carvalho P, Giannakou A et al. Clinical validity of flexible spectral imaging color enhancement (FICE) in small-bowel capsule endoscopy: a systematic review and meta-analysis. Endoscopy 2017; 49(3): 258–269. doi: 10.1055/s-0042-122015.
29. Koulaouzidis A, Douglas S, Plevris JN. Blue mode does not offer any benefit over white light when calculating Lewis score in small-bowel capsule endoscopy. World J Gastrointest Endosc 2012; 4(2): 33–37. doi: 10.4253/wjge.v4.i2.33.
30. Tacheci I (ed). Kapslová endoskopie. Hradec Králové: Nucleus HK 2008.
31. Korman LY, Delvaux M, Gay G et al. Capsule endoscopy structured terminology (CEST): proposal of a standardized and structured terminology for reporting capsule endoscopy procedures. Endoscopy 2005; 37(10): 951–959. doi: 10.1055/s-2005-870329.
32. Gerson LB, Fidler JL, Cave DR et al. ACG clinical guideline: diagnosis and management of small bowel bleeding. Am J Gastroenterol 2015; 110(9): 1265–1287, 1288. doi: 10.1038/ajg.2015.246.
33. Juanmartiñena Fernández JF, Fernández-Urien Sainz I, Zabalza Ollo B et al. Gastroduodenal lesions detected during small bowel capsule endoscopy: incidence, diagnostic and therapeutic impact. Rev Esp Enferm Dig 2018; 110(2): 102–108. doi: 10.17235/reed.2017.5114/2017.
34. Tacheci I, Devière J, Kopacova M et al. The importance of upper gastrointestinal lesions detected with capsule endoscopy in patients with obscure digestive bleeding. Acta Gastroenterol Belg 2011; 74(3): 395–399.
35. Hartmann D, Schmidt H, Bolz G et al. A prospective two-center study comparing wireless capsule endoscopy with intraoperative enteroscopy in patients with obscure GI bleeding. Gastrointest Endosc 2005; 61(7): 826–832. doi: 10.1016/s0016-5107(05)00372-x.
36. Teshima CW, Kuipers EJ, van Zanten SV et al. Double balloon enteroscopy and capsule endoscopy for obscure gastrointestinal bleeding: an updated meta-analysis. J Gastroenterol Hepatol 2011; 26(5): 796–801. doi: 10.1111/j.1440-1746.2010.06530.x.
37. Liao Z, Gao R, Xu C et al. Indications and detection, completion, and retention rates of small-bowel capsule endoscopy: a systematic review. Gastrointest Endosc 2010; 71(2): 280–286. doi: 10.1016/j.gie.2009.09.031.
38. Pennazio M, Santucci R, Rondonotti E et al. Outcome of patients with obscure gastrointestinal bleeding after capsule endoscopy: report of 100 consecutive cases. Gastroenterology 2004; 126(3): 643–653. doi: 10.1053/j.gastro.2003.11.057.
39. Singh A, Marshall C, Chaudhuri B et al. Timing of video capsule endoscopy relative to overt obscure GI bleeding: implications from a retrospective study. Gastrointest Endosc 2013; 77(5): 761–766. doi: 10.1016/j.gie.2012.11.041.
40. Lepileur L, Dray X, Antonietti M et al. Factors associated with diagnosis of obscure gastrointestinal bleeding by video capsule enteroscopy. Clin Gastroenterol Hepatol 2012; 10(12): 1376–1380. doi: 10.1016/j.cgh.2012.05.024.
41. Saurin JC, Delvaux M, Gaudin JL et al. Diagnostic value of endoscopic capsule in patients with obscure digestive bleeding: blinded comparison with video push-enteroscopy. Endoscopy 2003; 35(7): 576–584. doi: 10.1055/s-2003-40244.
42. Tsuboi A, Oka S, Tanaka S et al. The clinical usefulness of the PillCam progress indicator for route selection in double balloon endoscopy. Intern Med 2019; 58(10): 1375–1381. doi: 10.2169/internalmedicine.2043-18.
43. Yung DE, Koulaouzidis A, Avni T et al. Clinical outcomes of negative small-bowel capsule endoscopy for small-bowel bleeding: a systematic review and meta-analysis. Gastrointest Endosc 2017; 85(2): 305–317. doi: 10.1016/j.gie.2016.08.027.
44. Viazis N, Papaxoinis K, Vlachogiannakos J et al. Is there a role for second-look capsule endoscopy in patients with obscure GI bleeding after a nondiagnostic first test? Gastrointest Endosc 2009; 69(4): 850–856. doi: 10.1016/j.gie.2008.05.053.
45. Goddard AF, James MW, McIntyre AS et al. Guidelines for the management of iron deficiency anaemia. Gut 2011; 60(10): 1309–1316. doi: 10.1136/gut.2010.228874.
46. Yung DE, Vijayan S, Avni T et al. Fecal occult blood testing for the prediction of small-bowel pathology detected by capsule endoscopy: a systematic review and meta-analysis. Ann Gastroenterol 2017; 30(2): 186–191. doi: 10.20524/aog.2017.0122.
47. Dionisio PM, Gurudu SR, Leighton JA et al. Capsule endoscopy has a significantly higher diagnostic yield in patients with suspected and established small-bowel Crohn’s disease: a meta-analysis. Am J Gastroenterol 2010; 105(6): 1240–1248. doi: 10.1038/ajg.2009.713.
48. Kopylov U, Yung DE, Engel T et al. Diagnostic yield of capsule endoscopy versus magnetic resonance enterography and small bowel contrast ultrasound in the evaluation of small bowel Crohn’s disease: systematic review and meta-analysis. Dig Liver Dis 2017; 49(8): 854–863. doi: 10.1016/j.dld.2017.04.013.
49. Choi M, Lim S, Choi MG et al. Effectiveness of capsule endoscopy compared with other diagnostic modalities in patients with small bowel Crohn’s disease: a meta-analysis. Gut Liver 2017; 11(1): 62–72. doi: 10.5009/gnl16015.
50. Eliakim R, Spada C, Lapidus A et al. Evaluation of a new pan-enteric video capsule endoscopy system in patients with suspected or established inflammatory bowel disease – feasibility study. Endosc Int Open 2018; 6(10): e1235–e1246. doi: 10.1055/a-0677-170.
51. Solem CA, Loftus EV Jr, Fletcher JG et al. Small-bowel imaging in Crohn’s disease: a prospective, blinded, 4-way comparison trial. Gastrointest Endosc 2008; 68(2): 255–266. doi: 10.1016/j.gie.2008.02.017.
52. Tacheci I, Bradna P, Douda T et al. Small intestinal injury in NSAID users suffering from rheumatoid arthritis or osteoarthritis. Rheumatol Int 2016; 36(11): 1557–1561. doi: 10.1007/s00296-016-3552-x.
53. Tacheci I, Bradna P, Douda T et al. Wireless capsule enteroscopy in healthy volunteers. Acta Medica (Hradec Kralove) 2016; 59(3): 79–83. doi: 10.14712/18059694.2016.93.
54. Shim KN, Kim YS, Kim KJ et al. Abdominal pain accompanied by weight loss may increase the diagnostic yield of capsule endoscopy: a Korean multicenter study. Scand J Gastroenterol 2006; 41(8): 983–988. doi: : 10.1080/00365520600548974.
55. Adler SN, Yoav M, Eitan S et al. Does capsule endoscopy have an added value in patients with perianal disease and a negative work up for Crohn’s disease? World J Gastrointest Endosc 2012; 4(5): 185–188. doi: 10.4253/wjge.v4.i5.185.
56. De Bona M, Bellumat A, Cian E et al. Capsule endoscopy findings in patients with suspected Crohn’s disease and biochemical markers of inflammation. Dig Liver Dis 2006; 38(5): 331–335. doi: 10.1016/j.dld.2006.02.004.
57. Koulaouzidis A, Douglas S, Plevris JN. Lewis score correlates more closely with fecal calprotectin than Capsule Endoscopy Crohn’s Disease Activity Index. Dig Dis Sci 2012; 57(4): 987–993. doi: 10.1007/s10620-011-1956-8.
58. Kopylov U, Yung DE, Engel T et al. Fecal calprotectin for the prediction of small-bowel Crohn’s disease by capsule endoscopy: a systematic review and meta-analysis. Eur J Gastroenterol Hepatol 2016; 28(10): 1137–1144. doi: 10.1097/MEG.0000000000000692.
59. Gal E, Geller A, Fraser G et al. Assessment and validation of the new capsule endoscopy Crohn’s disease activity index (CECDAI). Dig Dis Sci 2008; 53(7): 1933–1937. doi: 10.1007/s10620-007-0084-y.
60. Gralnek IM, Defranchis R, Seidman E et al. Development of a capsule endoscopy scoring index for small bowel mucosal inflammatory change. Aliment Pharmacol Ther 2008; 27(2): 146–154. doi: 10.1111/j.1365-2036.2007.03556.x.
61. Kopylov U, Nemeth A, Koulaouzidis A et al. Small bowel capsule endoscopy in the management of established Crohn’s disease: clinical impact, safety, and correlation with inflammatory biomarkers. Inflamm Bowel Dis 2015; 21(1): 93–100. doi: 10.1097/MIB.0000000000000255.
62. Yang L, Ge ZZ, Gao YJ et al. Assessment of capsule endoscopy scoring index, clinical disease activity, and C-reactive protein in small bowel Crohn’s disease. J Gastroenterol Hepatol 2013; 28(5): 829–833. doi: 10.1111/jgh.12146.
63. Efthymiou A, Viazis N, Mantzaris G et al. Does clinical response correlate with mucosal healing in patients with Crohn’s disease of the small bowel? A prospective, case-series study using wireless capsule endoscopy. Inflamm Bowel Dis 2008; 14(11): 1542–1547. doi: 10.1002/ibd.20509.
64. Monteiro S, Dias de Castro F, Boal Carvalho P et al. Essential role of small bowel capsule endoscopy in reclassification of colonic inflammatory bowel disease type unclassified. World J Gastrointest Endosc 2017; 9(1): 34–40. doi: 10.4253/wjge.v9.i1.34.
65. Rondonotti E, Pennazio M, Toth E et al. Small-bowel neoplasms in patients undergoing video capsule endoscopy: a multicenter European study. Endoscopy 2008; 40(6): 488–495. doi: 10.1055/s-2007-995783.
66. Johnston CA, Yung DE, Joshi A et al. Small bowel malignancy in patients undergoing capsule endoscopy at a tertiary care academic center: case series and review of the literature. Endosc Int Open 2017; 5(6): e463–e470. doi: 10.1055/s-0043-106186.
67. Kopacova M, Rejchrt S, Bures J et al. Small intestinal tumours. Gastroenterol Res Pract 2013; 2013: 702536. doi: 10.1155/2013/702536.
68. Hakim FA, Alexander JA, Huprich JE et al. CT-enterography may identify small bowel tumors not detected by capsule endoscopy: eight years experience at Mayo Clinic
Rochester. Dig Dis Sci 2011; 56(10): 2914–2919. doi: 10.1007/s10620-011-1773-0.
69. Girelli CM, Porta P. Bulge or mass? A diagnostic dilemma of capsule endoscopy. Endoscopy 2008; 40(8): 703–704. doi: 10.1055/s-2008-1077483.
70. Gupta A, Postgate AJ, Burling D et al. A prospective study of MR enterography versus capsule endoscopy for the surveillance of adult patients with Peutz-Jeghers syndrome. AJR Am J Roentgenol 2010; 195(1): 108–116. doi: 10.2214/AJR.09.3174.
71. Caspari R, von Falkenhausen M, Krautmacher C et al. Comparison of capsule endoscopy and magnetic resonance imaging for the detection of polyps of the small intestine in patients with familial adenomatous polyposis or with Peutz-Jeghers’ syndrome. Endoscopy 2004; 36(12): 1054–1059. doi: 10.1055/s-2004-826041.
72. Urquhart P, Grimpen F, Lim GJ et al. Capsule endoscopy versus magnetic resonance enterography for the detection of small bowel polyps in Peutz-Jeghers syndrome. Fam Cancer 2014; 13(2): 249–255. doi: 10.1007/s10689-014-9700-0.
73. van Lier MG, Mathus-Vliegen EM, Wagner A et al. High cumulative risk of intussusception in patients with Peutz-Jeghers syndrome: time to update surveillance guidelines? Am J Gastroenterol 2011; 106(5): 940–945. doi: 10.1038/ajg.2010.473.
74. Beggs AD, Latchford AR, Vasen HF et al. Peutz-Jeghers syndrome: a systematic review and recommendations for management. Gut 2010; 59(7): 975–986. doi: 10.1136/gut.2009.198499.
75. Rokkas T, Niv Y. The role of video capsule endoscopy in the diagnosis of celiac disease: a meta-analysis. Eur J Gastroenterol Hepatol 2012; 24(3). 303–308. doi: 10.1097/MEG.0b013e32834fa914.
76. Jspeert JE, Tutein Nolthenius CJ, Kuipers EJ. CT-colonography vs. colonoscopy for detection of high-risk sessile serrated polyps. Am J Gastroenterol 2016; 111(4): 516–522. doi: 10.1038/ajg.2016.58.
77. Sakamoto T, Mitsuzaki K, Utsunomiya D et al. Detection of flat colorectal polyps at screening CT colonography in comparison with conventional polypoid lesions. Acta Radiol 2012; 53(7): 714–719. doi: 10.1258/ar.2012.110685.
78. Eliakim R, Yassin K, Niv Y et al. Prospective multicenter performance evaluation of the second-generation colon capsule compared with colonoscopy. Endoscopy 2009; 41(12): 1026–1031. doi: 10.1055/s-0029-1215360.
79. Rondonotti E, Borghi C, Mandelli G et al. Accuracy of capsule colonoscopy and computed tomographic colonography in individuals with positive results from the fecal occult blood test. Clin Gastroenterol Hepatol 2014; 12(8): 1303–1310. doi: 10.1016/j.cgh.2013.12.027.
80. Hagel AF, Gäbele E, Raithel M et al. Colon capsule endoscopy: detection of colonic polyps compared with conventional colonoscopy and visualization of extracolonic pathologies. Can J Gastroenterol Hepatol 2014; 28(2): 77–82.
81. Rex DK, Adler SN, Aisenberg J et al. Accuracy of capsule colonoscopy in detecting colorectal polyps in a screening population. Gastroenterology 2015; 148(5): 948–957. doi: 10.1053/j.gastro.2015.01.025.
82. Saito Y, Saito S, Oka S et al. Evaluation of the clinical efficacy of colon capsule endoscopy in the detection of lesions of the colon: prospective, multicenter, open study. Gastrointest Endosc 2015; 82(5): 861–869. doi: 10.1016/j.gie.2015.02.004.
83. Igawa A, Oka S, Tanaka S et al. Evaluation for the clinical efficacy of colon capsule endoscopy in the detection of laterally spreading tumors. Digestion 2017; 95(1): 43–48. doi: 10.1159/000452367.
84. Ota Y, Yamada A, Kobayashi Y et al. Diagnostic capability of colon capsule endoscopy for advanced colorectal cancer: a pilot study. Dig Endosc 2017; 29(6): 695–701. doi: 10.1111/den.12862.
85. Parodi A, Vanbiervliet G, Hassan C et al. Colon capsule endoscopy to screen for colorectal neoplasia in those with family histories of colorectal cancer. Gastrointest Endosc 2018; 87(3): 695–704. doi: 10.1016/j.gie.2017.05.023.
86. Voska M, Zavoral M, Grega T et al. Accuracy of colon capsule endoscopy for colorectal neoplasia detection in individuals referred for a screening colonoscopy. Gastroenterol Res Pract 2019; 2019: 8. doi: 10.1155/2019/5975438.
87. Spada C, Hassan C, Barbaro B et al. Colon capsule versus CT colonography in patients with incomplete colonoscopy: a prospective, comparative trial. Gut 2015; 64(2): 272–281. doi: 10.1136/gutjnl-2013-306550.
88. Hogan RB, Ahmad N, Hogan RB et al. Video capsule endoscopy detection of jejunal carcinoid in life-threatening hemorrhage, first trimester pregnancy. Gastrointest Endosc 2007; 66(1): 205–207. doi: 10.1016/j.gie.2006.11.021.
89. Harris LA, Hansel SL, Rajan E et al. Capsule endoscopy in patients with implantable electromedical devices is safe. Gastroenterol Res Pract 2013; 2013: 959234. doi: 10.1155/2013/959234.
90. Stanich PP, Kleinman B, Betkerur K et al. Video capsule endoscopy is successful and effective in outpatients with implantable cardiac devices. Dig Endosc 2014; 26(6): 726–730. doi: 10.1111/den.12288.
91. Moneghini D, Lipari A, Missale G et al. Lack of interference between small bowel capsule endoscopy and implantable cardiac defibrillators: an „in vivo“ electrophysiological study. United European Gastroenterol J 2016; 4(2): 216–220. doi: 10.1177/2050640615608570.
92. Rezapour M, Amadi C, Gerson LB. Retention associated with video capsule endoscopy: systematic review and meta-analysis. Gastrointest Endosc 2017; 85(6): 1157–1168. e1152. doi: 10.1016/j.gie.2016.12.024.
93. Nemeth A, Kopylov U, Koulaouzidis A et al. Use of patency capsule in patients with established Crohn’s disease. Endoscopy 2016; 48(4): 373–379. doi: 10.1055/s-0034-1393560.
94. Kim Y, Jeon SR, Choi SM et al. Practice patterns and clinical significance of use of capsule endoscopy in suspected and established Crohn’s disease. Intest Res 2017; 15(4): 467–474. doi: 10.5217/ir.2017.15.4.467.
95. Höög CM, Bark LÅ, Arkani J et al. Capsule retentions and incomplete capsule endoscopy examinations: an analysis of 2300 examinations. Gastroenterol Res Pract 2012; 2012: 518718. doi: 10.1155/2012/518718.
96. Rozendorn N, Klang E, Lahat A et al. Prediction of patency capsule retention in known Crohn’s disease patients by using magnetic resonance imaging. Gastrointest Endosc 2016; 83(1): 182–187. doi: 10.1016/j.gie.2015.05.048.
97. Herrerias JM, Leighton JA, Costamagna G et al. Agile patency system eliminates risk of capsule retention in patients with known intestinal strictures who undergo capsule endoscopy. Gastrointest Endosc 2008; 67(6): 902–909. doi: 10.1016/j.gie.2007.10.063.
98. Tacheci I, Ryska A, Rejchrt S et al. Spontaneous disintegration of a retained video capsule in a patient with cryptogenic multifocal ulcerous stenosing enteritis: a rare complication. Endoscopy 2008; 40 (Suppl 2): S104–S105. doi: 10.1055/s-2007-966871.
99. Yung DE, Plevris JN, Koulaouzidis A. Short article: aspiration of capsule endoscopes: a comprehensive review of the existing literature. Eur J Gastroenterol Hepatol 2017; 29(4): 428–434. doi: 10.1097/MEG.0000000000000821.
100. Kwack WG, Lim YJ. Current status and research into overcoming limitations of capsule endoscopy. Clin Endosc 2016; 49(1): 8–15. doi: 10.5946/ce.2016.49.1.8.