Současné postavení endoskopické transmurální resekce v léčbě kolorektálních neoplazií
Přemysl Falt Orcid.org 1,2
+ Pracoviště
Souhrn
Endoskopická transmurální resekce (FTRD – full-thickness resection device) je novou technikou endoskopické resekce kolorektálních neoplastických lézí nevhodných k standardní endoskopické resekci. V publikovaných souborech FTRD dosahuje vysoké technické úspěšnosti a proporce R0 resekcí s nízkým výskytem závažných komplikací. Dle limitovaných dat se FTRD zdá být doporučitelnou alternativou technicky a časově náročné endoskopické submukózní disekce (ESD) v léčbě karcinomů s povrchovou submukózní invazí a reziduálních neoplazií zejména mimo rektum. Hlavní limitací FTRD je omezený rozsah resekce a výskyt lokálních reziduálních neoplazií. Správné zařazení FTRD do algoritmu léčby kolorektálních neoplazií je podmíněno prospektivním srovnáním s jinými technikami endoskopické resekce.
Klíčová slova
koloskopie, kolorektální karcinom, endoskopická transmurální resekce, endoskopická submukózní disekce
Digestivní endoskopie: přehledová práce
Úvod
Endoskopická transmurální resekce (FTR – full-thickness resection) je novou metodou umožňující transmurální resekci stěny trávicí trubice. V průběhu let byla studována řada technik FTR lišící se mechanizmem a následností resekce a uzávěru perforačního otvoru [1]. Do rutinní praxe terciárních endoskopických center již pronikla tzv. FTRD technika (FTR Device, Ovesco Endoscopy, Tubingen, Německo), která kombinuje naložení OTS (over-the-scope) klipu na trakční pseudopolyp vytvořený duplikaturou střevní stěny a následnou endoskopickou resekci pomocí kličky naložené v průhledném nástavci OTS klipu. FTRD se tedy řadí mezi tzv. „non-exposed” FTR techniky, u kterých během správně provedeného výkonu nedochází ke vzniku otevřené perforace. FTRD byla po pilotních animálních studiích poprvé představena v roce 2014 [2,3] a v České republice byla poprvé provedena v roce 2016 [4]. Přes prozatímní absenci v platných doporučených postupech se FTRD postupně stává efektivní součástí terapeutického armamentária vybraných kolorektálních neoplazií.
Indikace
K FTRD jsou obecně zvažovány léze, které jsou potenciálně endoskopicky kurabilní a nejsou z nějakého důvodu vhodné k endoskopické slizniční resekci (EMR). Hlavní indikační skupinou jsou léze s podezřením na přítomnost submukózně invadujícího karcinomu a nutností en bloc resekce, dále neoplastické léze s příznakem „non-liftingu“, lokální reziduální neoplazie (LRN) a léze v obtížných lokalizacích (periapendikulární a peridivertikulární léze). Vzácně bývají indikovány drobné subepiteliální tumory (SET), nejčastěji neuroendokrinní tumory. Klíčovým kritériem při zvažování FTRD je velikost léze, která by neměla přesahovat 30 mm. Při pokusu o snesení větších lézí může dojít k následně obtížně řešitelné aplikaci OTS klipu přes neoplastickou tkáň. Rozsah resekce je ale limitován i fixací léze (typicky LRN), případnou polypoidní částí léze a tangenciálním přístupem k lézi. Vtažení léze a vytvoření duplikatury bývá vzhledem k šíři stěny a subperitoneální lokalizaci obtížnější v rektu.
Typickou a vděčnou indikací k FTR jsou kolorektální neoplastické léze se suspektní přítomností submukózně invadujícího karcinomu velikosti do 30 mm a s obvyklou morfologií 0–IIc nebo 0–IIa + IIc dle Pařížské klasifikace, které jsou v případě R0 resekce a absence rizikových známek (hluboká submukózní invaze, nízká diferenciace, lymfovaskulární nebo perineurální invaze, budding vyššího stupně) kurativně řešitelné [5] (obr. 1, 2). Transmurální resekát navíc umožňuje precizní staging pokročilejší neoplazie a FTRD není překážkou následné chirurgické resekce. Zatím není zcela jasné, zda hloubku případné submukózní invaze v resekátech po FTRD lze posuzovat stejným způsobem jako po EMR nebo ESD.
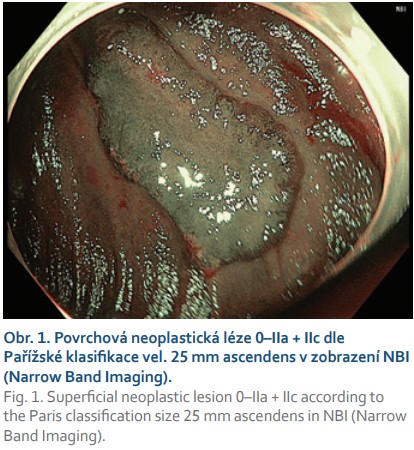
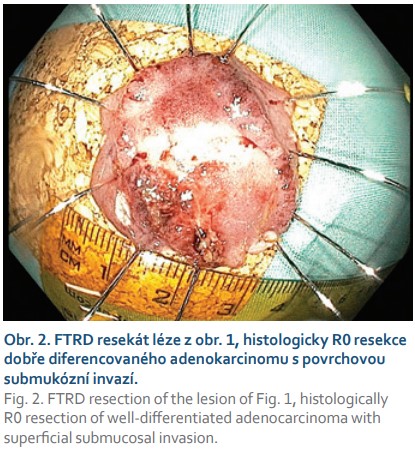
Další častou indikací jsou neoplastické léze s příznakem „non-liftingu“, které jsou i při benigní histologii technicky obtížně resekovatelné a zatíženy rizikem perforace. Nejčastěji se jedná o LRN, obvykle již po neúspěšném endoskopickém ošetření re-EMR a/nebo argonovou plazmakoagulací (obr. 3, 4). Hlavní limitací FTRD při léčbě LRN je jejich obtížné a často asymetrické vtažení do „capu“ kvůli jejich jizevnaté retrakci. Další příčinou „non-liftingu“ může být předchozí pokus o endoskopickou resekci, klešťové biopsie nebo desmoplazie některých typů lézí (LST-NG).
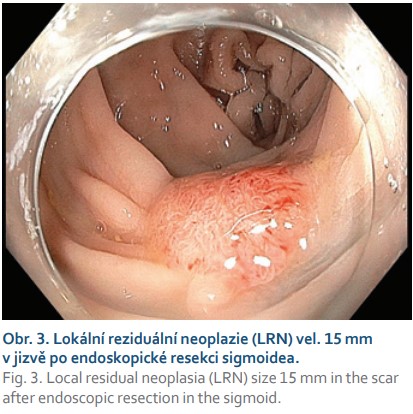
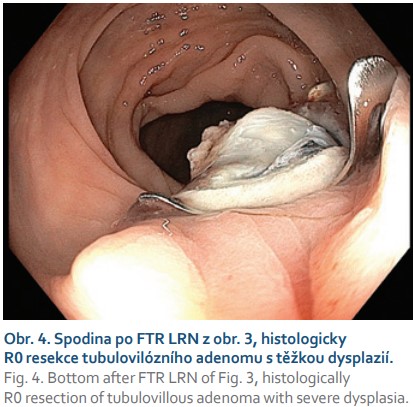
Kontroverzní indikací k FTRD je resekce jizev po předchozí inkompletní resekci nebo nejasném stagingu léze s přítomností invazivního karcinomu. Obvykle jde o nemocné s vysokým perioperačním rizikem a histologicky pozitivním vertikálním resekčním okrajem resekátu. V našem souboru je ve shodě s publikovanými zkušenostmi většina resekátů v této indikaci negativních a staging případné invazivní neoplazie v jizvě může být problematický.
Kontraindikací FTRD jsou obecné kontraindikace provedení koloskopie. Specifickou relativní kontraindikací je obtížná průchodnost koloskopem k místu resekce, těžká divertikulóza a aktivní zánětlivé postižení střevní stěny v místě průchodu FTR setu nebo samotné resekce. Riziko opožděného krvácení je vzhledem ke kompresi OTS klipem pod rovinou řezu pravděpodobně nižší než u jiných technik endoskopické resekce, ale vedení antitrombotické léčby se zatím řídí platnými doporučeními pro EMR a ESD.
Efektivita
Efektivita FTRD v léčbě kolorektálních neoplazií je v publikovaných souborech velmi konzistentní. K zatím výhradně evropským zkušenostem (Německo, Švýcarsko, Itálie, Nizozemsko, Česká republika) recentně přibyl i multicentrický soubor z USA. Do současné doby bylo publikováno celkem devět prospektivních souborů obsahujících více než 50 nemocných [6–12], z toho ve dvou případech jde o objemná data z národních FTRD registrů (Německo, Nizozemsko) [13,14]. Technického úspěchu, tedy dosažení místa resekce, aplikace OTS klipu a resekce vzniklého pseudopolypu kličkou, je dosahováno v 84–97 % případů. Histologicky potvrzená kompletní (R0) resekce je udávána v 79–91 % případů. Ne vždy je pomocí FTRD dosaženo transmurální resekce, která se endoskopicky vyznačuje přítomností tzv. příznaku terče („target sign“) a je potvrzena přítomností svalové vrstvy a případně serózy v resekátu. Ve zmiňovaných souborech bylo transmurální resekce dosaženo v 79–90 % případů a je méně častá v případě resekce fixovaných lézí a při lokalizaci lézí v rektu [13,15]. Po FTRD dochází překvapivě často ke vzniku LRN, v souborech se vyskytuje u 6–14 % pacientů, u kterých byla k dispozici kontrolní koloskopie [7–9,12–14]. Zajímavé je, že LRN vznikají i po resekcích hodnocených jako R0, v německém souboru byly pozitivní (R1) nebo nejisté (Rx) resekční okraje popsány pouze v 72 % případů LRN [13].
Za podrobnou zmínku stojí výsledky z německého FTRD registru, který je zatím největším publikovaným souborem. V 65 centrech bylo provedeno celkem 1 178 FTRD, z toho 67 % bylo adenomů s „non-liftingem“, 18 % časných karcinomů, 7 % SET a 1 % diagnostických transmurálních biopsií. Celkem 54 % lézí bylo před FTRD již minimálně jednou ošetřeno endoskopicky, ve většině případů šlo o inkompletní resekci nebo LRN. Technický úspěch byl zaznamenán v 88 %, R0 resekce v 80 % a transmurální resekce v 90 % případů. Výsledek kontrolní koloskopie byl k dispozici u 58 % a LRN bylo zaznamenáno ve 14 %, ve většině případů (77 %) bylo možné jejich další endoskopické ošetření, z toho v 55 % s dosažením R0 resekce. U 8 % nemocných ošetřených FTRD byla nutná následná chirurgická léčba, z toho v 65 % šlo o následné ošetření nekurativní endoskopické resekce, ve 24 % pro komplikace FTRD a v 10 % pro LRN [13].
Primárním cílem endoskopické léčby časné neoplazie je kurativní resekce, za kterou je považována R0 en bloc resekce neoplazie s nízkým rizikem lymfatické nebo systémové diseminace. Zatímco u větších benigních lézí je akceptována endoskopicky kompletní resekce po částech („piecemeal“) s endoskopicky a histologicky negativní postresekční jizvou, v případě léze obsahující invazivní karcinom je nezbytný přesný histopatologický staging podmíněný en bloc resekcí léze. Proporce kurativních resekcí je tedy snižována technickým neúspěchem FTRD, inkompletní resekcí (R1, R2) a nálezem rizikových histologických známek v R0 resekátu. Nekurativní FTRD se nezdá být překážkou následné chirurgické resekce u nemocného s přiměřeným perioperačním rizikem. V subanalýze německého FTRD registru bylo celkem 156 lézí obsahujících adenokarcinom, z toho 64 po inkompletní resekci maligního polypu a 92 v lézích s „non-liftingem“. Technického úspěchu bylo dosaženo v 92 %, transmurální resekce v 87 % a R0 resekce v 72 % případů. Resekce ale byla hodnocena jako kurativní pouze u 69 nemocných (44 %) a z toho 53 podstoupilo následnou chirurgickou resekci. U 27 nemocných byla v chirurgickém resekátu nalezena reziduální neoplazie a u 5 postižení lymfatických uzlin [16]. V našem souboru 15 karcinomů se submukózní invazí bylo FTRD hodnoceno jako kurativní v 10 případech, ve 4 případech šlo o karcinomy s hlubokou submukózní invazí a v 1 případě o invazi do svalové vrstvy (T2). Následné chirurgické resekce neprokázaly reziduální neoplazii ani lymfatické postižení exstirpovaných uzlin [12]. Z našich zkušeností vyplývá, že proporci kurativních FTRD lze zvýšit prakticky pouze pečlivým výběrem vhodných lézí, a to zejména vhodné velikosti, lokalizace a s morfologií naznačující maximálně povrchovou submukózní invazi (0–IIc/0–IIa+IIc dle Pařížské klasifikace, JNET 2B, pit pattern Vi). Po dosažení určité zkušenosti pravděpodobně nelze vzhledem k mechanizmu FTRD úspěšnost léčby příliš zvyšovat.
Komplikace
Komplikace asociované s FTRD souvisí s principem resekce. Jedná se o otevřené perforace, koagulační syndrom, krvácení, stenózy, píštěle a akutní appendicitidu po resekci periapendikulárních lézí. Výskyt komplikací je udáván v rozmezí 5–13 % a komplikací vyžadujících chirurgickou léčbu ve 2–3 % případů [6–14].
Nejzávažnější lokální komplikací je otevřená perforace, jejíž výskyt je udáván v 1–3 % ošetřených nemocných. Častěji se jedná o intraprocedurální perforaci následkem neuvolnění nebo špatně aplikovaného klipu před resekcí kličkou, kterou lze obvykle ošetřit endoskopicky nasazením dalšího OTS klipu. Proto je vždy důležitá pečlivá inspekce místa resekce novým zavedením koloskopu. Opožděná perforace vzniká během několika dní po výkonu, pravděpodobně v důsledku ischemické nekrózy tkáně uzavřené klipem, a její řešení je chirurgické. Vzhledem k obtížnému zavádění FTRD u některých nemocných lze předpokládat vyšší riziko perforace než při běžné koloskopii, nicméně takový případ zatím nebyl v literatuře popsán.
Koagulační syndrom známý po endoskopické resekci větších kolorektálních lézí se po FTRD vyskytuje výjimečně. Důvodem je pravděpodobně spolehlivý uzávěr místa resekce bez oslabení střevní stěny a použití čistě řezacího proudu.
Významné intraprocedurální krvácení se ve FTRD souborech nevyskytuje, pravděpodobně díky kompresi místa resekce OTS klipem. Opožděné krvácení pravděpodobně souvisí s ulcerací po odloučení OTS klipu, v souborech je jeho výskyt udáván v rozmezí 1–10 %. V drtivé většině případů je krvácení nevýznamné, bez nutnosti intervence nebo krevních převodů. Dle našich zkušeností se opožděné krvácení vyskytuje s odstupem přibližně 2 týdnů, u nemocných na antitrombotické léčbě a při kontrolní koloskopii bývá nalezena postresekční ulcerace bez OTS klipu, který jinak obvykle retinuje až několik měsíců. Časné opožděné krvácení může souviset také se slizničními lézemi při zavádění setu.
Přestože po FTRD někdy dochází k relativní stenóze lumen průchodné pro koloskop, klinicky významná stenóza byla popsána pouze jednou a po její balonkové dilataci navíc došlo k perforaci střeva s nutností chirurgické léčby [9]. Při FTRD také může dojít ke vtažení stěny jiného orgánu do OTS klipu, a tak ke vzniku píštěle, v literatuře je popsán případ enterokolické píštěle po resekci periapendikulární léze [7] a fatální případ enterokolické píštěle s následnou intususcepcí [17].
Specifickým rizikem po FTRD peri- apendikulárních lézí je akutní appendicitida. V multicentrickém souboru 50 nemocných po FTRD periapendikulárních neoplazií byla diagnostikována u 7 (14 %) nemocných, z toho ve 3 případech byla indikována appendektomie a ve 4 případech byl stav zvládnut konzervativně [18]. Zajímavý je případ translokace adenomu na viscerální peritoneum u pacienta po FTRD periapendikulární léze a appendektomii pro následnou akutní appendicitidu [19].
Limitace
Hlavní limitací FTRD je omezený rozsah resekce, a to zejména ve srovnání s ESD. Za maximální rozsah je považováno 30 mm v případě intaktní nefixované léze, optimálně by však velikost léze měla být do 25 mm. V případě fixovaných lézí považujeme za maximální velikost resekce 20 mm, optimálně do 15 mm. Z anatomických důvodů je třeba s menší velikostí resekátu počítat v rektu. V souborech se průměr velikosti ošetřených lézí pohybuje kolem 15 a velikost resekátů kolem 23 mm [12–14]. Rozsah resekce pravděpodobně nelze ovlivnit zvětšením „capu“, manipulace s ním by byla obtížná a navíc by se zvyšovalo riziko zachycení přilehlých orgánů. Omezenou velikost resekce lze v pečlivě vybraných případech obejít tzv. hybridním FTRD, tedy EMR nízkorizikových částí léze a FTRD fixovaného centra léze se všemi aspekty resekce po částech. Tímto způsobem lze ošetřit jak primární léze, tak LRN [20,21]. V jediném publikovaném souboru deseti adenomů s „non-liftingem“ průměrné velikosti 35 mm bylo dosaženo kompletní resekce ve všech případech bez komplikací [22]. Na našem pracovišti jsme zatím tímto způsobem ošetřili osm nemocných. V 7 případech byla resekce hodnocena jako kurativní bez nálezu LRN při kontrolní koloskopii, v 1 případě byl ve FTRD resekátu popsán karcinom s hlubokou invazí a pacient byl indikován k následné chirurgické resekci.
U některých nemocných může být obtížný až nemožný průchod FTRD setem do orálních partií tračníku. Při problematickém zavedení běžného koloskopu s diagnostickým „capem“ lze očekávat velmi obtížné zavedení FTRD setu. Riziková je zejména těžká divertikulóza, naopak při dolichokolon může být zavedení FTRD setu paradoxně jednodušší.
Z anatomických důvodů nejsou k FTRD vhodné léze v distálním rektu a anorektálním přechodu, a to z důvodu obtížné manipulace a tangenciálního přístupu a také možné intolerance přítomnosti klipu pacientem [9]. Také není vhodná resekce lézí v blízkosti Bauhinské chlopně pro riziko stenózy až uzávěru ileocékálního přechodu.
Za významnou limitaci lze považovat i již diskutovaný poměrně vysoký výskyt LRN po FTRD, a tím i nutnost další těsné endoskopické dispenzarizace. Vznik LRN po FTRD zatím není zcela objasněn, minimálně částečným vysvětlením může být obtížná kontrola okrajů léze během FTRD. ESD je naopak asociováno s velmi nízkým výskytem LRN, po R0 resekcích je prakticky nulový a dokonce i po resekcích hodnocených jako R1 je udáván pouze ve 3,6 % případů [23].
Srovnání s jinými technikami endoskopické resekce
Pro stanovení pozice FTRD v algoritmu efektivní a bezpečné léčby kolorektálních neoplazií bude nutné přímé srovnání s ostatními metodami endoskopické resekce, které zatím chybí. Indikační spektrum FTRD se nepřekrývá s endoskopickou polypektomií a jen částečně s en bloc EMR. Naopak většina lézí indikovaných k FTRD by mohla být indikována k ESD a u lézí do 30 mm to platí i naopak. U větších lézí samozřejmě zůstává metodou volby výrazně expert-dependentní a časově náročné ESD, chirurgické řešení nebo v přísně selektovaných případech může být použito hybridní FTRD. Volba resekční techniky pro menší léze bude záležet na řadě faktorů jako velikost, morfologie, fixace a lokalizace léze, zkušenost endoskopisty s oběma metodami, časové možnosti a preference nemocného.
Recentně publikovaná práce z našeho pracoviště srovnává prospektivně sledovaný soubor 52 nemocných ošetřených FTRD s retrospektivním souborem 50 nemocných ošetřených ESD po vyloučení lézí větších 30 mm. Ve FTRD souboru dominovaly léze 0–IIa+IIc v rektu a v ESD souboru LRN léze v průběhu celého tračníku, histologická pokročilost lézí ale byla v obou souborech téměř identická včetně proporce karcinomů se submukózní invazí (29 vs. 28 %). Technická úspěšnost byla významně vyšší při použití FTRD (92 vs. 74 %) stejně jako proporce R0 (85 vs. 62 %) a kurativních resekcí (75 vs. 56 %). Výskyt komplikací byl významně vyšší v ESD souboru (40 vs. 13 %), a to zejména na vrub častého výskytu koagulačního syndromu (24 vs. 0 %) a numericky častějšího výskytu perforace (8 vs. 2 %). Průměrné trvání FTRD bylo významně kratší než ESD (16–65 vs. 90–240 min) stejně jako hospitalizace po výkonu (1,7 ± 1,2 vs. 3,2 ± 1,9 dní). Výskyt LRN byl ve FTRD větvi 12 % ve shodě s publikovanými soubory, zatímco v ESD větvi byla LRN detekována pouze v jednom případě [12]. Velmi žádoucí jsou další, nejlépe multicentrická a randomizovaná pozorování, jako je například zatím probíhající projekt srovnávající FTRD s konvenční endoskopickou resekcí (NCT03868605) [24].
Závěr
Endoskopická transmurální resekce metodou FTRD je novou platformou endoskopické léčby kolorektálních neoplazií nevhodných k endoskopické polypektomii nebo endoskopické slizniční resekci (EMR) s konzistentně vysokou efektivitou a uspokojivým bezpečnostním profilem. Pro léze < 30 mm se FTRD zdá být perspektivní alternativou technicky a časově náročné endoskopické submukózní disekce (ESD), a to zejména mimo rektum, při léčbě časných karcinomů, reziduálních a inkompletně resekovaných lézí. Nevýhodou FTRD je striktně limitovaný rozsah resekce a výskyt lokálních reziduálních neoplazií (LRN) podmiňující nutnost další endoskopické dispenzarizace.
Doručeno/Submitted: 10. 5. 2021
Přijato/Accepted: 19. 5. 2021
doc. MUDr. Přemysl Falt, Ph.D.
II. interní klinika – gastroenterologická a geriatrická
LF UP a FN Olomouc
I. P. Pavlova 185/6
779 00 Olomouc
premysl.falt@fnol.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Schmidt A, Meier B, Caca K. Endoscopic full-thickness resection: current status. World J Gastroenterol 2015; 21(31): 9273–9285. doi: 10.3748/wjg.v21.i31.9273.
2. Schmidt A, Damm M, Caca K. Endoscopic full-thickness resection using a novel over-the-scope device. Gastroenterology 2014; 147(4): 740–742. doi: 10.1053/j.gastro.2014.07. 045.
3. Valli PV, Kaufmann M, Vrugt B et al. Endoscopic resection of a diverticulum-arisen colonic adenoma using a full-thickness resection device. Gastroenterology 2014; 147(5): 969–971. doi: 10.1053/j.gastro.2014.07.053.
4. Falt P, Urban O, Hanousek M et al. “Full-thickness” endoskopická resekce lokální reziduální neoplazie v hepatální flexure – videokazuistika. Gastroent Hepatol 2016; 70(5): 398–401. doi: 10.14735/amgh2016398.
5. Ferlitsch M, Moss A, Hassan C et al. Colorectal polypectomy and endoscopic mucosal resection (EMR): European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline. Endoscopy 2017; 49(3): 270–297. doi: 10.1055/s-0043-102569.
6. Valli PV, Mertens J, Bauerfeind P. Safe and successful resection of difficult GI lesions using a novel single-step full-thickness resection device (FTRD®). Surg Endosc 2018; 32(1): 289–299. doi: 10.1007/s00464-017-5676-9.
7. Schmidt A, Beyna T, Schumacher B et al. Colonoscopic full-thickness resection using an over-the-scope device: a prospective multicentre study in various indications. Gut 2018; 67(7): 1280–1289. doi: 10.1136/gutjnl-2016-313 677.
8. van der Spek B, Haasnoot K, Meischl C et al. Endoscopic full-thickness resection in the colorectum: a single-center case series evaluating indication, efficacy and safety. Endosc Int Open 2018; 6(10): E1227–E1234. doi: 10.1055/a-0672-1138.
9. Andrisani G, Soriani P, Manno M et al. Colo-rectal endoscopic full-thickness resection (EFTR) with the over-the-scope device (FTRD®): a multicenter Italian experience. Dig Liver Dis 2018; 51(3): 375–381. doi: 10.1016/j.dld.2018.09.030.
10. Falt P, Fojtik P, Hucl T et al. Endoscopic full-thickness resection of the colorectal lesions – a Czech multicenter experience. Endoscopy 2019; 51(4): S137–S138. doi: 10.1055/s-0039-1681574.
11. Ichkhanian Y, Vosoughi K, Diehl DL et al. A large multicenter cohort on the use of full-thickness resection device for difficult colonic lesions. Surg Endosc 2021; 35(3): 1296–1306. doi: 10.1007/s00464-020-07504-9.
12. Falt P, Zapletalova J, Urban O. Endoscopic full-thickness resection versus endoscopic submucosal dissection in the treatment of colonic neoplastic lesions </= 30 mm-a single-center experience. Surg Endosc 2021. doi: 10.1007/s00464-021-08492-0.
13. Meier B, Stritzke B, Kuellmer A et al. Efficacy and safety of endoscopic full-thickness resection in the colorectum: results from the German colonic FTRD registry. Am J Gastroenterol 2020; 115(12): 1998–2006. doi: 10.14309/ ajg.0000000000000795.
14. Zwager LW, Bastiaansen BA, Bronzwaer ME et al. Endoscopic full-thickness resection (eFTR) of colorectal lesions: results from the Dutch colorectal eFTR registry. Endoscopy 2020; 52(11): 1014–1023. doi: 10.1055/a-1176-1107.
15. Falt P, Hucl T, Fojtik P et al. Endoskopická transmurální resekce v terapii lokálních reziduálních neoplázií – analýza souboru 19 pacientů. Gastroent Hepatol 2018, 72(3): 206–211. doi: 10.14735/amgh2018206.
16. Kuellmer A, Mueller J, Caca K et al. Endoscopic full-thickness resection for early colorectal cancer. Gastrointest Endosc 2019; 89(6): 1180–1189. doi: 10.1016/j.gie.2018.12.025.
17. Oliviero G, Gagliardi M, Napoli M et al. Fatal outcome consequent to an endoscopic full thickness resection of a colonic lateral spreading tumor: a case report. Am J Case Rep 2020. doi: 10.12659/AJCR.922855.
18. Schmidbaur S, Wannhoff A, Walter B et al. Risk of appendicitis after endoscopic full-thickness resection of lesions involving the appendiceal orifice: a retrospective analysis. Endoscopy 2021; 53(4): 424–428. doi: 10.1055/a-1227-4555.
19. Dumoulin FL, Gorris DG, Berger S et al. Full-thickness resection with an over-the-scope device: possible translocation of adenoma tissue in a case of an incomplete resection at the appendix. Endosc Int Open 2018; 6(5): E622–E624. doi: 10.1055/a-0589-9850.
20. Falt P, Stepan M, Andelova R et al. Combination of endoscopic mucosal resection and full-thickness resection in the treatment of local residual neoplasia of the colon two case reports. Rozhl Chir Fall 2017; 96(9): 394–398.
21. Falt P, Andělová R, Urban O. Kombinace endoskopické slizniční resekce a „full-thickness“ resekce v léčbě adenomu ascendens s příznakem „non-liftingu“. Gastroent Hepatol 2018; 72(2): 148–151. doi: 10.14735/amgh2018csgh.info03.
22. Meier B, Caca K, Schmidt A. Hybrid endoscopic mucosal resection and full-thickness resection: a new approach for resection of large non-lifting colorectal adenomas (with video). Surg Endosc 2017; 31(10): 4268–4274. doi: 10.1007/s00464-017-5461-9.
23. Akintoye E, Kumar N, Aihara H et al. Colorectal endoscopic submucosal dissection: a systematic review and meta-analysis. Endosc Int Open 2016; 4(10): E1030–E1044. doi: 10.1055/s-0042-114774.
24. Clinical Trials. Endoscopic full thickness resection versus standard therapy of the colorectal neoplasia. 2019 [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT 03868605.