Prevence vzniku pankreatické píštěle u laparoskopických levostranných pankreatektomií
Petr Moravčík1, Zdeněk Kala1, Jan Hlavsa Orcid.org 1, Vladimír Procházka1, Tomáš Pavlík2, Lumír Kunovský1
+ Pracoviště
Souhrn
Úvod: Postoperační pankreatická píštěl (POPF – postoperative pancreatic fistula) je jednou z nejzávažnějších komplikací v pankreatobiliární chirurgii. Řešení klinicky významných píštělí stupně B a C vyžaduje vždy intervenční řešení či reoperaci. POPF je provázena vysokou mortalitou. Možným řešením problému je prevence vzniku píštěle. Metody: Retrospektivní observační studie pacientů s patologií těla a kaudy pankreatu, kterým byla na našem pracovišti v období 2016–2021 provedena laparoskopická distální pankreatektomie či splenopankreatektomie (LDP – laparoscopic distal pancreatectomy or splenopancreatectomy). Od roku 2020 byl u pacientů standardizován soubor preventivních perioperačních opatření za cílem snížení POPF. Primárním cílem bylo stanovit celkový počet POPF, počet krvácení asociovaných s POPF a mortalitu asociovanou s POPF v souboru z let 2016–2021. Sekundárním cílem bylo porovnat výsledky skupiny pacientů se standardizací preventivních opatření operovaných v letech 2020–2021 se skupinou pacientů bez standardizovaných opatření z let 2016–2019. Výsledky: V letech 2016–2021 jsme provedli celkem 67 laparoskopických distálních pankreatektomií. Z toho u 10 pacientů (14,9 %) se vyskytla klinicky významná POPF stupně B či C a v 22 případech biochemický leak (32,8 %). Krvácení asociované s POPF ani úmrtí jsme nezaznamenali. Ve skupině pacientů z let 2020 a 2021 se standardizací preventivních opatření jsme u 20 operovaných pacientů nezaznamenali klinicky významné POPF, biochemický leak se vyskytl u 7 pacientů (35 %). Ve skupině 47 pacientů bez standardizace léčby, operovaných v letech 2016–2019, se oproti tomu klinicky významné POPF vyskytly u 10 pacientů (21,3 %) biochemický leak u 15 pacientů (31,9 %). Lze konstatovat, že zavedená preventivní opatření neovlivnila četnost biochemického leaku, ale statisticky významně snížila množství klinicky významných POPF. Závěr: Výsledky celého souboru pacientů potvrzují vysoký počet POPF po LDP. Výsledky podskupiny pacientů se standardizovanými perioperačními postupy zaměřenými na snížení POPF, prokázaly statisticky významné snížení klinicky významných POPF, a naznačují dobrou účinnost zavedených opatření.
Klíčová slova
pooperační komplikace, chirurgie, pankreas, pankreatická píštěl, distální pankreatektomie
Úvod
Resekční výkony v pankreatobiliární chirurgii jsou zatíženy vysokou pooperační morbiditou a mortalitou. Distální resekce slinivky břišní nejsou oproti hemipankreatoduodenektomii spojeny se složitým rekonstrukčním výkonem, avšak i u nich je pooperační morbidita negativně ovlivněna vysokým počtem pooperačních pankreatických píštělí. Postoperační pankreatická píštěl (POPF – postoperative pancreatic fistula) se u laparoskopické distální pankreatektomie (LDP – laparoscopic distal pancreatectomy or splenopancreatectomy) vyskytují dle různých zdrojů v rozmezí 15–60 % [1–4]. Dle aktuálně platné definice Mezinárodní studijní skupiny pro pankreatickou chirurgii (ISGPS – International study group for pancreatic surgery) se o klinicky významnou píštěl jedná v případě, že je v sekretu z břišních drénů potvrzena aktivita amyláz (AMS) a píštěl si vynutí jakékoli intervenční či chirurgické řešení – jedná se o píštěle stupně B a C. Dřívější píštěl typu A, která nemá vliv na změnu pooperačního managementu, je nadále definována jako biochemický leak. POPF je v 5–12 % komplikována přidruženým krvácením a je nejčastějším důvodem pooperační mortality. Celková mortalita u POPF dosahuje 1 %, u samostatných píštělí typu C ale již 25 % [5–7]. Vzhledem k těmto nepříznivým výsledkům je snahou chirurgů vzniku píštěle aktivně předcházet. Výsledky jednotlivých preventivních opatření jsou však často sporné. Na našem pracovišti provádíme, ve snaze eliminovat výskyt POPF, řadu preventivních opatření. Od roku 2020 pak používáme standardizovaný perioperační soubor preventivních opatření. K vyhodnocení jeho efektivity jsme se rozhodli retrospektivně zanalyzovat náš soubor pacientů.
Metody
Jde o retrospektivní observační studii souboru pacientů s patologií těla či kaudy slinivky břišní, u nichž byla indikována a provedena laparoskopická distální pankreatektomie/splenopankreatektomie. Pacienti nebyli selektováni dle typu patologie ani dle typu distálního resekčního výkonu. Vyloučeni byli pacienti, u nichž byla distální pankreatektomie či splenopankreatektomie součástí multiviscerální resekce. Jednalo se o pacienty pouze z našeho pracoviště z období od 1. 1. 2016 do 31. 12. 2021. Data jsme získali z prospektivně vedené databáze.
Primárním cílem bylo stanovit celkový počet POPF v našem souboru pacientů, počet krvácení asociovaných s POPF a celkovou mortalitu asociovanou s POPF.
Sekundárním cílem pak bylo porovnání výsledků skupiny pacientů operovaných od roku 2020, u kterých byl použit standardizovaný soubor preventivních opatření k eliminaci POPF, s výsledky pacientů operovaných v letech 2016–2019, u kterých byla použita pouze dílčí preventivní opatření.
Odběr AMS z břišního drénu ke stanovení možné přítomnosti POPF či biochemického leaku probíhal u všech pacientů ve 4. pooperačním dni.
Ve standardizované skupině byla zavedena následující opatření:
Farmako-preventivní – kontinuální podávání somatostatinu (Eumedica®) 3 mg/den. Podávání bylo zahajováno již na operačním sále s pokračováním do 4. pooperačního dne, kdy při negativitě AMS byla farmakoprevence ukončena. Při pozitivitě byla naopak dávka navýšena na 6 mg/den s pokračováním do maximálně 12. pooperačního dne.
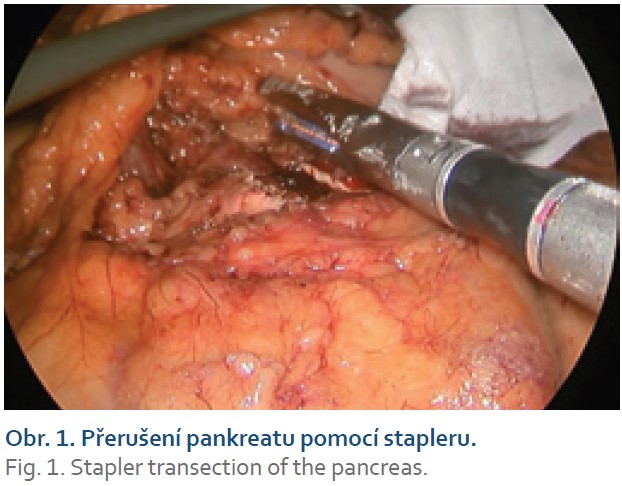
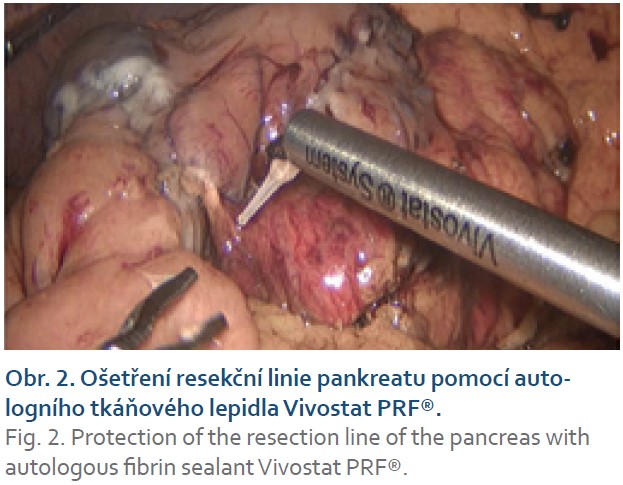
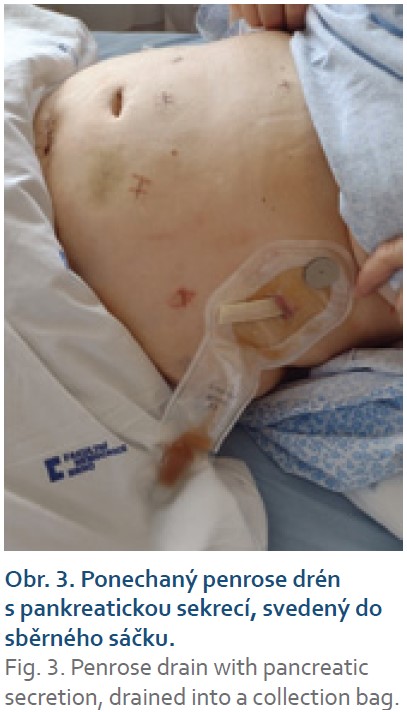
Dále opatření technická: přerušení pankreatu bylo prováděno tzv. crush technikou, při níž je místo budoucí resekční linie postupně, po dobu 10 minut, komprimováno cévní svorkou a následně zde přerušeno staplerem, který je taktéž postupně uzavírán (obr. 1). Při výběru typu náboje pak byla zohledněna tloušťka pankreatické tkáně v místě přerušení. Při tloušťce tkáně do 12 mm – hodnoceno dle předoperačního CT vyšetření – byl volen stapler Echelon Endopath® s nábojem barvy zlaté – se střední velikostí svorek (výška otevřené svorky 3,8 mm). Při objemnější slinivce stejný stapler s nábojem zelené barvy (výška otevřené svorky 4,1 mm) či černé barvy (výška otevřené svorky 4,2 mm). Staplerová linie a obnažené velké cévy po provedené lymfadenektomii byly standardně ošetřeny aplikací autologního tkáňového lepidla Vivostat PRF® (obr. 2). K resekční linii byl přiložen měkký Penrose drén jako spádová drenáž, který byl při negativitě AMS ve 4. pooperačním dni extrahován. Při pozitivitě AMS bylo provedeno CT vyšetření k ověření korektní polohy drénu a k vyloučení patologických kolekcí v jiných místech dutiny břišní. Dle výsledku CT vyšetření byla následně umožněna i cílená manipulace s drénem, tedy jeho eventuální povytažení a refixace. Při ponechání břišního drénu byla hodnota AMS v sekretu z břišního drénu pravidelně kontrolována. Při vymizení aktivity AMS či vymizení sekrece z drénu byla provedena jeho extrakce. Při přetrvávání aktivity AMS, nízkých odpadech do drénu a dobrém klinickém stavu byla možná dimise pacienta s drénem fixovaným do stomické pomůcky s následnou postupnou mobilizací drénu a jeho extrakcí při ambulantních kontrolách (obr. 3). Ve všech případech, kdy byl drén ponechán déle než 4 pooperační dny, byl proveden stěr sekretu z břišního drénu na mikrobiologické vyšetření – a dle výsledku a vývoje klinického stavu pacienta byla případně nasazena ATB terapie.
U všech pacientů byla zahájena časná rehabilitace s mobilizací již v den operace. V den operace byl taktéž pacientům umožněn perorální příjem tekutin. V případě dobrého klinického stavu byli od prvního pooperačního dne postupně zatíženi perorálním příjmem.
Výsledky
V období od 1. 1. 2016 do 31. 12. 2021 jsme na našem pracovišti provedli celkem 67 laparoskopických distálních resekcí pankreatu. Od roku 2020 jsme pak standardizovali soubor operačních a perioperačních preventivních opatření s cílem snížení POPF a asociované pooperační morbidity a mortality. Tato opatření byla aplikována u celkem 20 pacientů.
V souboru 67 pacientů bylo 37 žen a 30 mužů. Průměrný věk pacientů byl 58 let u žen a 62,5 let u mužů. V histopatologických diagnózách převažovala zhoubná onemocnění (tab. 1).
Klinicky relevantní POPF typu B a C jsme zaznamenali u 10 z celkového souboru 67 pacientů (14,9 %). Biochemický leak byl patrný u 22 pacientů (32,8 %). POPF asociovaná s krvácením nebyla zaznamenána. Nezaznamenali jsme úmrtí.
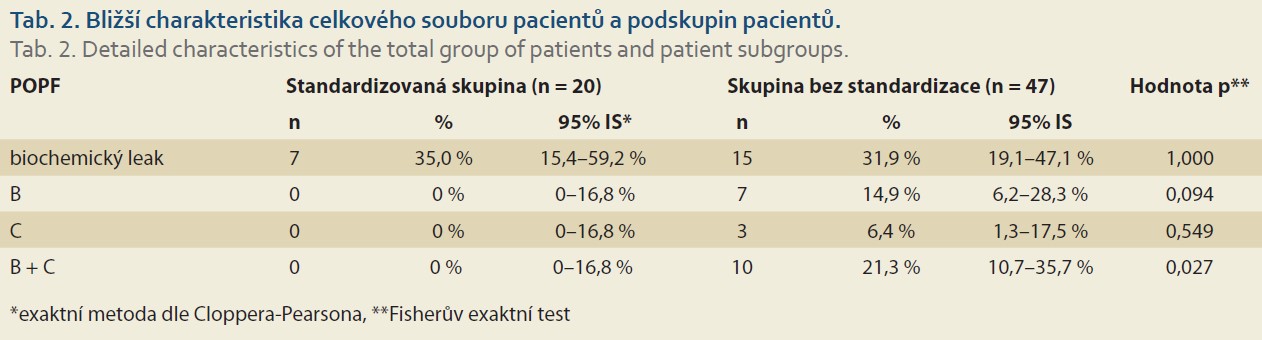
Ve skupině pacientů operovaných v letech 2020 a 2021 jsme u 20 pacientů se standardizovaným protokolem nezaznamenali žádnou klinicky významnou POPF, biochemický leak byl prokázán v 7 případech (35 %). Ve zbylé skupině 47 pacientů z let 2016–2019, bez standardizovaného protokolu, se klinicky významná POPF vyskytla u 10 pacientů (21,3 %) a biochemický leak v 15 případech (31,9 %).
Bližší charakteristiku celkového souboru pacientů a podskupin pacientů uvádí tab. 2.
Diskuze
Dlouhodobá snaha o snížení klinicky relevantních POPF pomocí různých opatření je zjevná. V literatuře najdeme četné práce z dřívější i z recentní doby hodnotící efekt jednotlivých opatření.
Nejčastěji diskutovaná je operační technika, při níž můžeme ovlivnit především způsob přerušení pankreatu a ošetření pahýlu slinivky. Přerušení pankreatu je možné provést skalpelem, elektrokoagulací či vysokoenergetickým nástrojem s následným přešitím resekční linie či staplerem. Původní, dnes nadále často užívané, nestaplerové přerušení slinivky vyžaduje přešití resekční linie. Techniky sutury jsou různé. Variantou je sutura jednotlivými stehy, pokračovacím stehem, stehy matracovými či uzávěr pahýlu slinivky technikou „rybí tlamy“. Při nestaplerovém přerušení slinivky je taktéž možné cílené uzavření pankreatického vývodu opichem přímo v ploše resekční linie [8]. Při laparoskopických operacích je technicky výhodné k přerušení slinivky užít stapler, přičemž současné práce prokazují, že jeho užitím dosáhneme stejných výsledků jako při prostém přerušení s následnou suturou [9–11]. Četné práce dokonce popisují signifikantní snížení POPF při užití stapleru [12–14]. Ani samotný způsob aplikování stapleru není jednotný a favorizovanou se stává tzv. crush technika, při níž se stapler uzavírá postupnou kompresí či se tkáň v místě plánovaného přerušení „přichystá“ prekompresí pomocí svorky a následně se stapler aplikuje ve stejném místě, taktéž postupným uzavíráním. Celková doba komprese svorkou a následného uzavírání stapleru dosahuje v některých publikacích až 20 minut. Naše technika přerušení pankreatu se postupně vyvíjela. Vzhledem k tomu, že ne všechny staplery umožňují postupné uzavírání, preferujeme nyní prekompresi pankreatu cévní svorkou s následným postupným staplerovým přerušením slinivky. Délka prekomprese a přerušení se pohybuje kolem 10 minut a liší se podle tloušťky slinivky a tuhosti pankreatické tkáně [15–18].
Samostatnou otázkou je volba vhodného staplerového náboje. Ukazuje se, že snížení počtu POPF je závislé na výšce svorek a tloušťce slinivky v místě přerušení. K přerušení slinivky do tloušťky 12 mm jsou dle recentní literatury vhodné náboje zlaté barvy s výškou svorek 3,5–3,8 mm, pro slinivky s větším průměrem pak náboje barvy černé či zelené s výškou svorek 4,1–4,8 mm [19–21]. Četné publikace taktéž doporučují užití náboje s ochrannou vrstvou, jejichž užití vede ke snížení POPF [22,23].
Možným způsobem dodatečné protekce resekční linie je taktéž augmentace uvolněným ligamentum teres hepatis, případně augmentace tkáňovými lepidly či hemostatickým materiálem. V našem souboru pacientů taktéž využíváme ligamentum teres hepatis. Nutno ovšem podotknout, že pouze u těch pacientů, kde to jeho velikost umožňuje. U všech pacientů pak provádíme augmentaci resekční plochy tkáňovým lepidlem Vivostat PRF®. Jedná se o autologní fibrinové lepidlo obohacené krevními destičkami vyráběné z pacientovy arteriální krve přímo na operačním sále během operačního výkonu. Z celkem 100 ml krve získáváme přibližně 5–6 ml lepidla [24–26]. Možné je i napojení pahýlu pankreatu na gastrointestinální trakt pomocí pankreato-enteroanastomózy či prosté překrytí resekční plochy suturou ke stěně tenké kličky bez vytvoření anastomózy [27,28].
Neméně podstatným tématem ve vztahu ke vzniku a četnosti POPF je taktéž problematika užití břišních drénů a jejich jednotlivých typů. Nejčastěji používanou je klasická spádová drenáž, někteří autoři ale preferují drény s podtlakem, jiní dokonce upřednostňují proplachovou drenáž [29,30]. Je možné provést operace i bez použití drénů. Systematické review francouzských autorů hodnotící publikace z let 1990–2020 věnující se problematice drenáže po pankreatických resekcích shrnuje zásadní doporučení: současná literatura neposkytuje oporu pro rutinní vynechání drenáže. Je možné selektivně nezavádět drenáž u pacientů s velmi nízkým rizikem POPF. Při dobrém pooperačním průběhu je vhodná krátkodobá drenáž do maximálně 5. pooperačního dne. Dle recentní literatury taktéž není možno určit superiorní typ drenáže – aktivní vs. pasivní – a volba typu drénu by tak měla být ponechána na preferencích chirurga [31]. Na našem pracovišti preferujeme pasivní drenáž měkkým Penrose drénem, u něhož nevzniká při nutnosti dlouhodobého ponechání riziko vzniku dekubitu.
Ovlivnit množství POPF lze i opatřeními zavedenými mimo operační sál. Nejčastěji diskutovanou je otázka farmakoprevence pomocí analog somatostatinu – inhibitoru růstového hormonu. Přestože v případě proximálních resekcí se zdá jejich efekt nevýznamný, v případě levostranných resekcí poukazuje recentní metaanalýza z roku 2020 na snížení klinicky významných POPF u pacientů, kterým byla analoga somatostatinu podávána [32].
Dalším možným předoperačním preventivním opatřením je provedení dekomprese pankreatického vývodu pomocí endoskopického zavedení pankreatického stentu. Výsledky naznačují snížení počtu POPF po zavedení drenáže, nicméně nejsou zcela přesvědčivé. Vzniká zde navíc i možné riziko vzniku postinstrumentační pankreatitidy, které může vést k oddálení operace. Endoskopie umožňuje taktéž aplikaci botulotoxinu do oblasti Vaterské papily (Oddiho svěrače). Prozatím publikovaná práce německých autorů z pracoviště v Heidelbergu poskytla slibné výsledky, kdy u pacientů, jimž byl botulotoxin endoskopicky aplikován, nedošlo po následné operaci ke vzniku klinicky významných POPF. V současné době je v běhu prospektivní randomizovaná studie PREBOT od stejných autorů [33–36].
Žádné z výše zmíněných preventivních opatření prozatím samostatně nevedlo k úplné eliminaci POPF. Jejich samostatný efekt na signifikantní snížení POPF je taktéž často diskutabilní. Přes zjevnou kvalitu dostupných publikovaných studií jsou výsledky dílčích opatření nejednoznačné a jednotlivé studie často poskytují protichůdné závěry. Pro jasné závěry jsou tedy nutné další prospektivní randomizované kontrolované studie s dostatečným počtem pacientů.
Na základě výše uvedeného však lze předpokládat, že cestou k významnému a trvalému snížení POPF by mohla být kombinace jednotlivých opatření a standardizace operační a perioperační péče. Výsledky našeho souboru pacientů to taktéž naznačují. Je ovšem nutné konstatovat, že limitací našeho souboru pacientů je jeho menší velikost a retrospektivní analýza.
Závěr
Účinná prevence vzniku pankreatické píštěle u laparoskopických levostranných pankreatektomií je dlouhodobou výzvou. Výsledky jednotlivých preventivních opatření jsou často sporné a samostatně prozatím prokazatelně nevedou k trvalému snížení POPF. Cestou ke snížení této pooperační morbidity by mohla být kombinace jednotlivých preventivních opatření a standardizace operačních a perioperačních postupů.
ORCID autorů
P. Moravčík ORCID 0000-0002-5368-3875,
Z. Kala ORCID 0000-0003-4187-388X,
J. Hlavsa ORCID 0000-0001-5938-2339,
V. Procházka ORCID 0000-0001-7747-6072,
T. Pavlík ORCID 0000-0001-7166-032X,
L. Kunovský ORCID 0000-0003-2985-8759.
Doručeno/Submitted: 29. 3. 2022
Přijato/Accepted: 2. 5. 2022
MUDr. Petr Moravčík
Chirurgická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
moravcik.petr@fnbrno.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Plotkin A, Ceppa EP, Zarzaur BL et al. Reduced morbidity with minimally invasive distal pancreatectomy for pancreatic adenocarcinoma. HPB 2017; 19 (3): 279–285. doi: 10.1016/j.hpb.2017.01.014.
2. Yoshida Y, Matsumoto I, Matsumoto M et al. Transpancreatic mattress suture wit Vicryl mesh around th stupm decreases postopertive pancreatic fistula after distal pancreatectomy. J Hepatobiliary Pancreat Sci 2019; 26 (11): 510–516. doi: 10.1002/jhbp.664.
3. Chee M, Lee CY, Lee SY et al. Short- and long-term outcomes after minimally invasive versus open spleen-saving distal pancreatectomies. J Min Access Surg 2022; 18 (1): 118–124. doi: 10.4103/jmas.JMAS_178_20.
4. Sugimoto M, Gotohda N, Kato Y et al. Risk factor analysis and prevention of postoperative pancreatic fistula after distal pancreatectomy with stapler use. J Hepatobiliary Pancreat Sci 2013; 20 (5): 538–544. doi: 10.1007/s00534-013-0596-0.
5. Bassi C, Marchegiani G, Dervenis C et al. The 2016 update of the International Study Group (ISGPS) definition and grading of postoperative pancreatic fistula: 11 years after. Surgery 2017; 161 (3): 584–591. doi: 10.1016/j.surg. 2016.11.014.
6. Yekebas EF, Wolfram L, Cataldegirmen G et al. Postpancreatectomy hemorrhage: diagnosis and treatment – an analysis in 1669 consecutive pancreatic resections. Ann Surg 2007; 246 (2): 269– –280. doi: 10.1097/01.sla.0000262953.77735.db.
7. Wente MN, Veit JA, Bassi C et al. Postpancreatectomy hemorrhage (PPH): an international study group of pancreatic surgery (ISGPS) definition. Surgery 2007; 142 (1): 20–25. doi: 10.1016/j.surg.2007.02.001.
8. Chikladze S, Makowiec F, Kusters S et al. The rate of postoperative pancreatic fistula after distal pancreatectomy is independent of the pancreatic stump closure technique – a retrospective analysis of 284 cases. Asian J Surg 2020; 43 (1): 227–233. doi: 10.1016/j.asjsur.2019.03.009.
9. Diener MK, Seiler CM, Rossion I et al. Effectiveness of stapler versus handsewn closure after distal pancreactomy (DISPACT trial): a randomized, controlled multicenter trial. Lancet 2011; 377 (9776): 1514–1522. doi: 10.1016/ S0140-6736 (11) 60237-7.
10. Ferrone CR, Warshaw AL, Rattner DW et al. Pancreatic fistula rates after 462 distal pancreatectomies: staplers do not decrease fistula rates. J Gastrointest Surg 2008; 12 (10): 1691–1697. doi: 10.1007/s11605-008-0636-2.
11. Hackert T, Büchler MW. Remnant closure after distal pancreatectomy: current state and future perspectives. Surgeon 2012; 10 (2): 95–101. doi: 10.1016/j.surge.2011.10.003.
12. Cunha AS, Carrere N, Meunier B et al. Stump closure reinforcement with absorbable fibrin collagen sealant sponge (TachoSil) does not prevent pancreatic fistula after distal pancreatectomy: the FIABLE multicenter controlled randomized study. Am J Surg 2015; 210 (4): 739–748. doi: 10.1016/j.amjsurg.2015.04.015.
13. Ecker BL, McMillan MT, Allegrini V et al. Risk factors and mitigation strategies for pancreatic fistula after distal pancreatectomy: analysis of 2026 resections from the International, Multi-institutional Distal Pancreatectomy Study Group. Ann Surg 2019; 269 (1): 143–149. doi: 10.1097/SLA.0000000000002491.
14. Ban D, Shimada K, Konishi M et al. Stapler and nonstapler closure of the pancreatic remnant after distal pancreatectomy: multicenter retrospective analysis of 388 patients. World J Surg 2012; 36 (8): 1866–1873. doi: 10.1007/s00268-012-1595-z.
15. Asbun HJ, Van Hilst J, Tsamalaidze L et al. Technique and audited outcomes of laparoscopic distal pancreatectomy combining the clockwise approach, progressive stepwise compression technique, and staple line reinforcement. Surg Endosc 2020; 34 (1): 231–239. doi: 10.1007/s00464-019-06757-3.
16. Nakamura M, Ueda J, Kohno H et al. Prolonged peri-fring compression with a linear stapler prevents pancreatic fstula in laparoscopic distal pancreatectomy. Surg Endosc 2011; 25 (3): 867–871. doi: 10.1007/s00464-010-1285-6.
17. Ariyarathenam AV, Bunting D, Aroori S et al. Laparoscopic distal pancreatectomy using the modifed prolonged prefring compression technique reduces pancreatic fistula. J Laparoendosc Adv Surg Tech A 2015; 25 (10): 821–825. doi: 10.1089/lap.2015.0200.
18. Matsumoto I, Kamei K, Satoi S et al. Efficacy of the slow firing method using a reinforced triple row stapler for preventing postoperative pancreatic fistula during laparoscopic distal pancreatectomy. Surg Today 2022; 52 (2): 260–267. doi: 10.1007/s00595-021-02344-z.
19. Sugimoto M, Kendrick ML, Farnell MB et al. Realtionshio between pancretic thisckness and staple height is relevant to the occurrence od pancreatic fistula after distal pancreatectomy. HPB 2020; 22 (3): 398–404. doi: 10.1016/ j.hpb.2019.07.010.
20. Sepesi B, Moalem J, Galka E et al. The influence of staple size on fistula formation following distal pancreatectomy. J Gastrointest Surg 2012; 16 (2): 267–274. doi: 10.1007/s11605-011-1715-3.
21. Nishikawa M, Yamamoto J, Hoshikawa M et al. Stapler sizes optimized for pancreatic thickness can reduce pancreatic fistula incidence after distal pancreatectomy. Surg Today 2020; 50 (6): 623–631. doi: 10.1007/s00595-019-01929-z.
22. Hamilton NA, Porembka MR, Johnston FM et al. Mesh reinforcement of pancreatic transection decreased incidence of pancreatic occlusion failure for left pancreatectomy: a single-blinded, randomized controlled trial. Ann Surg 2012; 255 (6): 1037–1042. doi: 10.1097/SLA.0b013e31825659ef.
23. Kondo N, Uemura K, Nakagawa N et al. A multicenter, randomized, controlled trial comparing reinforced staplers with bare staplers during distal pancreatectomy (HiSCO-07) trial. Ann Surg Oncol 2019; 26 (5): 1519–1527. doi: 10.1245/s10434-019-07222-0.
24. Ratnayake CB, Wells C, Hammond J et al. Network meta-analysis comparing techniques and outcomes of stump closure after distal pancreatectomy. Br J Surg 2019; 106 (12): 1580–1589. doi: 10.1002/bjs.11291.
25. Hassenpflug M, Hinz U, Strobel O et al. Teres ligament patch reduces relevant morbidity after distal pancreatectomy (the DISCOVER Randomized Controlled Trial). Ann Surg 2016; 264 (5): 723–730. doi: 10.1097/SLA.0000000000001913.
26. Jang JY, Shin YC, Han Y et al. Effect of polyglycolic acid mesh for prevention of pancreatic fistula following distal pancreatectomy: a randomized clinical trial. JAMA Surg 2017; 152 (2): 150–155. doi: 10.1001/jamasurg.2016.3644.
27. Meniconi RL, Caronna R, Borreca D et al. Pancreato-jejunostomy versus hand-sewn closure of the pancreatic stump to prevent pancreatic fistula after distal pancreatectomy: a retrospective analysis. BMC Surg 2013; 13: 23. doi: 10.1186/1471-2482-13-23.
28. Uemura K, Satoi S, Motoi F et al. Randomized clinical trial of duct-to-mucosa pancreaticogastrostomy of pancreatic stump versus hand-sewn closure after distal pancreatectomy. Br J Surg 2017; 104 (5): 536–543. doi: 10.1002/bjs.10458.
29. Adamenko O, Ferrari C, Schmidt J. Irrigation and passive drainage of pancreatic stump after distal pancreatectomy in high-risk patients: an innovative approach to reduce pancreatic fistula. Langenbecks Arch Surg 2020; 405 (8): 1233–1241. doi: 10.1007/s00423-020-02012-9.
30. Kone LB, Maker VK, Banulescu M et al. Should drains suck? A propensity score analysis of closed-suction versus closed-gravity drainage after pancreatectomy. J Gastrointest Surg 2021; 25 (5): 1224–1232. doi: 10.1007/s11605-020-04613-7.
31. Veziant J, Selvy M, Buc E et al. Evidence-based evaluation of abdominal drainage in pancreatic surgery. J Visc Surg 2021; 158 (3): 220–230. doi: 10.1016/j.jviscsurg.2020.11.001.
32. Schorn S, Vogel T, Demir E et al. Do somatostatin-analogues have the same impact on postoperative morbidity and pancreatic fistula in patients after pancreaticoduodenectomy and distal pancreatectomy? A systematic review with meta-analysis of randomized-controlled trials. Pancreatology 2020; 20 (8): 1770–1778. doi: 10.1016/j.pan.2020.10.043.
33. Fischer CP, Bass B, Fahy B et al. Transampullary pancreatic duct stenting decreases pancreatic fistula rate following left pancreatectomy. Hepatogastroenterology 2008; 55 (81): 244–248.
34. Rieder B, Krampulz D, Adolf J et al. Endoscopic pancreatic sphincterotomy and stenting for preoperative prophylaxis of pancreatic fistula after distal pancreatectomy. Gastrointest Endosc 2010; 72 (3): 536–542. doi: 10.1016/j.gie.2010.04.011.
35. Wu X, Li M, Wu W et al. The role of prophylactic transpapillary pancreatic stenting in distal pancreatectomy: a meta-analysis. Front Med 2013; 7 (4): 499–505. doi: 10.1007/s11684-013-0296-9.
36. Klaiber U, Sauer P, Martin E et al. Protocol of a randomised controlled phase II clinical trial investigating PREoperative endoscopic injection of BOTulinum toxin into the sphincter of Oddi to reduce postoperative pancreatic fistula after distal pancreatectomy: the PREBOT pilot trial. BMJ Open 2020; 10 (9): e036815. doi: 10.1136/bmjopen-2020-036815.