Obezita a idiopatické střevní záněty
Vladimír Teplan Orcid.org 1,2,3, Milan Lukáš4
+ Pracoviště
Souhrn
Incidence a prevalence obezity a nadváhy v posledních dekádách dramaticky roste do podoby globální pandemie. Současně paralelně narůstá i výskyt zánětlivých onemocnění střeva (IBD). Na rozdíl od dřívějších nálezů má v současnosti 15–40 % pacientů s IBD nadváhu či je obézních a je zřejmé, že obezita s vysokou přítomností viscerálního tuku se může podílet na vzniku a průběhu IBD zvláště u pacientů s Crohnovou nemocí. Ačkoliv jsou některé nálezy dřívějších kohortních studií z tohoto hlediska nejednoznačné, recentní studie podporují významnou roli viscerální tukové tkáně a zvláště pak tuku mezenterického pokrývajícího střevo (označovaného jako creeping fat) na rozvoj střevního zánětu. Také je zdůrazňována role porušené funkce adipocytů spojené se změnou produkce adipokinů, jako je leptin a adiponektin. Nepochybně významnou roli hraje též dlouhodobý příjem a složení tzv. západní diety spojené i se změnami střevní mikrobioty. Vliv obezity na léčbu IBD pacientů je nutné dále studovat. Významné je zjištění, že obezita mění clearance biologik vedoucí k jejich snížené hladině, a tím k nutnosti pravidelné úpravy dávky léku. Vyšší stupeň obezity vede často ke změně operačního postupu a zvyšuje riziko perioperačních komplikací.
Klíčová slova
IBD, obezita, kolorektální chirurgie, adipokiny, viscerální tuk
Úvod
Prevalence nadváhy a obezity se především v západním světě dramaticky v posledních dekádách zvyšuje a v současnosti má již charakter pandemie [1]. Současně se paralelně zvyšuje i incidence a prevalence idiopatických střevních zánětů (IBD – inflammatory bowel disease) [2,3]. Počet pacientů se závažnou obezitou překročil již 600 milionů a nezadržitelně se dále zvyšuje. V systematické review hodnotící 260 populačních studií je roční incidence IBD 10–30 případů na 100 000 obyvatel neboli postihuje kolem 0,5 % dospělé populace [3]. Existují však velké geografické rozdíly a prevalence IBD v Severní Americe a západní Evropě činí až 422 případů na 100 000 obyvatel. Je nepochybné, že na obou těchto entitách se podílí změna životního stylu a dietních zvyklostí se zvýšeným příjmem nasycených mastných kyselin a sacharidů a sníženým obsahem vlákniny. Významně také klesla v posledních desetiletích pravidelná denní fyzická aktivita [4]. Proto není překvapující, že ve stejném období je zaznamenáván nárůst počtu pacientů s IBD, kteří mají vyjádřenou obezitu, postihující 15–40 % dospělé a dětské populace s Crohnovou nemocí nebo ulcerózní kolitidou [5–8]. S ohledem na metabolickou aktivitu tukové tkáně je v popředí otázka, zda a jak může zvětšené množství tukové tkáně ovlivnit průběh IBD. Bylo jednoznačně prokázáno, že obezita svým prozánětlivým účinkem negativně ovlivňuje některé autoimunní či zánětlivé procesy a může také nepříznivě ovlivnit účinnost podávaných léků [9–11].
Obezita jako rizikový faktor pro vznik a průběh IBD
V observační studii uskutečněné ve Skotsku sledovali Steed et al signifikantní vzestup incidence IBD u obézních pacientů. Ve sledované skupině nemocných s diagnózou Crohnovy nemoci jich 18 % bylo obézních a celkově 52 % mělo nadváhu či obezitu [12], což dle autorů studie souviselo s celkovým vyšším výskytem obezity v populaci. Překvapivě pouze malé procento nemocných (3 % u CN a 0,5 % u ulcerózní kolitidy – UC) mělo podváhu. Výskyt obezity byl signifikantně vyšší u pacientů s CN oproti pacientům s UC. Analogické zjištění bylo prokázáno i u pediatrických pacientů. Long et al [13] sledovali děti ve věku 4–16 let s IBD a zjistili, že 23,6 % pediatrických IBD pacientů bylo obézních nebo mělo nadváhu.
Přes zvýšenou prevalenci obezity u pacientů s IBD není zatím objasněn přesný patofyziologický mechanizmus, kterým obezita ovlivňuje progresi IBD [14–19]. Ve velké prospektivní americké kohortní studii u žen (The Nurses’ Health Study) autoři zjistili, že obezita měřená pomocí BMI (body mass index) a složení těla (poměr tukové tkáně) byla asociována s vyšším rizikem rozvoje CN ve srovnání s UC [14]. Dánská kohortní studie se 75 tis. žen (Danish National Birth Cohort) prokázala přímý vztah mezi obezitou a vybranými autoimunními onemocněními včetně CN, kdežto pro UC nebyl tento vztah potvrzen [16,20]. Podobné závěry byly zjištěny v kohortě dlouhodobě sledovaných pacientů s obezitou ve švédské studii [21]. Autoři zjistili, že relativní incidence CN byla nejvyšší, pokud obezita byla diagnostikována před 30. rokem života. K podobným závěrům dospěli autoři dánské studie (Copenhagen School Health Records Register), ve které byla zkoumána souvislost hodnoty BMI v dětství (7–13 let) s pozdějším rozvojem IBD. Autoři zjistili, že obezita v dětském věku přestavuje riziko pro pozdější rozvoj IBD [18]. Naproti tomu v evropské prospektivní studii zaměřené na výskyt výživy ve vztahu k nádorům (studie EPIC) zahrnující více než půl milionu probandů nepředstavovala obezita stanovená pouze pomocí BMI průkazné riziko pro rozvoj CN či UC. Možné vysvětlení je v tom, že v dané kohortě byli muži i ženy a vysoké procento pacientů vyššího věku. Proto se uvažuje o tom, že riziko obezity ve vztahu k CN je závislé na věku a že také BMI není validním ukazatelem přítomnosti rizikové tukové tkáně v těle [16,20,21]. V recentní metaanalytické studii Rahmani et al [22] zjistili, že obezita představuje významné riziko pro CN, ale totéž neprokázali pro UC. U pacientů s CN je rozhodující především nález zvýšeného viscerálního tukového kompartmentu (VAT – viscersal fat volumes) s jeho metabolickou aktivitou a produkovanými prozánětlivými faktory, který je významně prediktivní ve srovnání s hodnotu BMI [23–25].
Vliv obezity na průběh IBD
Pokud je obezita hodnocena pouze pomocí BMI, není vždy jasně průkazný vztah ke klinickému průběhu IBD. Blain et al zjistili, že dospělí pacienti s CN a BMI > 30 kg/m2 měli častější perineální komplikace a častější hospitalizace [26]. V retrospektivní studii potvrdili Hass et al u pacientů s CN a vyšším BMI časnější chirurgické výkony [27]. Podobně u pediatrických pacientů s IBD byla vyšší hodnota BMI prediktivní pro potřebu chirurgických výkonů [28]. V retrospektivní kohortní studii Malik et al zjistili, že obézní pacienti s CN měli až 2,5× častěji horší průběh onemocnění ve srovnání s neobézními [29]. V recentní retrospektivní studii u dospělých nemocných s CN Singla et al prokázali, že pacienti s vyšším BMI měli významně častější extraintestinální komplikace [30]. Pavelock et al v retrospektivní observační studii u IBD nemocných zjistili, že obezita negativně ovlivňuje klinický průběh IBD a může vést k relapsu onemocnění s nutností intenzivní léčby [31].
Naproti těmto nálezům doložili Seminerio et al, že ačkoli IBD pacienti s vysokým BMI měli obecně nižší kvalitu života (měřenou dotazníkem QoL), nevyžadovali další nezbytné vícenáklady léčby včetně chirurgie [32]. Flores et al dokonce zjistili, že v jejich sledované skupině měli obézní IBD pacienti hodnocení pouze BMI méně často chirurgické výkony náležející k IBD a také nižší nutnost hospitalizace ve srovnání s kontrolní neobézní skupinou [33]. Pringle et al pak ukázali, že obézní nemocní s CN neměli větší riziko perianální choroby a častějších chirurgických intervencí včetně penetrujících komplikací [34]. Podobně při UC nebyla vyšší hodnota BMI asociována s horším průběhem onemocnění. V kohortě 202 pacientů s UC Stabroth-Akil et al [35] zjistili menší aktivitu chronického onemocnění u obézních ve srovnání se skupinou s normálním BMI. V recentní studii Hu et al při metaanalýze vlivu obezity definované jako BMI > 30 kg/m2 u nemocných s IBD dokonce zjistili méně agresivní průběh onemocnění [36].
Z těchto i dalších výsledků je zřejmé, že hodnocení obezity pomocí hodnoty BMI je nepřesné a zavádějící a nevyjadřuje skutečný vliv distribuce a složení tělesného tuku. Je proto nezbytné hodnotit vliv tukové tkáně jinými přesnějšímu ukazateli [22,36–38].
Měření viscerální tukové tkáně
Studie u nemocných s CN hodnotící obsah tělesného tuku měřením viscerální obezity je mnohem přesnější k vyjádření vlivu tukové tkáně. Erhayiem et al ve studii u 97 nemocných s CN užili výpočetní tomografie (CT) k měření mezenterického tukového indexu (MFI), což umožnilo vyjádřit poměr plochy mezi viscerálním a subkutánním tukem v oblasti břicha [39]. Toto zjištění potvrdili ve studii Li et al též s užitím CT, ve které prokázali, že plocha viscerálního tuku a MFI asociuje s pooperační rekurencí CN [40]. Bryant et al v prospektivní studii u 97 nemocných s CN k vyšetření viscerálního tuku užili metodu DEXA [41]. Taktéž potvrdili, že zvýšení viscerálního tuku lépe než BMI určuje aktivitu CN včetně hodnocení dotazníku QoL.
Tyto metody zobrazení tukové viscerální tkáně představují mnohem lepší predikční faktor i u pooperačních stavů u pacientů s CN, kteří se podrobili ileokolické resekci, než je pouhé stanovení BMI [42]. Holt et al určili obsah viscerální tukové tkáně jako nezávislý prediktivní faktor rekurence CN po chirurgickém výkonu [43]. Stejně tak v další studii u CN pacientů bylo vyšetření břišního tuku CT nadřazeno výpočtu BMI a obsah břišního viscerálního tuku byl indikátorem pre- a postoperačního rizika [44].
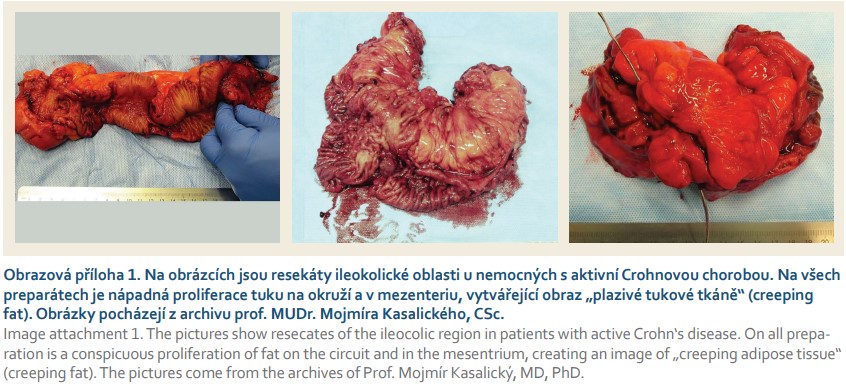
Úbytek svalové hmoty při IBD
Sarkopenie definovaná jako úbytek svalové hmoty spolu s porušenou svalovou funkcí bývá důsledkem metabolicko-nutričních poruch při IBD. Může se rozvinout také u nemocných s obezitou viscerální formy, a to především u nemocných s CN. V prospektivní studii Bryant et al prezentovali 154 nemocných vyšetřených denzitometrií pro obezitu při IBD s nálezem významné deplece svalové tkáně zhoršující se s progresí onemocnění. Fekální kalprotektin negativně koreloval s indexem svalové hmoty [45]. Izometrický „handgrip“ koreloval pozitivně s indexem svalové hmoty a negativně s tukovou hmotou. Jedním z možných důvodů úbytků svalové hmoty je dlouhodobý efekt prozánětlivých cytokinů, jejichž zdrojem je hypertrofická viscerální tuková tkáň [46,47].
Obezita a chronický zánět
Obezita, především obezita viscerální, je spojena s chronickým zánětlivým stavem charakterizovaným aktivací prozánětlivých signálních drah, se zvýšenou syntézou reaktantů akutní fáze, jako je C-reaktivní protein (CRP), a se zvýšenou produkcí prozánětlivých cytokinů. Aktivace prozánětlivého transkripčního faktoru NF-kB v adipocytech je typickým nálezem při obezitě [48]. Tuková tkáň je velmi významný endokrinní orgán, který syntetizuje řadu biologicky aktivních látek nazývaných adipo (cyto) kiny, jako jsou leptin, adiponektin, IL-1, IL-6, IL-8, resistin, TNFl, apelin, chemerin, které významně zasahují do metabolické homeostázy a imunitních funkcí [49,50]. Tuková tkáň se vyskytuje ve dvou hlavních typech: většinově jako bílá tuková tkáň (WAT) a u člověka v malém množství ve formě hnědé tukové tkáně (BAT) [51]. V posledních letech byla popsána další forma, tzv. béžová tuková tkáň [52]. WAT se vyskytuje ve dvou formách jako viscerální tuk (VAT) a tuk podkožní (SAT), z nichž každý má rozdílné metabolické a imunologické profily [25,53,54]. Viscerální obezita představuje hlavní zdroj prozánětlivého stavu a účastní se řady závažných gastrointestinálních onemocnění, jako je steatóza jater, akutní pankreatitida, nádorové procesy, ale i CN [55]. Tuková depozita s infiltrací makrofágy se mohou uplatňovat při imunitních zánětlivých procesech včetně CN [53,54]. Defekty střevní bariéry a zvýšená permeabilita jejuna byly popsány ve studii Gensera et al u závažné obezity [56]. Navíc zde byly zjištěny poruchy junkčních proteinů okludinu a tricelulinu, ale lipopolysacharid (LPS), LPS-vazebný protein (LPSB) a zonulin byly naopak zvýšeny ve srovnání s neobézními kontrolami.
Mezenterická bílá tuková tkáň u pacientů s CN
Crohnova nemoc je charakterizována zřetelnými změnami v mezenterické tukové tkáni. První takové změny byly popsány již Crohnem et al jako typické pro CN [57]. Mezenterická tuková tkáň (mWAT) je hypertrofická a je označována jako tzv. plazivý tuk (creeping fat). Jeho zastoupení je u pacientů s IBD, především s CN, významně zvýšeno, jak potvrzují studie s magnetickou rezonancí (MR) [58]. Tento tuk je predilekčně umístěn v zánětlivě postižených částech střeva [59]. Je zřejmé, že mWAT se může aktivně podílet na tíži střevního postižení a ovlivnit další komplikace [60–64]. U nemocných s CN, u kterých bylo zjištěno selektivní rozšíření tukových depozit podél postižených lymfatických uzlin a střeva, byla lokalizace tuku až na 50 % střevního povrchu [65,66]. Tato forma tukové tkáně se liší od obvykle lokalizované mezenterické tukové tkáně významně zvýšenou infiltrací imunitními buňkami [25,60,67]. Je tedy zřejmé, že mWAT může být velmi významným zdrojem prozánětlivých faktorů, jako jsou cytokiny a chemokiny [24,60–63,68–74], a to ve větším rozsahu, než je samotný tuk viscerální [75]. Je hlavním místem lokální produkce TNFL, IL-6 a dalších prozánětlivých cytokinů zvýšeně produkovaných u pacientů s IBD. Je významným zdrojem i CRP a jeho produkce mezenterickými adipocytokiny indukuje lokální zánět a bakteriální translokaci do mWAT [62,76]. Předpokládá se, že u pacientů s CN umožňuje transmurální zánět zvýšenou bakteriální translokaci do této plazivé tukové tkáně. Translokované antigeny mohou přímo aktivovat (pre) adipocyty [71,77,78]. Adipocyty derivované mediátory modulují fenotyp a funkci imunitních buněk. Preadipocyty se mohou dále diferencovat na makrofágy [79,80].
Adipokiny
Adipo (cyto) kiny jsou produkovány adipocyty a mohou se také uplatňovat v patogenezi idiopatických střevních zánětů [38,81–83].
Leptin
Leptin je tvořen především v bílé tukové tkáni a je vylučován v diurnálním rytmu v závislosti na množství tukové tkáně a jeho hlavní role je v ovlivnění energetické homeostázy a metabolizmu. Vykazuje silný prozánětlivý efekt na imunitní systém a jeho uvolňování aktivuje zánětlivé cytokiny, jako je IL-1, IL-6, LPS [56]. V recentním systematickém review adipokinů při IBD ale nebyla prokázána lineární asociace mezi hladinami leptinu a tíží IBD [81]. Biesiada et al zjistili zvýšené hladiny leptinu u pacientů s exacerbací UC a tyto hladiny pozitivně korelovaly s IL-1 a TNF, ale nebyla prokázána přímá korelace s aktivitou zánětlivého střevního procesu [84]. Podobné zjištění bylo potvrzeno ve studii realizované Tuzunem et al, kde byla zjištěna zvýšená hladina leptinu u pacientů s akutní fází UC [85]. Při studiu exprese leptinu v mezenterickém tuku u IBD pacientů prokázali Barbier et al a Paul et al zvýšenou expresi mRNA leptinu v mezenterické tukové tkáni jak u pacientů s CN, tak s UC [86,87].
Adiponektin
Adiponektin (APN) je výrazným adipocytokinem produkovaným v tukové tkáni (viscerální i podkožní), který má protizánětlivé účinky a hraje klíčovou roli v regulaci inzulinové senzitivity. Koncentrace APN je u obézních osob nižší než u neobézních kontrol. Podobně jako u leptinu jsou údaje týkající se APN hladin u nemocných s IBD kontroverzní. Kahraman et al zjistili, že sérová hladina APN je snížena jak u pacientů s CN, tak i s UC [88]. Podobné závěry byly zjištěny ve studii Valentiniho et al, kdy hladina APN byla snížena u IBD bez vlivu k aktivitě onemocnění [89]. Naproti tomu Karmiris et al zjistili u IBD pacientů zvýšenou hladinu APN a současně sníženou leptinu [90]. V zajímavé studii Yamamota et al [91] byla zjištěna upregulace exprese APN v plazivém tuku u pacientů s CN i s UC ve srovnání s normální mezenterickou tukovou tkání. Podobné závěry byly učiněny ve studii Paula et al [87].
Ostatní adipokiny
Resistin, původně popsaný jako produkt tukové tkáně, je produkován makrofágy a má silný prozánětlivý účinek. Hraje roli v patogenezi obezity a inzulinové rezistence [92]. Hladiny resistinu se zvyšují u nemocných s IBD a současně klesají po úspěšné biologické léčbě infliximabem [93]. Han et al sledovali zvýšený kolonický apelin u pacientů s IBD [94]. Ge et al zjistili vysokou expresi apelinu v mezenterickém tuku pacientů s CN a dovozovali jeho vliv na lymfatický systém střeva [95]. Chemerin je adipokin fungující jako chemoatraktant pro buňky imunitního systému. U IBD pacientů jsou popsány jeho vyšší i nižší hladiny [96–98]. Visfatin hraje významnou roli v intracelulárním a extracelulárním metabolickém efektu spojeném s obezitou [92]. Jeho koncentrace těsně korelují s množstvím viscerálního i mezenterického tuku. Sérový visfatin je zvýšen u obézních nemocných s IBD [97–100], jeho koncentrace koreluje s aktivitou IBD v kolonických biopsiích [100,101].
Dietní režim a střevní mikrobiota ve vztahu k IBD
Epidemiologické studie prokazují, že vývoj obezity i IBD spojené s prozánětlivým stavem se zvýšenou expresí cytokinů a chemokinů je úzce spojen se stravovacím režimem, především s tzv. západní dietou obsahující vysoké zastoupení nasycených mastných kyselin, sacharidů, živočišných bílkovin, ale málo rostlinné vlákniny [102,103]. V japonské studii sledující změnu tradiční diety k dietě západní byla prokázána zvýšená incidence CN [104]. V systematické studii demonstrovali Hou et al asociaci mezi zvýšeným výskytem rizika k IBD a zvýšeným příjmem PUFA, omega 6-mastných kyselin, živočišných tuků a masa [105].
Dalším velmi významným nálezem je přítomná střevní dysbióza vyvolaná touto dietou. Je nepochybné, že střevní mikrobiota hraje kritickou roli při rozvoji obezity, obezitou asociovaných zánětů a IBD [106–110]. Pacienti s IBD mají zjišťovánu střevní dysbiózu spojenou s poklesem střevní mikrobiální diverzity [111], což znamená redukce bakterií typu Firmicutes a nárůst typu Bacteriodetes a Proteobacteria [66,106]. Tyto změny souvisejí se zvýšeným příjem sacharidů a tuků a mohou vést k dysfunkci střevní slizniční bariéry, ke zvýšené permeabilitě a k bakteriální translokaci, což jsou společné patologické pochody pro obezitu i IBD [71,112,113]. Translokace bakterií může přímo aktivovat adipocyty a preadipocyty s následnou zvýšenou tvorbou proinflamačních cytokinů a zvýšení známek zánětu [71,77,78]. Byla prokázána významná korelace mezi vysokotukovou dietou a zvýšením markerů bakteriální translokace [114–116].
Obezita a biologická léčba IBD
Není pochyb o tom, že biologická léč-ba (BL) velmi významně ovlivňuje léčebný proces nemocných s IBD. Je proto velmi důležité vědět, zda a jak obezita může ovlivnit farmakokinetiku podávaných preparátů zvláště tam, kde se podává dávka nezávisle na tělesné hmotnosti. Podobně jako v transplantologiii se všem nemocným přesně monitorují koncentrace podávaných monoklonálních protilátek a dle jejich aktuálních hodnot lze dávku bezprostředně upravit. Přesnější se jeví možnost výpočtu velikosti dávky s ohledem na zjištěnou tělesnou hmotnost, jako je tomu při podávání infliximabu nebo vedolizumabu. Při obezitě vyššího stupně však výpočet nemusí respektovat složení tělesných kompartmentů včetně vyššího obsahu vody v tukové tkáni [117].
Bhalme et al sledovali u pacientů s IBD léčených adalimumabem (ve srovnání se skupinou léčenou infliximabem) větší pravděpodobnost kolísání léčebného účinku u obézních pacientů s BMI > 35 kg/m2 ve srovnání se skupinou s BMI < 25 kg/m2, a to 40 vs. 20 % [118]. Toto kolísání bylo tím větší, čím výraznější obezita byla přítomna. Seminerio et al zjistili, že průměrná dávka infliximabu u pacientů s BMI > 40 kg/m2 byla 4 mg/kg tělesné hmotnosti se srovnání se 7,9 mg/kg tělesné hmotnosti u pacientů v normální hodnotou BMI [32]. U pacientů s IBD, kteří měli pouze nadváhu (BMI < 30 kg/m2), byla pak průměrná hodnota hladiny infliximabu 6,4 mg/kg tělesné hmotnosti.
Populační farmakokinetické studie biologické léčby u pacientů s IBD zahrnující podávání infliximabu, adalimumabu, certolizumab pegolu a golimumabu, vedolizumabu a zřejmě i ustekinumabu identifikovaly zvýšenou hodnotu BMI jako nezávislý rizikový faktor pro zvýšení clearance dané látky vedoucí ke zkrácenému poločasu s důsledkem poklesu účinné hladiny látky, a tím se snížením jejího účinku [119–124]. I když dosud není mechanizmus zcela objasněn, předpokládá se zvýšená metabolická clearance s možnou účastí prozánětlivého účinku viscerálního tuku. V retrospektivní kohortní studii u 124 pacientů s IBD léčených infliximabem měli pacienti s obezitou 3–9× častěji kolísání hladin účinné látky vyžadující úpravu podávané dávky [125]. Každé i jednotkové zvýšení hodnoty BMI představovalo u IBD pacientů zvýšení pravděpodobnosti poddávkování léku cca o 6 %. V podobné prospektivní monocentrické studii 199 pacientů s CN s mediánem trvání 1 roku léčených adalimumabem měla až jedna třetina nemocných významné kolísání hladin v nutnou úpravou v mediánu 5 měsíců od zahájení léčby, a to v závislosti na zvýšené hodnotě BMI [126].
Ačkoli jsou data o vlivu obezity na léčebnou strategii podávání biologické léčby u nemocných s IBD stále limitovaná, analogické závěry již byly udělány u pacientů s obezitou léčených biologiky s jinými autoimunními chorobami, jako je revmatoidní artritida či psoriatická artritida [127–129].
Obezita, především vyššího stupně, také může významně ovlivnit podávání imunosupresivní léčby a vyžaduje častěji úpravu její dávky [130]. Bylo potvrzeno, že u nemocných s vyšší hodnotou BMI dochází k nižší konverzi azathioprinu na účinný metabolit 6-thioguanin a naopak se ve větší míře u těchto nemocných vytváří toxický 6-metyl-merkaptopurin
Obezita a chirurgické výkony u IBD pacientů
Intraabdominální chirurgické výkony jsou u obézních pacientů s IBD často technicky komplikovanější a jsou zatíženy větším rizikem perioperačních komplikací. V přehledové analýze hodnotící výsledky 33 studií o vlivu obezity na perioperační komplikace při laparoskopické kolorektální resekci nalezli Makino et al delší časy operačního výkonu a zvýšené riziko konverze z laparoskopického k otevřenému výkonu [131]. Obézní skupina měla signifikantně vyšší výskyt komorbidit a vyšší riziko i pooperačních komplikací, především rané infekce. V národní studii z USA byl u 382 637 hospitalizovaných chirurgických pacientů s IBD prokázán signifikantně vyšší výskyt pooperačních komplikací, infekcí, plicních komplikací a šokových stavů [132]. Obezita také zvyšuje riziko časných komplikací po vytvoření ileo-pouch-análních anastomóz a je negativním prediktorem pro dlouhodobou dobrou funkci pouche.
Je proto velmi žádoucí, aby obézní IBD pacienti měli před plánovaným chirurgickým výkonem vyšetření CT či MR, aby mohlo být přesněji zhodnoceno jejich chirurgické riziko s ohledem na přítomný viscerální (především mezenterální) tuk, jak prokázali ve studii Ding et al, kteří retrospektivně zhodnotili kohortu 164 operovaných pacientů s CN [133]. Prokázali, že pokud je area viscerálního tuku > 130 cm2, stoupalo riziko pooperačních komplikací 2,7násobně.
Léčebné možnosti obezity u IBD pacientů
U stabilizovaných IBD pacientů s obezitou můžeme postupovat konzervativně s užitím individuálně upravených redukčních dietních programů včetně náhrad jednotlivých jídel. Vždy je třeba spolupracovat se zkušenou nutričním terapeutem a dietu individuálně upravit dle potravinové tolerance jednotlivých pacientů. Léčebný program včetně biologické léčby není při postupné redukci tuku nijak ovlivněn. Vždy se musíme vyvarovat prohloubení katabolizmu s možným rozvojem ketoacidózy. Je třeba udržovat vyrovnaný program příjmu tekutin a minerálů, který je třeba průběžně kontrolovat. Nutná je též kontrola složení tělesných kompartmentů v cca 3měsíčních intervalech (např. bioimpedancí), abychom předešli většímu úbytku svalové hmoty.
Ve výjimečných případech závažné obezity 3. a 4. stupně s dalšími orgánovými komplikacemi či před plánovaným chirurgickým či ortopedickým výkonem lze uvažovat i o možnostech bariatrické chirurgie. Jako nejvhodnější typ chirurgického výkonu je u IBD nemocných bez postižení proximální části trávicí trubice provedení tzv. sleeve gastrektomie. Výskyt komplikací byl po těchto výkonech stejně frekventní u nemocných s IBD jako u jinak zdravých pacientů, nicméně se jedná o ojedinělé kazuistické série a prezentovaná data zatím nedovolují jednoznačné uzavření navrženého postupu [134,135].
Klíčové body
1. 15–40 % pacientů s IBD má nadváhu či obezitu.
2. Viscerální obezita vyššího stupně (BMI > 35 kg/m2) může významně zhor-šit prognózu IBD, především CN.
3. Mezenterická tuková tkáň je metabolicky aktivní, podílí se na lokální zánětlivé reakci, dysfunkci mukózní bariéry a bakteriální translokaci.
4. Adipokiny jsou produkovány adipocyty a mohou se uplatňovat při idiopatických zánětlivých střevních zánětech (především leptin a adiponektin).
5. Dieta se zvýšeným obsahem tuků, sacharidů a živočišných bílkovin a s nedostatkem vlákniny a vitaminů se podílí na vzniku dysbiózy jak u obezity, tak u IBD.
6. Obezita je spojena se zvýšenou clearancí biologických léků a jejich snížená koncentrace snižuje i léčebný účinek.
7. U obézních IBD pacientů byl měl být kvantifikován předoperačně viscerální tuk (CT, MR, DEXA, bioimpedance) s cílem předejít rozvoji pooperačních komplikací.
Doručeno/Submitted: 25. 11. 2020
Přijato/Accepted: 5. 12. 2020
prof. MUDr. Vladimír Teplan, DrSc.
Klinické a výzkumné centrum pro střevní záněty
Klinické centrum ISCARE a. s. a 1. LF UK v Praze
Českomoravská 2510/19
190 00 Praha
teplan@iscare.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Ng M, Fleming T, Robinson M et al. Global, regional and national prevalence of overweight and obesity in children and adults during 1980–2013: a systematic analysis for the global burden of disease study 2013. Lancet 2014; 384 (9945): 766–781. doi: 10.1016/S0140-6736 (14) 60460-8.
2. Ng SC, Zeng Z, Niewiadomski O et al. Early course of inflammatory bowel disease in a population-based inception cohort study from 8 countries in Asia and Australia. Gastroenterology 2016; 150 (1): 86–95. doi: 10.1053/j.gastro.2015.09.005.
3. Molodecky NA, Soon IS, Rabi DM et al. Increasing incidence and prevalence of the inflammatory bowel diseases with time, based on systematic review. Gastroenterology 2012; 142 (1): 46–54. doi: 10.1053/j.gastro.2011.10.001.
4. Ananthakrishnan AN. Environmental risk factors for inflammatory bowel diseaes: a review. Dig Dis Sci 2015; 60 (2): 290–298. doi: 10.1007/s10620-014-3350-9.
5. Singh S, Dulai PS, Zarrinpar A et al. Obesity in IBD: epidemiology, pathogenesis, disease course and tratment outcomes. Nat Rev Gastroenterol Hepatol 2017; 14 (2): 110–121. doi: 10.1038/nrgastro.2016.181.
6. Suibhne TN, Raftery TC, McMahon O et al. High prevalence of overweight and obesity in adults with Crohn’s disease: associations with disease and lifestyle factors. J Crohns Colitis 2013; 7 (7): e241–e248. doi: 10.1016/j.crohns.2012.09.009.
7. Lynn AM, Harmsen WS, Aniwan S et al. Prevalence of obesity and influence on phenotype within a population-based cohort of inflammatory bowel disease patients. Gastroenterology 2018; 154 (Suppl 6): S608.
8. Lynn AM, Harmsen WS, Tremaine WJ et al. Trends in the prevalence of overweight and obesity at the time of inflammatory bowel disease diagnosis: a population-based study. Gastroenterology 2018; 154 (Suppl 6): S614–S615.
9. Snekvik I, Smith CH, Nilsen TIL et al. Obesity, waist circumference, weight change, and risk of incident psoriasis: prospective data from the HUNT study. J Invest Dermatol 2017; 137 (12): 2484–2490. doi: 10.1016/j.jid.2017.07.822.
10. Qin B, Yang M, Fu et al. Body mass index and the risk of rheumatoid arthritis: a systematic review and dose-response meta-analysis. Arthritis Res Ther 2015; 17 (1): 86. doi: 10.1186/s13 075-015-0601-x.
11. Maas F, Arends S, van der Veer E et al. Obesity is common in axial spondyloarthritis and is associated with poor clinical outcome. J Rheumatol 2016; 43 (2): 383–387. 10.3899/jrheum.150648.
12. Steed H, Walsh S, Reynolds N. A brief report of the epidemiology of obesity in the inflammatory bowel disease population of Tayside, Scotland. Obes Facts 2009; 2 (6): 370–372. doi: 10.1159/000262276.
13. Long MD, Crandall WV, Leibowitz IH et al. Prevalence and epidemiology of overweight and obesity in children with inflammatory bowel disease. Inflamm Bowel Dis 2011; 17 (10): 2162–2168. doi: 10.1002/ibd.21585.
14. Khalili H, Ananthakrishnan AN, Konijeti GG et al. Measures of obesity and risk of Crohn’s disease and ulcerative colitis. Inflamm Bowel Dis 2015; 21 (2): 361–368. doi: 10.1097/MIB.0000000000000283.
15. Mendall M, Harpsøe MC, Kumar D et al. Relation of body mass index to risk of developing inflammatory bowel disease amongst women in the Danish National Birth Cohort. PLoS One 2018; 13 (1): e0190600. doi: 10.1371/journal.pone.0190600.
16. Harpsøe MC, Basit S, Andersson M et al. Body mass index and risk of autoimmune diseases: a study within the Danish National Birth Cohort. Int J Epidemiol 2014; 43 (3): 843–855. doi: 10.1093/ije/dyu045.
17. Chan SS, Luben R, Olsen A et al. Body mass index and the risk for Crohn’s disease and ulcerative colitis: data from a European Prospective Cohort Study (The IBD in EPIC Study). Am J Gastroenterol 2013; 108 (4): 575–582. doi: 10.1038/ajg.2012.453.
18. Jensen CB, Ängquist LH, Mendall MA et al. Childhood body mass indexand risk of inflammatory bowel disease in adulthood: a population-based cohort study. Am J Gastroenterol 2018; 113 (5): 694–701. doi: 10.1038/s4139 5-018-0031-x.
19. Melinder C, Hiyoshi A, Hussein O et al. Physical fitness in adolescence and subsequent inflammatory bowel disease risk. Clin Transl Gastroenterol 2015; 6 (11): e121. doi: 10.1038/ctg.2015.49.
20. Mendall MA, Gunasekera AV, John BJ et al. Is obesity a risk factor for Crohn’s disease? Dig Dis Sci 2011; 56 (3): 837–844. doi: 10.1007/s10620-010-1541-6.
21. Hemminki K, Li X, Sundquist J et al. Risk of asthma and autoimmune diseases and related conditions in patients hospitalized for obesity. Ann Med 2012; 44 (3): 289–295. doi: 10.3109/07853890.2010.547515.
22. Rahmani J, Kord-Varkaneh H, Hekmatdoost Aet al. Body mass index and risk of inflammatory bowel disease: a systematic review and dose-response meta-analysis of cohort studies of over a million participants. Obes Rev 2019; 20 (9): 1312–1320. doi: 10.1111/obr.12875.
23. Uko V, Vortia E, Achkar JP et al. Impact of abdominal visceral adipose tissue on disease outcome in pediatric Crohn’s disease. Inflamm Bowel Dis 2014; 20 (12): 2286–2291. doi: 10.1097/MIB.0000000000000200.
24. Kredel L, Batra A, Siegmund B et al. Role of fat and adipokines in intestinal inflammation. Curr Opin Gastroenterol 2014; 30 (6): 559–565. doi: 10.1097/MOG.0000000000000116.
25. Kredel LI, Siegmund B. Adipose-tissue and intestinal inflammation – visceral obesity and creeping fat. Front Immunol 2014; 5: 462. doi: 10.3389/fimmu.2014.00462.
26. Blain A, Cattan S, Beaugerie L et al. Crohn’s disease clinical course abd severity in obese pateinets. Clin Nutr 2002; 21 (1): 51–57. doi: 10.1054/clnu.2001.0503.
27. Hass DJ, Brensinger CM, Lewis JD et al. The impact of increased body mass index on the clinical course of Crohn’s disease. Clin Gastroenterol Hepatol 2006; 4 (4): 482–488. doi: 10.1016/j.cgh.2005.12.015.
28. Long MD, Crandall WV, Leibowitz IH et al.Prevalence and epidemiology of overweight and obesity in children with inflammatory boweldisease. Inflamm Bowel Dis 2011; 17 (10): 2162–2168. doi: 10.1002/ibd.21585.
29. Malik TA, Manne A, Oster RA et al. Obesity is associated with poor surgical outcome in Crohn’s disease. Gastroenterology Res 2013; 6 (3): 85–90. doi: 10.4021/gr553w.
30. Singla MB, Eickhoff C, Betteridge J. Extraintestinal manifestations are common in obese patients withCrohn’s disease. Inflamm Bowel Dis 2017; 23 (9): 1637–1642. doi: 10.1097/MIB.0000000000001187.
31. Pavelock N, Masood U, Minchenberg S et al. Effects of obesity on the course of inflammatory bowel disease. Proc (Bayl Univ Med Cent) 2019; 32 (1): 14–17. doi: 10.1080/08998 280.2018.1542887.
32. Seminerio JL, Koutroubakis IE, Ramos-Rivers C et al. Impact of obesity on the management and clinical course of patients with inflammatory bowel disease. Inflamm Bowel Dis 2015; 21 (12): 2857–2863. doi: 10.1097/MIB.000000 0000000560.
33. Flores A, Burstein E, Cipher DJ et al. Obesity in inflammatory bowel disease: a marker of less severe disease. Dig Dis Sci 2015; 60 (8): 2436–2445. doi: 10.1007/s10620-015-3629-5.
34. Pringle PL, Stewart KO, Peloquin JM et al. Body mass index, genetic susceptibility, and risk of complications among individuals with Crohn’s disease. Inflamm Bowel Dis 2015; 21 (10): 2304–2310. doi: 10.1097/MIB.00 00000000000498.
35. Stabroth-Akil D, Leifeld L, Pfützer R et al. The effect of body weight on the severity and clinical course of ulcerative colitis. Int J Colorectal Dis 2015; 30 (2): 237–242. doi: 10.1007/s00384-014-2051-3.
36. Hu Q, Ren J, Li G et al. The impact of obesity on the clinical course of inflammatory bowel disease: a meta-analysis. Med Sci Monit 2017; 23: 2599–2606. doi: 10.12659/msm.901969.
37. Randall CW, Vizuete JA, Martinez N et al. From historical pespectives to modern therapy: a review of current and future biologial treatment for Crohn’s disease. Therap Adv Gastroenterol 2015; 8 (3): 143–159. doi: 10.1177/1756283X15576462.
38. Harper JW, Zisman TL. Interaction of obesity and inflammatory bowel disease. World J Gastroenterol 2016; 22 (35): 7868–7881. doi: 10.3748/wjg.v22.i35.7868.
39. Erhayiem B, Dhingsa R, Hawkey CJ et al. Ratio of visceral to subcutaneous fat area is a biomarker of complicated Crohn’s disease. Clin Gastroenterol Hepatol 2011; 9 (8): 684–687. doi: 10.1016/j.cgh.2011.05.005.
40. Li Y, Zhu W, Gong J et al. Visceral fat area is associatedwith a high risk for early postoperative recurrence in Crohn’s disease. Colorectal Dis 2015; 17 (3): 225–234. doi: 10.1111/codi.12798.
41. Bryant RV, Schultz CG, Ooi S et al. Visceral adipose tissue is associated with stricturing Crohn’s disease behavior, fecal calprotectin, and quality of life. Bowel Dis 2019; 25 (3): 592–600. doi: 10.1093/ibd/izy278.
42. Connelly TM, Juza RM, Sangster W et al. Volumetric fat ratio and not body mass index is predictive of ileocolectomy outcomes in Crohn’s disease patients. Dig Surg 2014; 31 (3): 219–224. doi: 10.1159/000365359.
43. Holt DQ, Moore GT, Strauss BJG et al. Visceral adiposity predicts post-operative Crohn’s disease recurrence. Aliment Pharmacol Ther 2017; 45 (9): 1255–1264. doi: 10.1111/apt.14018.
44.Van der Sloot KW, Joshi AD, Bellavance DR et al. Visceral adiposity, genetic susceptibility, and risk of complications among individuals with Crohn’s disease. Inflamm Bowel Dis 2016; 23 (1): 82–88. doi: 10.1097/MIB.0000000000000978.
45.Bryant RV, Schultz CG, Ooi S et al. Obesity in inflammatory bowel disease: gains in adiposity despite high prevalence of myopenia and osteopenia. Nutrients 2018; 10 (9): 1192. doi: 10.3390/nu10091192.
46. Scaldaferri F, Pizzoferrato M, Lopetuso LR et al. Nutrition and IBD: malnutrition and/or sarcopenia? A practical guide. Gastroenterol Res Pract 2017; 2017: 8646495. doi: 10.1155/2017/ 8646495.
47. Bilski J, Mazur-Bialy A, Brzozowski B et al. Can exerise affect the course of inflammatory bowel disease ? Experimenal and clinical evidence. Pharmacol Rep 2016; 68 (4): 827–836. doi: 10.1016/j.pharep.2016.04.009.
48. Ellulu MS, Patimah I, Khaza’ai H et al. Obesity and inflammation: the linking mechanism and the complications. Arch Med Sci 2017; 13 (4): 851–863. doi: 10.5114/aoms.2016.58928.
49. Dandona P, Aljada A, Chaudhuri A et al. Metabolic syndrome: a comprehensive perspective based on interactions between obesity, diabetes, and inflammation. Circulation 2005; 111 (11): 1448–1454. doi: 10.1161/01.CIR.0000158483.13093.9D.
50. Weidinger C, Ziegler JF, Letizia M et al. Adipokines and their role in intestinal inflammation. Front Immunol 2018; 9: 1974. doi: 10.3389/fimmu.2018.01974.
51. Lanthier N, Leclercq IA. Adipose tissues as endocrine target organs. Best Pract Res Clin Gastroenterol 2014; 28 (4): 545–558. doi: 10.1016/j.bpg.2014.07.002.
52. Rosenwald M, Wolfrum C. The origin and definition of brite versus white and classical brown adipocytes. Adipocyte 2014; 3 (1): 4–9. doi: 10.4161/adip.26232.
53. Tchkonia T, Thomou T, Zhu Y eet al. Mechanisms and metabolic implications of regional differences among fat depots. Cell Metab 2013; 17 (5): 644–656. doi: 10.1016/j.cmet.2013.03.008.
54. Karagiannides I, Pothoulakis C. Obesity, innate immunity and gut inflammation. Curr Opin Gastroenterol 2007; 23 (6): 661–666. doi: 10.1097/MOG.0b013e3282c8c8d3.
55. Nam SY. Obesity-related digestive diseases and their pathophysiology. Gut Liver 2017; 11 (3): 323–334. doi: 10.5009/gnl15557.
56. Genser L, Aguanno D, Soula HA et al. Increased jejunal permeability in human obesity is revealed by a lipid challenge and is linked to inflammation and type 2 diabetes. J Pathol 2018; 246 (2): 217–230. doi: 10.1002/path.5134.
57. Harper JW, Zisman TL. Interaction of obesity and inflammatory bowel disease. World J Gastroenterol 2016; 22 (35): 7868–7881. doi: 10.3748/wjg.v22.i35.7868.
57. Crohn BB, Ginzburg L, Oppenheimer GD. Regional ileitis: a pathologic and clinical entity. JAMA 1932; 99: 1323–1329.
58. Desreumaux P, Ernst O, Geboes K et al. Inflammatory alterations in mesenteric adipose tissue in Crohn’s disease. Gastroenterology1999; 117 (1): 73–81. doi: 10.1016/s0016-5085(99)70552-4.
59. Sheehan AL, Warren BF, Gear MW et al. Fat-wrapping in Crohn’s disease: pathological basis and relevance to surgical practice. Br J Surg 1992; 79 (9): 955–958. doi: 10.1002/bjs.1800790934.
60. Peyrin-Biroulet L, Chamaillard M, Gonzalez F et al. Mesenteric fat in Crohn’s disease: a pathogenetic hallmark or an innocent bystander? Gut 2007; 56 (4): 577–583. doi: 10.1136/gut. 2005.082925.
61. Fink C, Karagiannides I, Bakirtzi K et al. Adipose tissue and inflammatory bowel disease pathogenesis. Inflamm Bowel Dis 2012; 18 (8): 1550–1557. doi: 10.1002/ibd.22893.
62. Peyrin-Biroulet L, Gonzalez F, Dubuquoy L et al. Mesenteric fat as a source of C reactive protein and as a target forbacterial translocation in Crohn’s disease. Gut 2012; 61 (1): 78–85. doi: 10.1136/gutjnl-2011-300370.
63. Kaser A, Tilg H. “Metabolic aspects” in inflammatory bowel diseases. Curr Drug Deliv 2012; 9 (4): 326–332. doi: 10.2174/156720112801323044.
64. Mao R, Kurada S, Gordon IO et al. The mesenteric fat and intestinal muscle interface: creeping fat influencing stricture formation in Crohn’s disease. Inflamm Bowel Dis 2019; 25 (3): 421–426. doi: 10.1093/ibd/izy331.
65. Westcott ED, Mattacks CA, Windsor ACJ et al. Perinodal adipose tissue and fatty acid composition of lymphoid tissues in patients with and without Crohn’s disease and their implications for the etiology and treatment of CD. Ann NY Acad Sci 2006; 1072: 395–400. doi: 10.1196/annals.1326.034.
66. Bilski J, Mazur-Bialy A, Wojcik D et al. Role of obesity, mesenteric adipose tissue, and adipokies in inflammatory bowel diseases. Biomolecules 2019; 9 (12): 780. doi: 10.3390/biom9120780.
67. Kredel LI, Batra A, Stroh T et al. Adipokines from local fat cells shape the macrophage compartment of the creeping fat in Crohn’s disease. Gut 2013; 62 (6): 852–862. doi: 10.1136/gutjnl-2011-301424.
68. Tilg H, Kaser A. Gut microbiome, obesity, and metabolic dysfunction. J Clin Invest 2011; 121 (6): 2126–2132. doi: 10.1172/JCI58109.
69. Batra A, Heimesaat MM, Bereswill S et al. Mesenteric fat – control site for bacterial translocation in colitis? Mucosal Immunol 2012; 5 (5): 580–591. doi: 10.1038/mi.2012.33.
70. Batra A, Zeitz M, Siegmund B. Adipokine signaling in inflammatory bowel disease. Inflamm Bowel Dis 2009; 15 (12): 1897–1905. doi: 10.1002/ibd.20937.
71. Kruis T, Batra A, Siegmund B. Bacterial translocation – impact on the adipocyte compartment. Front Immunol 2014; 4: 510. doi: 10.3389/fimmu.2013.00510.
72. Sideri A, Bakirtzi K, Shih DQ et al. Substance P mediates pro-inflammatory cytokine release form mesenteric adipocytes in inflammatory bowel disease patients. Cell Mol Gastroenterol Hepatol 2015; 1 (4): 420–432. doi: 10.1016/j.jcmgh.2015.03.003.
73. Drouet M, Dubuquoy L, Desreumaux P et al. Visceral fat and gut inflammation. Nutrition 2012; 28 (2): 113–117. doi: 10.1016/j.nut.2011.09.009.
74. Acedo SC, Gotardo EMF, Lacerda JM et al. Perinodal adipose tissue and mesenteric lymph node activation during reactivated TNBS-colitis in rats. Dig Dis Sci 2011; 56 (9): 2545–2552. doi: 10.1007/s10620-011-1644-8.
75. Gewirtz AT. Deciphering the role of mesenteric fat in inflammatory bowel disease. Cell Mol Gastroenterol Hepatol 2015; 1 (4): 352–353. doi: 10.1016/j.jcmgh.2015.05.004.
76. Vermeire S, Van Assche G, Rutgeerts P. The role of C-reactive protein as an inflammatory marker ingastrointestinal diseases. Nat Clin Pract Gastroenterol Hepatol 2005; 2 (12): 580–586. doi: 10.1038/ncpgasthep0359.
77. Zulian A, Cancello R, Micheletto G et al. Visceral adipocytes: old actors in obesity and new protagonists in Crohn’s disease? Gut 2012; 61 (1): 86–94. doi: 10.1136/gutjnl-2011-300391.
78. Zulian A, Cancello R, Ruocco C et al. Differences in visceral fat and fat bacterial colonization between ulcerative colitis and Crohn’sdisease. An in vivo and in vitro study. PLoS One 2013; 8 (10): e78495. doi: 10.1371/journal.pone.0078495.
79. Charrière G, Cousin B, Arnaud E et al. Preadipocyte conversion to macrophage. Evidence of plasticity. J Biol Chem 2003; 278 (11): 9850–9855. doi: 10.1074/jbc.M210811200.
80. Xu H, Barnes GT, Yang Q et al. Chronic inflammation in fat plays a crucial role in the development of obesity-related insulin resistance. J Clin Invest 2003; 112 (12): 1821–1830. doi: 10.1172/JCI19451.
81. Morshedzadeh N, Rahimlou M, Asadzadeh AH et al. Association between adipokines levels with inflammatory bowel disease (IBD): systematic reviews. Dig Dis Sci 2017; 62 (12): 3280–3286. doi: 10.1007/s10620-017-4806-5.
82. Azamar-Llamas D, Hernández-Molina G, Ramos-Ávalos B et al. Adipokine contribution to the pathogenesis of osteoarthritis. Mediators Inflamm 2017; 2017: 5468023. doi: 10.1155/ 2017/5468023.
83. Graßmann S, Wirsching J, Eichelmann F et al. Association between peripheral adipokines and inflammation markers: a systematic review and meta-analysis. Obesity (Silver Spring) 2017; 25 (10): 1176–1785. doi: 10.1002/oby.21945.
84. Biesiada G, Czepiel J, Ptak-Belowska A et al. Expression and release of leptin and proinflammatory cytokines in patients with ulcerative colitis and infectious diarrhea. J Physiol Pharmacol 2012; 63 (5): 471–481.
85. Tuzun A, Uygun A, Yesilova Z et al. Leptin levels in the acute stage of ulcerative colitis. J Gastroenterol Hepatol 2004; 19 (4): 429–432. doi: 10.1111/j.1440-1746.2003.03300.x.
86. Barbier M, Vidal H, Desreumaux P et al. Overexpression of leptin mRNA in mesenteric adipose tissue in inflammatory bowel diseases. Gastroenterol Clin Biol 2003; 27 (11): 987–991.
87. Paul G, Schäffler A, Neumeier M et al. Profiling adipocytokine secretion from creeping fat in Crohn’s disease. Inflamm Bowel Dis 2006; 12 (6): 471–477. doi: 10.1097/00054725-200606 000-00005.
88. Kahraman R, Calhan T, Sahin A et al. Are adipocytokines inflammatory or metabolic mediators in patients with inflammatory bowel disease? Ther Clin Risk Manag 2017; 13: 1295–1301. doi: 10.2147/TCRM.S140618.
89. Valentini L, Wirth EK, Schweizer U et al. Circulating adipokines and the protective effects of hyperinsulinemia in inflammatory bowel disease. Nutrition 2009; 25 (2): 172–181. doi: 10.1016/j.nut.2008.07.020.
90. Karmiris K, Koutroubakis IE, Xidakis C et al. Circulating levels of leptin, adiponectin, resistin, and ghrelin in inflammatory bowel disease. Inflamm Bowel Dis 2006; 12 (2): 100–105. doi: 10.1097/01.MIB.0000200345.38837.46.
91. Yamamoto K, Kiyohara T, Murayama Y et al. Production of adiponectin, an anti-inflammatory protein, in mesenteric adipose tissue in Crohn’s disease. Gut 2005; 54 (6): 789–796. doi: 10.1136/gut.2004.046516.
92. Al-Suhaimi EA, Shehzad A. Leptin, resistin and visfatin: the missing link between endocrine metabolic disorders and immunity. Eur J Med Res 2013; 18 (1): 12. doi: 10.1186/2047-783X-18-12.
93. Karmiris K, Koutroubakis IE, Xidakis C et al. The effect of infliximab on circulating levels of leptin, adiponectin and resistin in patients with inflammatory bowel disease. Eur J Gastroenterol Hepatol 2007; 19 (9): 789–794. doi: 10.1097/MEG.0b013e3282202bca.
94. Han S, Wang G, Qiu S et al. Increased colonic apelin production in rodents with experimental colitis and in humans with IBD. Regul Pept 2007; 142 (3): 131–137. doi: 10.1016/j.regpep.2007.02.002.
95. Ge Y, Li Y, Chen Q et al. Adipokine apelin ameliorates chronic colitis in Il-10−/−mice by promoting intestinal lymphatic functions. Biochem Pharmacol 2018; 148: 202–212. doi: 10.1016/j.bcp.2018.01.011.
96. Weigert J, Obermeier F, Neumeier M et al. Circulating levels of chemerin and adiponectin are higher in ulcerative colitis and chemerin is elevated in Crohn’s disease. Inflamm Bowel Dis 2010; 16 (4): 630–637. doi: 10.1002/ibd.21091.
97. Terzoudis S, Malliaraki N, Damilakis J et al. Chemerin, visfatin, and vaspin serum levels in relation to bone mineral density in patients with inflammatory bowel disease. Eur J Gastroenterol Hepatol 2016; 28 (7): 814–819. doi: 10.1097/MEG.0000000000000617.
98. Waluga M, Hartleb M, Boryczka G et al. Serum adipokines in inflammatory bowel disease. World J Gastroenterol 2014; 20 (22): 6912–6917. doi: 10.3748/wjg.v20.i22.6912.
99. Dogan S, Guven K, Celikbilek M et al. Serum visfatin levels in ulcerative colitis. J Clin Lab Anal 2016; 30 (5): 552–556. doi: 10.1002/jcla.21901.
100. Moschen AR, Kaser A, Enrich B et al. Visfatin, an adipocytokine with proinflammatory and immunomodulating properties. J Immunol 2007; 178 (3): 1748–1758. doi: 10.4049/jimmunol.178.3.1748.
101. Starr AE, Deeke SA, Ning Z et al. Proteomic analysis of ascending colon biopsies from a paediatric inflammatory bowel disease inception cohort identifies protein biomarkers that differentiate Crohn’s disease from UC. Gut 2017; 66 (9): 1573–1583. doi: 10.1136/gutjnl-2015-310705.
102. DeClercq V, Langille MGI, Van Limbergen J. Differences in adiposity and diet quality among individuals with inflammatory bowel disease in Eastern Canada. PLoS One 2018; 13 (7): e0200580. doi: 10.1371/journal.pone.0200580.
103. González-Muniesa P, Mártinez-González MA, Hu FB et al. Obesity. Nat Rev Dis Primers 2017; 3: 17034. doi: 10.1038/nrdp.2017.34.
104. Shoda R, Matsueda K, Yamato S et al. Epidemiologic analysis of Crohn disease in Japan: increased dietary intake of n-6 polyunsaturated fatty acids and animal protein relates to the increased incidence of Crohn disease in Japan. Am J Clin Nutr 1996; 63 (5): 741–745. doi: 10.1093/ajcn/63.5.741.
105. Hou JK, Abraham B, El-Serag H. Dietary intake and risk of developing inflammatory bowel disease: A systematic review of the literature. Am J Gastroenterol 2011; 106 (4): 563–573. doi: 10.1038/ajg.2011.44.
106. Wright EK, Kamm MA, Teo SM et al. Recent advances in characterizing the gastrointestinal microbiome in Crohn’s disease: a systematic review. Inflamm Bowel Dis 2015; 21 (6): 1219–1228. doi: 10.1097/MIB.000000000000382.
107. Schaubeck M, Haller D. Reciprocal interaction of diet and microbiome in inflammatory bowel diseases. Curr Opin Gastroenterol 2015; 31 (6): 464–470. doi: 10.1097/MOG.000 000000000216.
108. De Filippo C, Cavalieri D, Di Paola M et al. Impact of diet in shaping gut microbiota revealed by a comparative study in children from Europe and rural Africa. Proc Natl Acad Sci USA 2010; 107 (33): 14691–14696. doi: 10.1073/pnas.1005963107.
109. Albenberg LG, Lewis JD, Wu GD. Food and the gut microbiota in inflammatory bowel diseases: a critical connection. Curr Opin Gastroenterol 2012; 28 (4): 314–320. doi: 10.1097/MOG. 0b013e328354586f.
110. Kim A. Dysbiosis: a review highlighting obesity and inflammatory bowel disease. J Clin Gastroenterol 2015; 49 (Suppl 1): S20–S24. doi: 10.1097/MCG.0000000000000356.
111. Ni J, Wu GD, Albenberg L et al. Gut microbiota and IBD: causation or correlation? Nat Rev Gastroenterol Hepatol 2017; 14 (10): 573–584. doi: 10.1038/nrgastro.2017.88.
112. DeGruttola AK, Low D, Mizoguchi A et al. Current understanding of dysbiosis in disease in human and animal models. Inflamm Bowel Dis 2016; 22 (5): 1137–1150. doi: 10.1097/MIB.000 0000000000750.
113. Schink M, Konturek PC, Tietz E et al. Microbial patterns in patients with histamine intolerance. J Physiol Pharmacol 2018; 69 (4): 579–593. doi: 10.26402/jpp.2018.4.09.
114. Pendyala S, Walker JM, Holt PR. A high-fat diet is associated with endotoxemia that originates from the gut. Gastroenterology 2012; 142 (5): 1100–1101. doi: 10.1053/j.gastro.2012.01.034.
115. Ghanim H, Abuaysheh S, Sia CL et al. Increase in plasma endotoxin concentrations and the expression of Toll-like receptors and suppressor of cytokine signaling-3 in mononuclear cells after a high-fat, high-carbohydrate meal: implications for insulin resistance. Diabetes Care 2009; 32 (12): 2281–2287. doi: 10.2337/dc09-0979.
116. Maciejewska D, Skonieczna-Zydecka K, Lukomska A et al. The short chain fatty acids and lipopolysaccharides status in Sprague-Dawley rats fed with high-fat and high-cholesterol diet. J Physiol Pharmacol 2018; 69 (2): 6. doi: 10.26402/jpp.2018.2.05.
117. Singh S, Proudfoot J, Xu R et al. Obesity and response to infliximab in patients with inflammatory bowel diseases: pooled analysis of individual participant data from clinical trials. Am J Gastroenterol 2018; 113 (6): 883–889. doi: 10.1038/s41395-018-0104-x.
118. Bhalme M, Sharma A, Keld R et al. Does weight-adjusted anti-tumour necrosis factor treatment favour obese patients with Crohn’s disease? Eur J Gastroenterol Hepatol 2013; 25 (5): 543–549. doi: 10.1097/MEG.0b013e32835d1f15.
119. Dotan I, Ron Y, Yanai H et al. Patient factors that increase infliximab clearance and shorten half-life in inflammatory bowel disease: a population pharmacokinetic study. Inflamm Bowel Dis 2014; 20 (12): 2247–2259. doi: 10.1097/MIB.0000000000000212.
120. Sharma S, Eckert D, Hyams JS et al. Pharmacokinetics and exposure-efficacy relationship of adalimumab in pediatric patients with moderate to severe Crohn’s disease: results from a randomized, multicenter, phase-3 study. Inflamm Bowel Dis 2015; 21 (4): 783–792. doi: 10.1097/MIB.0000000000000327.
121. Colombel JF, Sandborn WJ, Allez M et al. Association between plasma concentrations of certolizumab pegol and endoscopic outcomes of patients with Crohn’s disease. Clin Gastroenterol Hepatol 2014; 12 (3): 423–431. doi: 10.1016/j.cgh.2013.10.025.
122. Xu ZH, Lee H, Vu T et al. Population pharmacokinetics of golimumab in patients with ankylosing spondylitis: impact of body weight and immunogenicity. Int J Clin Pharmacol Ther 2010; 48 (9): 596–607. doi: 10.5414/cpp48596.
123. Rosario M, Dirks NL, Gastonguay MR et al. Population pharmacokinetics-pharmacodynamics of vedolizumab in patients with ulcerative colitis and Crohn’s disease. Aliment Pharmacol Ther 2015; 42 (2): 188–202. doi: 10.1111/apt.13243.
124. Swanson SM, Harper J, Zisman TL. Obesity and inflammatory bowel disease: diagnostic and therapeutic implications. Curr Opin Gastroenterol 2018; 34 (2): 112–119. doi: 10.1097/MOG.0000000000000422.
125. Harper JW, Sinanan MN, Zisman TL. Increased body mass index is associated with earlier time to loss of response to infliximab in patients with inflammatory bowel disease. Inflamm Bowel Dis 2013; 19 (10): 2118–2124. doi: 10.1097/MIB.0b013e31829cf401.
126. Bultman E, de Haar C, van Liere-Baron A et al. Predictors of dose escalation of adalimumab in a prospective cohort of Crohn’s disease patients. Aliment Pharmacol Ther 2012; 35 (3): 335–341. doi: 10.1111/j.1365-2036.2011.04946.x.
127. Klaasen R, Wijbrandts CA, Gerlag DM et al. Body mass index and clinical response to infliximab in rheumatoid arthritis. Arthritis Rheum 2011; 63 (2): 359–364. doi: 10.1002/art.30136.
128. Gremese E, Carletto A, Padovan M et al. Obesity and reduction of the response rate to anti-tumor necrosis factor in rheumatoid arthritis: an approach to a personalized medicine. Arthritis Care Res (Hoboken) 2013; 65 (1): 94–100. doi: 10.1002/acr.21768.
129. Eder L, Thavaneswaran A, Chandran V et al. Obesity is associated with a lower probability of achieving sustained minimal disease activity state among patients with psoriatic arthritis. Ann Rheum Dis 2015; 74 (5): 813–817. doi: 10.1136/annrheumdis-2013-204448.
130. Poon SS, Asher R, Jackson R et al. Body mass index and smoking affect thioguanine nucleotide levels in inflammatory bowel disease. J Crohns Colitis 2015; 9 (8): 640–646. doi: 10.1093/ecco-jcc/jjv084.
131. Makino T, Shukla PJ, Rubino F et al. The impact of obesity on perioperative outcomes after laparoscopic colorectal resection. Ann Surg 2012; 255 (2): 228–236. doi: 10.1097/SLA.0b013 e31823dcbf7.
132. Jain A, Limketkai BN, Hutfless S. The effect of obesity on post-surgical complications during hospitalizations for inflammatory bowel disease: a nationwide analysis. Gastroenterology 2014; 146 (5): S595–S596.
133. Ding Z, Wu XR, Remer EM et al. Association between high visceral fat area and postoperative complications in patients with Crohn’s disease following primary surgery. Colorectal Dis 2016; 18 (2): 163–172. doi: 10.1111/codi.13128.
134. Colombo F, Rizzi A, Ferrari C et al. Bariatric surgery in patients with inflammatory bowel disease: an accessible path? Report of a case series and review of the literature. J Crohns Colitis 2015; 9(2): 185–190. doi: 10.1093/ecco-jcc/jju011.
135. Aminian A, Andalib A, Ver MR et al. Outcomes of bariatric surgery in patients with inflammatory bowel disease. Obes Surg 2016; 26(6): 1186–1190. doi: 10.1007/s11695-015-1909-y