Malnutrice u jaterní cirhózy - patogeneze vzniku, klinický dopad a možnosti ovlivnění
Milan Dastych Jr.1, Michal Šenkyřík Orcid.org 2, Libuše Husová Orcid.org 3, Jan Lata4
+ Pracoviště
Souhrn
Jaterní cirhóza je spojena s komplexní malnutricí s dominujícím deficitem proteinů jak sérových, tak svalových, s deplecí tukové tkáně a jaterního glykogenu, karencí vitaminů a stopových prvků (zinek, selen). V diagnostice této specifické malnutrice selhávají klasické ukazatele stavu výživy, které jsou ovlivněny jaterní chorobou (změny tělesné váhy, BMI, albumin). Dle současných znalostí jsou pro diagnostiku podvýživy u jaterní cirhózy zásadní jednoduchá antropometrická měření - kožní řasa nad tricepsem, obvod svalů paže a síla stisku ruky, které jsou spolu s hodnocením příjmu potravy citlivými ukazateli malnutrice. Výskyt malnutrice u jaterní cirhózy je udáván v rozmezí 12-68 % a pozitivně koreluje s tíží jaterní cirhózy. U pacientů s jaterní cirhózou ve stadiu Ch-P A, B vystupuje malnutrice jako nezávislý rizikový faktor a negativně koreluje s délkou přežití pacientů. U pacientů s jaterní cirhózou ve stadiu Ch-P C vliv na přežití nebyl prokázán. Včasná diagnostika podvýživy v počátečních stadiích jaterní cirhózy a její ovlivnění může pozitivně ovlivnit prognózu nemocných.
Klíčová slova: jaterní cirhóza - léčba - malnutrice.
ÚVOD
Jaterní cirhóza je ve velkém procentu případů spojena se specifickým typem malnutrice, spoluvytváří klinický obraz choroby. Autoři ve světovém písemnictví popisují 30-50% přítomnost poruchy výživy u pacientů s jaterní cirhózou, přičemž stupeň jaterního selhávání je přímo úměrný tíži malnutrice. Pokud bychom hovořili o poruše výživy v nejširším slova smyslu, lze metabolické abnormality a změny biochemických reakcí pozorovat již ve stadiích předcházejících cirhóze, tedy u steatózy a fibrózy Důležitá je skutečnost, že tyto abnormality jsou po odstranění etiologického činitele jaterního poškození (abstinence, potlačení replikace viru, snížení obsahu mědi) reverzibilní, a nemají tedy dopad a vliv na prognózu nemoci. Jiná situace vyvstává u jaterní cirhózy, kdy postižení funkční kapacity jaterní tkáně je trvalé. Stejně tak jsou trvale abnormální i biochemické a metabolické reakce. Výsledkem jsou potom klinicky a laboratorně měřitelné změny, které odrážejí poruchy výživy související s jaterní cirhózou. Porucha výživy je tím hlubší, čím závažnější je jaterní postižení. Ovlivnění nutričního stavu u pacientů s jaterní cirhózou vhodným způsobem může mít příznivý vliv na prognózu nemocných a může snížit výskyt komplikací. V předkládané práci chceme pojednat o příčinách vzniku malnutrice u jaterní cirhózy, možnostech její diagnostiky, jejím výskytu a významu jako nezávislého rizikového faktoru. Závěrem jsou diskutovány možnosti a indikace nutričních intervencí dle guidelines (Evropská společnost pro parente rální a enterální výživu) a vlastních zkušeností.
PATOGENEZE VZNIKU MALNUTRICE U JATERNÍ CIRHÓZY
U pacientů se stabilizovanou jaterní cirhózou se můžeme setkat s nižším příjmem proteinů a energetických substrátů, zejména tuků. Práce H. Davidsona, provedená u 52 cirhotiků (Ch-P: 9) prokázala signifikantně nižší příjem proteinů (71 %), tuků (75 %) a energie (75 %) ve srovnání s kontrolní skupinou(1). Naopak studie Riggiova neprokázala u skupiny 74 stabilizovaných cirhotiků (Ch-P: 6) negativní energetickou bilanci a snížení příjmu živin(2). Rozdíl mezi studiemi byl ve výběru pacientů, kteří se lišili tíží jaterní cirhózy dle Ch-P klasifikace. Lze tedy říci, že příjem živin negativně koreluje s tíží jaterní cirhózy a dle dalších prací s jejími komplikacemi(3,4). Na patogenezi nízkého příjmu potravy se podílí několik faktorů. Klíčové jsou pravděpodobně hormonální změny ovlivňující globálně organismus, které vedou ke vzniku nechutenství, změnám bazálního metabolismu včetně utilizace živin. V literatuře byly u pacientů s jaterní cirhózou popsány ýšené hladiny leptinu a tumor nekrotizujícího faktoru (TNF), které negativně ovlivňují příjem potravy, zvyšují energetický výdej a udržují vznikající kachexii(5). Dalším faktorem omezujícím příjem potravy jsou chybná dietní doporučení. Týkají se zejména neopodstatněného omezení příjmu tuků(1,2). Výsledkem restrikce tuku a preference beztukových diet, potažmo jaterních, je jednak deficit energetického substrátu a jednak chyběni esenciálních lipidů a fosfolipidů nutných k regeneraci jaterních buněk, vitaminů rozpustných v tucích a mastných kyselin. Neopomenutelným faktorem ovlivňujícím příjem živin je alkoholismus a s ním související sociální a dietní zvyklosti, které vedou k nízkému příjmu proteinů, vitaminů a stopových prvků(6). Dříve doporučovaná restrikce bílkovin až na 30 g/den u pacientů s jaterní cirhózou a encefalopatií se také významnou měrou podílela na negativní dusíkové bilanci. Navíc tato přísná restrikce bílkovin málo ovlivňuje tíži jaterní encefalopatie.
U cirhotiků se setkáváme s maldigescí a následnou malabsorpcí přijatých živin. Maldigesce souvisí s omezenou produkcí žluče, jejíž složení bývá mnohdy defektní(7), a to v důsledku snížené syntézy žlučových kyselin(8)a fosfolipidů. Výsledkem je špatná emulgace tuků a omezené vstřebávání vitaminů rozpustných v tucích (ADEK), vystupňované u jaterní cirhózy s cholestázou. Při portální hypertenzi pozorujeme překrvení žaludeční a střevní stěny - kongestivní gastroenteropatii. Tyto změny mají negativní dopad na vstřebávání živin(9,10), negativně ovlivňují střevní mikroflóru a střevní permeabilitu(11,12). Právě zvýšení střevní permeability jaterní cirhózy při portální hypertenzi, spojené se zvýšenou bakteriální translokací(11,13-15), může být klíčovým mechanismem vzniku a udržování malnutrice jaterní cirhózy. Jak tyto práce ukazují, zvýšená střevní permeabilita vede k invazi mikroorganismů nebo jejich součástí (endotoxin) do střevní stěny, lymfatických uzlin a systémového oběhu, kde svým antigenním působením vyvolávají imunitní reakci spojenou s produkcí zánětlivých cytokinů (TNF), které přímo ovlivňují metabolické cesty využití substrátů, energetický výdej, apetit, a nastavují tak celé metabolické klima organismu. Tyto změny pak vedou, podobně jako u nádorů nebo chronického srdečního selhání, k vývoji a fixaci malnutrice. Kromě výše uvedeného je portální hypertenze spoluzodpovědná za tvorbu ascitu a možný rozvoj spontánní bakteriální peritonitidy (SBP) jako manifestní infekce. Ascites mechanickým působením omezuje příjem potravy a SBP vede ke katabolismu bílkovin se svalovou proteolýzou. Řešení portální hypertenze (TIPS, spojkové operace) tak příznivě ovlivní stav výživy.
U jaterní cirhózy pravidelně pozorujeme změny v metabolismu cukrů, tuků a bílkovin. Setkáváme se s hyperinzulinismem a inzulínovou rezistencí(16). V játrech klesá zásoba glykogenu a zkracuje se doba efektivní glykogenolýzy k udržení normoglykémie při hladovění. Zatímco u zdravého jedince vydrží zásoby glykogenu na 18-24 hodin, u pacientů s jaterní cirhózou je tato doba zkrácena na 6-8 hodin. Již za krátkodobého hladovění dochází k proteolýze za účelem glukoneogeneze a lipolýze k získání energetických substrátů. Navíc jsou pacienti ohroženi rizikem vzniku hypoglykémie. Pozorovanou inzulínovou rezistenci lze do jisté míry považovat za ochranný mechanismus, zabezpečující konstantní glykémii(17).
U tukového metabolismu je aktivována lipolýza a stoupá hladina neesterifikovaných mastných kyselin, které se stávají hlavním energetickým substrátem pro periferní tkáně a játra. Omezený zdroj tuků v důsledku dietních opatření a jejich porušená resorpce vede k čerpání endogenních tukových rezerv s postupným rozvojem jejich deplece. Tento stav je charakteristický pro pokročilou jaterní cirhózu. Důsledkem spotřeby tukových rezerv je stupňování katabolismu svalového proteinu z důvodu glukoneogeneze a postupný rozvoj svalové atrofie - sarkopenie(16).
Metabolismus proteinů je ovlivněn komplexně. Díky snížené funkční kapacitě jaterní tkáně klesá syntéza celé řady proteinů (koagulační faktory, albumin, prealbumin), zároveň je zvýšená proteolýza ve svalech v důsledku inzulinorezistence, glukoneogeneze a deficitu tuků. Důsledkem je rozvoj komplexní proteinové malnutrice s nízkými sérovými hladinami anabolických proteinů a již zmíněnou sarkopenií. Popsaná rezistence k růstovému hormonu a inzulínu podobnému růstovému faktoru (IGF) se také podílí na udržování katabolismu bílkovin(17). Právě deficit svalové tkáně je považován za negativní nezávislý prognostický faktor délky přežití pacientů s jaterní cirhózou.
V souvislosti s metabolismem živin je zajímavý vliv pohlaví. Rozsáhlá italská práce(18)provedená na 212 pacientech s jaterní cirhózou popsala u žen přednostní utilizaci tukových zásob se zachováním svalové hmoty, tedy obraz odpovídající nekomplikovanému hladovění s deplecí tukové tkáně. U mužů naopak prokázala preferenční metabolizaci svalů („fat free mass"), což vede k jejich redukci a metabolicky odpovídá stresovému hladovění v kritickém stavu. Důvodem výše popsaných změn jsou hormonální změny pozorované u mužů. Jedná se o nižší hladinu testosteronu a androstendionu a vyšší hladinu estradiolu a dehydroepiandrosteronu, což také souvisí s klinicky pozorovanou feminizací mužů trpících cirhózou. Jiné práce tento vliv pohlaví nezdůrazňují a vznik stresového hladovění u pacientů s jaterní cirhózou dávají spíše do souvislosti s probíhajícími komplikacemi jaterní cirhózy (krvácení z jícnových varixů, infekční komplikace, spontánní bakteriální peritonitida, hepatorenální syndrom) (19-21).
Výsledkem všech výše uvedených faktorů a změn je rozvoj komplexní malnutrice s dominujícím deficitem proteinů jak sérových, tak svalových, ale také deplecí tukové tkáně a jaterního glykogenu, karencí vitaminů a stopových prvků (zinek, selen). Poruchu výživy u jaterní cirhózy nelze tedy jednoduše nazvat proteinovou nebo marantickou malnutricí, ale právem hovoříme o specifické proteino-energetické malnutrici jaterní cirhózy.
DIAGNOSTIKA MALNUTRICE U JATERNÍ CIRHÓZY
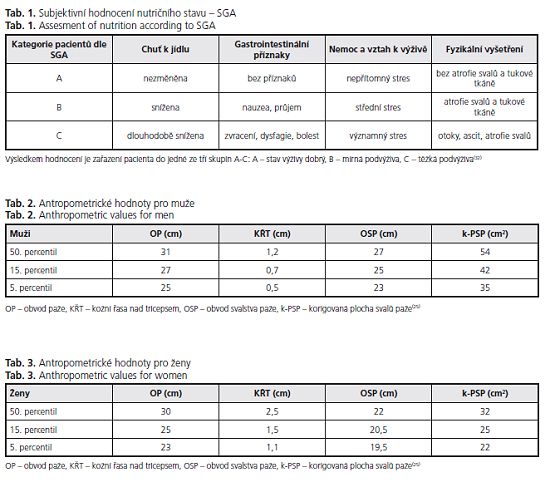
Jaké jsou možnosti diagnostiky přítomnosti a eventuálně hodnocení stupně poruchy výživy u jaterní cirhózy? V klinické praxi se diagnostika podvýživy tradičně opírá o tři oblasti: 1. anamnézu, 2. antropometrii, 3. laboratorní vyšetření. Řada klasických diagnostických ukazatelů podvýživy u jaterní cirhózy selhává. Důvodem jsou jednak metabolické změny a jednak klinické projevy cirhózy se sekvestrací tekutin (ascites, edémy). Z anamnézy selhává důležitý marker ýživy respektive rizika malnutrice, a sice váhový úbytek - dynamická váha. U pacientů s jaterní cirhózou se při zhoršení jaterní funkce a zhoršení stavu výživy setkáváme naopak s nárůstem váhy v důsledku retence tekutin. Z antropometrických klasických parametrů ze stejného důvodu selhává body mass ex (BMI) a Brocův index (výška [cm] - 100). Hodnocení laboratorních parametrů je obtížné. U jaterní cirhózy je těžké odlišit, které laboratorní změny připadají na vrub snížené jaterní funkce a které jsou projevem poruchy výživy jako takové. To platí zejména pro hodnocení proteinového metabolismu - albumin, prealbumin, transferin. Z výše uvedených důvodů byly hledány jiné parametry, snadno měřitelné a málo ovlivněné jaterní chorobou. Práce zabývající se hodnocením stavu výživy u jaterní cirhózy se shodují, že klinické hodnocení stavu výživy a jednoduchá antropometrická měření jsou citlivými ukazateli přítomnosti podvýživy(18,19,22-24).
Z anamnestických údajů, hodnotící stav výživy, je třeba zdůraznit odhad porce přijímané potravy (celá, %, V2, Ví), » k jídlu a změny tělesné váhy s vědomím retence tekutin. Přesné zhodnocení jídelníčku pacientů je možné v ambulanci dietních sester. Tato analýza významně zpřesňuje odhad množství přijímané energie a živin a odhaluje špatné dietní návyky. Po fyzikálním vyšetření pacientů spolu s výše jmenovanými anamnestickými údaji může zkušený klinik určit stav výživy (bez podvýživy [A], střední podvýživa [B], těžkápodvýživa [C]), a stanovit tak klinické hodnocení výživy (Subjective Global Assessment, , kategorie A-C) (tab. ). V rozsáhlé italské multicentrické studii(19)koreloval SGA s antropometricky diagnostikovanou podvýživou v 77 % případů. Je třeba také říci, že v současné době úpadku propedeutického přístupu k pacientům a přemíře objektivních metod bude klinický odhad pravděpodobně horší. Zařazení jedého antropometrického měření k diagnostice podvýživy u jaterní cirhózy je proto namístě.
K antropometrickým měřením patří obvod paže (OP v cm) a kožní řasa nad tricepsem (KŘT v cm) s odvozenými hodnotami obvodu svalstva paže (OSP = OP-[7t x KŘT]) a korigovaná plocha svalů paže (k-PSP = OSP2/12,56 - 10 pro muže a OSP2 /12.56 - 6,5 pro ženy). Jejich hodnoty pod 15. percentil svědčí pro malnutrici a pod 5. percentil pro těžkou malnutrici. (tab. ,3)(25). Obvod paže a kožní řasa nad tricepsem se měří na volně svěšené nedominantní paži přesně uprostřed vzdálenosti mezi acromion a olecranon. KŘT musí být měřena na dorzální straně paže v čáře protínající olecranon. K měření OP lze použít běžný krejčovský metr nebo speciální pásmové měřidlo. KŘT se měří kaliperem. Dalším funkčně-antropometrickým parametrem ukazujícím buněčnou depleci (sarkopenii) je vyšetření síly stisku ruky (hand grip, ), jeho dostupnost je ale omezená na specializované nutriční ambulance.
Z biochemických ukazatelů lze zmínit sérovou koncentraci zinku, kdy snížené hodnoty mohou poukazovat na podvýživu. Další biochemické parametry jsou příliš ovlivněny jaterní funkcí a nelze je pro diagnostiku podvýživy použít. Provedením nepřímé kalorimetrie lze zjistit respirační kvocient (RQ) a energetickou potřebu pacientů. Existují práce prokazující korelaci mezi RQ a příjmem potravy a hladinou albuminu(21), kde i při normálních antropometrických hodnotách nízký RQ ukazoval na abnormální energetický metabolismus a na vznikající malnutrici. Naše zkušenosti u pacientů s jaterní cirhózou potvrdily signifikantně vyšší energetický výdej měřený nepřímou kalorimetrií ve srovnání s energetickou potřebou vypočtenou Hariss-Benedictovou rovnicí a dominantní utilizaci tuků, což odpovídá nízkému respiračnímu kvocientu (RQ = 0,69)(26).
VÝSKYT MALNUTRICE U JATERNÍ CIRHÓZY
Výskyt klinicky relevantní malnutrice u jaterní cirhózy je udáván v rozmezí 12-68 % podle použité detekční metody, podle etiologie a tíže jaterní cirhózy. Nejčastěji byla popisovaná malnutrice u mužů s alkoholickou etiologií jaterní cirhózy a pokračujícím abúzem alkoholu. Výskyt podvýživy pozitivně koreluje s tíží jaterní cirhózy klasifikované dle Ch-P klasifikace A-C, jak popisují níže citované práce. V práci E Alberina(18), kde k diagnostice použili KŘT a OP, byl výskyt malnutrice u pacientů s Ch-P A 12,5 % CH-P B 35 % a Ch-P C 45 %. Multicentrická italská studie(19), popisuje 20% výskyt malnutrice u Ch-P A a 50% u Ch-P C, k diagnostice sloužila KŘT a k-PSR. Francouzští autoři(24)odhalili za použití stejných metod malnutrici u pacientů s Ch-P A u 11 %, Ch-P B u 35 % a u Ch-P C u 54 %. Za použití HG k diagnostice poruchy výživy byla v práci M. da Silvy(23)malnutrice popsána u 68 % pacientů převážně s jaterní cirhózou CH-P A. Z uvedeného vyplývá, že při použití jednoduchých antropometrických měření je detekce malnutrice obdobná. Otázkou je využití HG, který se zdá v detekci poruchy výživy nejcitlivější, zvláště u lehkých stupňů jaterní cirhózy.
MALNUTRICE JAKO NEZÁVISLÝ RIZIKOVÝ FAKTOR PŘEŽITÍ
V práci Alberina(18)bylo po dobu dvou let sledováno 212 cirhotiků. Ke stanovení malnutrice byly použity antropometrické metody (KŘ, OSP). Pacienti s lehkou a těžkou podvýživou (KŘ a/nebo OSP < 10., resp. < 5. percentil) měli nižší pravděpodobnost přežití v 6, 12 a 24 měsíci ve srovnání s pacienty bez podvýživy S délkou přežití těsněji koreloval deficit svalové tkáně vyjádřený jako OSP.
V práci M. da Silvy(23)provedené u 50 cirhotiků, kdy k definici podvýživy byl použit HG, bylo prokázáno, že pacienti označeni jako malnutriční (HG pod 5. percentil normy) mají horší prognózu díky častějšímu výskytu komplikací - refrakterní ascites, jaterní encefalopatie, spontánní bakteriální peritonitidy, hepatorenálního syndromu. Tyto komplikace se vyskytly u 65 % malnutričních pacientů na rozdíl od 11,8 % pacientů bez známek podvýživy. Rozsáhlá multicentrická studie Merliho(27)hodnotila efekt malnutrice u 1492 pacientů s jaterní cirhózou. K diagnostice byla použita antropometrie (PSP a KŘ pod 5. percentil). Malnutrice zvyšovala relativní riziko úmrtí u pacientů s jaterní cirhózou na dvojnásobek. Významnější vliv na přežití měla deplece svalstva než tukových rezerv. Po stratifikaci pacientů dle tíže jaterní cirhózy podle Ch-P klasifikace bylo prokázáno, že u skupiny pacientů s Ch-P C nemá nutriční stav velký vliv na přežití, které je ovlivňováno především komplikacemi cirhózy (ascites, krvácení z varixů, SBP, HRS). Naopak u pacientů Ch-P A, B s deplecí svalového proteinu byl vliv na prognózu pacientů zřetelný.
Z výše uvedených prací lze shrnout, že malnutrice negativně ovlivňuje přežití pacientů s nižší tíží jaterního postižení (Ch-P A, B), kde vystupuje jako nezávislý rizikový faktor průběhu jaterní cirhózy. Navíc zhoršuje pooperační průběh a přežití pacientů po transplantaci jater(28)a pravděpodobně ovlivňuje výskyt infekčních komplikací a krvácení z jícnových varixů(29). Deficit svaloviny se jeví jako nejcitlivější ukazatel malnutrice a k jeho diagnostice lze nejlépe využít HG a OSP. Zlepšení nutričního stavu pacientů s jaterní cirhózou má pozitivní vliv na průběh choroby a prognózu nemocných.
LÉČBA MALNUTRICE U JATERNÍ CIRHÓZY
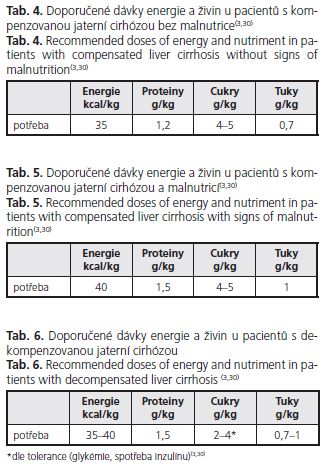
Jaké jsou v současné době indikace k nutriční intervenci u pacientů s jaterní cirhózou? Jaké modality můžeme využít? V prvé řadě je třeba vybrat nemocného, který intervenci potřebuje. K tomuto výběru prakticky slouží jednoduché diagnostické postupy. Je to jednak zhodnocení perorálního příjmu potravy a jednak změření tlouš»ky kožní řasy nad tricepsem a obvodu nedominantní paže. Odvozené výpočty obvodu svalstva paže a plochy svalstva paže zpřesňují diagnostiku. Pacienti, kteří nepřijímají celé porce a/nebo vykazují hodnoty antropometrických ukazatelů pod 15., resp. 5. percentil normy, jsou indikování k nutriční intervenci. K dispozici máme jednak kontrolu dietních zvyklostí a korekci případných chybných doporučení, sipping, ální výživu a parenterální výživu. V případě kompenzovaného cirhotika známkami malnutrice nejprve revidujeme dietní zvyklosti, nutno potvrdit nebo vyloučit příjem alkoholu. Chybná dietní doporučení u pacientů s jaterní cirhózou se nejvíce týkají historicky vžitých „jaterních" diet, založených na přísném omezení tuků, sníženém příjmu bílkovin a omezení luštěnin (dieta 4/S 60 g B, 25 g T, 400 g S, 8900 kj). Tyto diety byly vytvořeny pro pacienty s akutní hepatitidou pro přechodnou nesnášenlivost tuků při cholestáze a pacienty s alkoholickou steatohepatitidou, kde působí spolu s abstinencí léčebně. Pro pacienty s kompenzovanou jaterní cirhózou jsou nevhodné. Je třeba zdůraznit, že omezení energetických substrátů (tuku) vede k depleci svalového proteinu s vývinem sarkopenie a fixaci malnutrice se všemi negativními dopady. Ve studii Riggia u 74 cirhotických pacientů s převahou CH-P A (44 pacientů) byla prokázána preferenční utilizace tuků odpovídající nízkému respiračnímu kvocientu a signifikantně nižší příjem tuků u malnutričních cirhotiků(2). V dietních doporučeních tedy tuky neomezujeme, je možno doporučit jak živočišné, tak rostlinné tuky dle individuální snášenlivosti (máslo, smetanové jogurty, tavené a tvrdé sýry, oleje, vepřové, hovězí maso, mořské ryby). Důraz by měl být také kladen na dostatečný příjem bílkovin v dávce 1,2 g/kg ideální váhy (výška (cm) - 100), a to jak živočišného, tak lépe rostlinného původu pro nižší obsah aromatických aminokyselin. Také přívod rozpustné vlákniny (zelenina, luštěniny, obilniny, laktulóza) má význam pro vytvoření převahy kvasných střevních procesů nad hnilobnými, což může příznivě ovlivnit vznik jaterní encefalopatie (tab. ). U pacientů, u kterých revize dietních zvyklostí neýší energetický příjem, je indikována doplňková enterální výživa formou popíjení ochucených přípravků (sipping) dávce 300-600 kcal(3,30).
U pacientů s dekompenzovanou cirhózou (vzestup bilirubinu, hepatorenální syndrom, ascites) je nutné za hospitalizace zjistit jejich perorální příjem. Pokud příjem energie a živin nedosahuje (i při zařazení sippingu) doporučených hodnot (tab. ), je metodou volby enterální výživa (EV) nazojejunální sondou při netoleranci nebo kontraindikacích EV pak parenterální výživa (PV).
Dotazníková studie, která měla za cíl zjistit podíl používání parenterální a enterální výživy u pacientů s jaterním selháním, provedená ve 33 centrech, ukázala, že 50 % pacientů dostávalo enterální výživu a u 50 % pacientů byla použita výživa parenterální(31). Je možno shrnout, že způsob nutriční intervence v těchto případech je dán zkušenostmi konkrétního pracoviště. Z našeho pohledu se jeví jako základní předpoklad správného výživového zajištění dodržení adekvátní dodávky energie a živin. Forma podání závisí na místních zvyklostech a toleranci pacientů. Jistě lze parenterální a enterální způsob kombinovat a v případě dobré tolerance EV postupně parenterální dodávku živin omezit a přejít na plnou EV, která má podstatně méně komplikací a je levnější. U našich pacientů s dekompenzovanou jaterní cirhózou zahajujeme nutriční intervenci úplnou parenterální výživou v dávkách uvedených v tabulce 5 a po 2 týdnech, dle vývoje, přecházíme na perorální příjem či plnou EV nazojejunální sondou.
U pacientů s jaterní encefalopatií í jednoznačné doporučení, zda volit enterální nebo parenterální výživu(3). Pokud je zvolena enterální výživa, je nutné pro zvýšené riziko aspirace, přísné zavedení sondy do jejuna, nejlépe pod endoskopickou kontrolou. Pokud se jaterní encefalopatie významně zhorší po zahájení EV, je možné přejít na přípravky EV se zvýšeným obsahem rozvětvených aminokyselin (Fresubin hepa) a posílit přívod rozpustné vlákniny (laktulóza, Benefibra) spolu s probiotiky Na našem pracovišti preferujeme za těchto situací podání úplné PV se zvýšeným podílem rozvětvených aminokyselin (tab. 6).
Enterální výživa (EV)
Cesta podání enterální výživy je obvykle nazojejunální sondou, méně často popíjením. Perkutánní endoskopická gastrostomie nebo jejunostomie jsou u pacientů s jaterní cirhózou nevhodné pro riziko krvácení a infekci ascitu. Nutno respektovat kontraindikace EV - krvácení do GIT, náhlé příhody břišní. V těchto situacích je na místě úplná parenterální výživa. K enterální výživě lze použít standardní polymerní přípravky s energetickou denzitou 1 kcal/ ml. Při dobré toleranci pak můžeme s výhodou přejít na přípravky s vyšší energetickou denzitou (1,5 kcal/ml roztoku) pro omezení nálože tekutin. Enterální formule s rozvětvenými aminokyselinami jsou na našem trhu omezeně dostupné (Fresubin hepa) a poměrně nákladné. Výhodné jsou enterální přípravky s obsahem rozpustné vlákniny, která podporuje kvasné pochody ve střevech a omezuje zhoršování jaterní encefalopatie a průjmy. Podávání enterální výživy může být kontinuální, mimo jiné k prevenci vzniku hypoglykémií a dodržení požadované dávky živin. Je možné kombinovat EV sondou s perorálním příjmem, kdy je doplňková dávka enterální výživy podána v noční době, a tak je dodržena energetická nálož. Nejčastější komplikací EV, která mnohdy omezuje její praktické použití, je průjem. Průjmů lze předejít pomalým zahajováním EV, kdy cílové dávky dosahujeme za 4-5 dní, použitím přípravků s rozpustnou vlákninou a probiotik. Dobré zkušenosti máme s použitím pankreatických fermentů. Také lze použít klasická antidiarhoika resorpční (Smecta) nebo antiperistaltická (loper-amid, difenoxylát).
Parenterální výživa (PV)
Úplnou PV podáváme cestou centrálního žilního katétru. Jeho zavedení může být u dekompenzovaných cirhotiků spojeno s nutností hematologické přípravy, kterou provádíme vždy při dvojnásobně prodlouženém protrombinovém čase. Preferenčně využíváme roztoky aminokyselin s vyšším obsahem rozvětvených aminokyselin (40 % všech AK) a sníženým obsahem aromatických AK (Aminoplasmal hepa 10 %, Braun; Aminosteril hepa 8 %, Fresenius Kabi). Větvené AK jsou dobrým energetickým zdrojem pro jaterní buňky a periferní tkáně a nejsou prekurzory falešných neurotransmiterů jako aromatické AK. Toto složení aminoroztoků pozitivně ovlivňuje dusíkovou a energetickou bilanci a omezuje vývoj jaterní encefalopatie. Parenterální výživu podáváme formou vaků All in one (AIO) s použitím maximálně koncentrovaných roztoků pro omezenou zátěž tekutinami. Příjem sodíku omezujeme na 50-70 mmol/den, draslík hradíme dle plazmatických koncentrací a odpadů do moči. Důležitá je dostatečná substituce fosforu za monitorace jeho aktuální plazmatické hladiny. Využitelné zásoby bývají u malnutričních cirhotiků významně sníženy a při realimentaci bez adekvátního hrazení fosfátů může dojít k rozvoji refeeding syndromu - svalová slabost, křeče, zmatenost, respirační a oběhové selhání. Samozřejmou součástí je dodávka stopových prvků a vitaminů se zvýšeným přívodem vitaminů skupiny B (zejména vitaminu Bia B6) a zinku. Akutní nedostatek tiaminu po zahájení PV se může projevit jako nekorigovatelná laktátová acidóza, která má mnohdy fatální důsledky (Shoshin beri-beri). Uvedené komplikace jsou u EV výjimečné, vzhledem k pomalému zvyšování dávky EV při jejím zahájení. Parenterální substituce vitaminu K za sledování hodnoty protrombinového času odliší snížení jaterní funkce od jeho deficitu. Monitorace iontogramu, hladiny fosforu, odpadů iontů a dusíku do moči, koncentrace triglyceridů, glykemického profilu, acidobáze a úprava složení roztoků PV dle aktuální metabolické situace je nedílnou součástí provádění PV u pacientů s dekompenzovanou jaterní cirhózou. Podání 300-500 kcal ve formě polymerního enterálního přípravku může pozitivně ovlivnit střevní bariéru, zajistit výživu enterocytů a omezit negativní vliv PV na jaterní funkci.
ZÁVĚR
U pacientů s jaterní cirhózou se setkáváme se specifickou malnutricí, jejíž incidence roste v závislosti na tíži jaterního poškození. K jejímu odhalení se osvědčila jednoduchá antropometrická měření - obvod paže a kožní řasa nad tricepsem, a od nich odvozené parametry - obvod svalů paže a plocha svalů paže. Hodnocení síly stisku ruky se zdá být nejcitlivějším ukazatelem deplece svalové tkáně. S negativní prognózou choroby koreluje nejtěsněji deficit svalové tkáně odhalený u lehčích forem jaterní cirhózy V konečné fázi jaterní cirhózy již malnutrice nemá vliv na délku přežití pacientů. Ke komplexní a racionální péči o pacienty s jaterní cirhózou patří vyšetření jednoduchých antropometrických parametrů v časných fázích jaterní cirhózy. V případě diagnostiky malnutrice může jednoduchá nutriční intervence (úprava jídelníčku, sipping) prognózu nemocných.
LITERATURA
- 1. Davidson HIM, Richardson R, Sutherland D, et al. Macronutrient preference, dietary intake and substrate oxidation among stable cirrhotic patients. Hepatology 1999; 29: 1380-1386.
- 2. Riggio O, Angeloni S, Ciuffa L, et al. Malnutrition is not related to alterations in energy balance in patients with stable liver cirrhosis. Clinical Nutrition 2003; 22: 553-559.
- 3. Plauth M, Cabre E, Riggio O, et al. ESPEN Guidelines on enteral nutrition: Liver disease. Clinical Nutrition 2006; 25: 285-294.
- 4. Plauth M, Merli M, Kondrup J, et al. Espen guidelines for nutrition in liver disease and transplantation. Clinical Nutrition 1997; 16: 43-55.
- 5. Lin SY, Wang YY, Shen WH. Increased serum leptin concentrations correlate with soluble tumour necrosis factor receptor levels in patients with cirrhosis. Clin Endocrinol 2002; 57: 805-811.
- 6. Navrátilová M, Čéšková E, Sobotka L. á výživa v psychiatrii. Praha: Maxdorf 2000; s. 54-55.
- 7. Del Puppo M, Kienle MG, Petroni ML, et al. Serum 27-hydroxycholesterol in patients with primary biliary cirrhosis suggests alteration of cholesterol catabolism to bile acids via the acidic pathway. J Lipid Res 1998; 12: 2477-2482.
- 8. Crosignani A, Delpuppo M, Longo M, et al. Changes in classic and alternative pathways of bile acid synthesis in chronic liver disease. Clin Chim Acta 2007; 382: 82-88.
- 9. Jacobs DL, Lof J, Quigley EM. The effect of mesenteric venous hypertension on gut motility and absorption. J Surg Res 1990; 48: 562-567.
- 10. Sarfeh IJ, Aaronson S, Lombino D, et al. Selective impairment of nutrient absorption from intestines with chronic venous hypertension. Surgery 1986; 99: 166-169.
- 11. Pirlich M, Norman K, Lochs H, et al. Role of intestinal function in cachexia. Curr Opin Clin Nutr Metab Care 2006; 9: 603-606.
- 12. Feld JJ, Meddings J, Heathcote EJ. Abnormal intestinal permeability in primary biliary cirrhosis. Dig Dis Sci2006;51: 1607-1613.
- 13. Hashimoto N, Ohyanagi H. Effect of acute portal hypertension on gut mucosa. Hepatogastroenterolo-gy 2002; 49: 1567-1570.
- 14. Garcia-Tsao G, Albillos A, Barden GE. Bacterial translocation in acute and chronic portal hypertension. Hepatology 1994; 20: 264-266.
- 15. Guarner C, Soriano G. Bacterial translocation and its consequences in patients with cirrhosis. Eur J Gastroenterol Hepatol 2005; 17: 45-51.
- 16. Holeček M. metabolizmu cukrů, tuků, bílkovin a aminokyselin. Praha: Grada 2006; 251-253.
- 17. Donaghy A. Issues of malnutrition and bone disease in patients with cirrhosis. Journal of Gastroenterolo-gy and Hepatology 2002; 17: 462-466.
- 18. Alberino F, Gatta A, Amodio P, et al. Nutrition and survival in patients with liver cirrhosis. Nutrition 2001; 17: 445-450.
- 19. Italian multicentre cooperative project on nutrition in liver cirrhosis. Nutritional status in cirrhosis. Journal of Hepatology 1994; 21: 317-325.
- 20. Angela M, Morgan M, Morgan MY. Resting energy expenditure should be measured in patients with cirrhosis, not predicted. Hepatology 1999; 30: 655-664.
- 21. Scolapio JS, Bowen J, Stoner G. Substrate oxidation in patients with cirrhosis: comparison with other nutritional markers. Journal of Parent and Enteral Nutrition 2000; 24: 150-153.
- 22. Gunsar F, Raimondo ML, Jones S, et al. Nutritional status and prognosis in cirrhotic patients. Aliment Pharmacol Ther 2006; 24: 563-572.
- 23. Alvares-da-Silva MR, da Silveira TR. Comparison between handgrip strength, subjective global assesment and prognostic nutritional index in assessing malnutrition and predicting clinical outcome in cirrhotic out patients. Nutrition 2005; 21: 113-117.
- 24. Piquet MA, Ollivier I, Gloro R, et al. Nutritional indices in cirrhotic patients. Nutrition 2006; 22: 216-217.
- 25. Heymsfield SB, McManus C, Smith J, et al. Anthropometric measurement of muscle mass:revised equations for calculating bone-free arm muscle area. Am J Clin Nutr 1982; 36: 680-690.
- 26. Dastych M, Senkyřík M, Lata J, Husová L. ý energetický výdej a základní antropometrické měření u pacientů s jaterní cirhózou Child -C. Čes a Slov Gastroent a Hepatol 2007; Suppl: 61.
- 27. Merli M, Riggio O, Dally L. Does malnutrition affect survival in cirrhosis? Hepatology 1996; 23: 1041-1046.
- 28. Figueiredo F, Dickson ER, Pasha T, et al. Impact of nutritional status on outcomes after liver transplantation. Transplantation 2000; 70: 1347-1352.
- 29. Lata J, Husová L, Juránková J, et al. Factors participating in the developement and mortality of variceal bleeding in portal hypertension - possible effects of the kidney damage and malnutrition. Hepato-gastroenterology ; 53: 416-421.
- 30. Sobotka L, et al. Basics in clinical nutrition. Third Edition. : Galén 2004; 321-325.
- 31. Schulz T, Bechstein WO, Neuhas P, et al. Clinical practice of nutrition in acute liver failure - a European survey. Clinical Nutrition 2004; 23: 975-982.
- 32. Wilhelm Z, et al. ýživa v onkologii. Brno: Národní centrum šetřovatelství a nelékařských zdravotnických oborů 2004; 58.
Práce byla podpořena grantem Interní grantové agentury MZ ČR NR 9084-3.
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené