Malabsorpce žlučových kyselin u onkologických pacientů
Darina Kohoutová1,2, David Zogala3, Jiří Doležal Orcid.org 4, Otto Lang5,6, Jan Bureš1,7,8
+ Pracoviště
Souhrn
Malabsorpce žlučových kyselin (BAM – bile acid malabsorption) je výsledkem dysregulace enterohepatálního oběhu žlučových kyselin a jejich syntézy v játrech. Prevalence BAM je odhadována na 1 % všeobecné dospělé populace, patří mezi nejvíce opomíjené diagnózy. U osob splňujících diagnostická kritéria dráždivého tračníku se primární BAM vyskytuje u třetiny nemocných. U Crohnovy choroby s terminální ileitidou nebo po resekci terminálního ilea je BAM přítomna u 50–100 % pacientů. U onkologických pacientů s anamnézou radioterapie v oblasti pánve postihuje až polovinu nemocných. Zlatým standardem diagnostiky je SeHCAT test (75Selenium HomoCholic Acid Taurine test), nyní nově dostupný také v České republice. Hlavním dietním opatřením je omezení tuků v potravě. Základem farmakoterapie je podání sekvestrantů žlučových kyselin (v České republice je dostupný cholestyramin).
Klíčová slova
malabsorpce žlučových kyselin, SeHCAT test, cholestyramin
Úvod
Malabsorpce žlučových kyselin byla poprvé popsána v roce 1967 jako choleretická enteropatie [1]. V současné době je možno v databázi PubMed nalézt na toto téma více než 1 300 publikací, přesto malabsorpce žlučových kyselin patří mezi nejvíce opomíjené diagnózy. Tato práce přináší stručný přehled současných poznatků. Upozorňuje také na zvláštnosti tohoto syndromu u onkologických nemocných.
Fyziologie žlučových kyselin
Žlučové kyseliny jsou syntetizovány z cholesterolu v játrech (detailní review Camilleri et al [2], Marasco et al [3]). Klasická cesta zodpovědná za syntézu cca 75–90 % žlučových kyselin je zprostředkována 17 enzymy, přičemž enzymem limitujícím rychlost syntézy je cholesterol 7-α-hydroxyláza (CYP7A1). Kromě klasické cesty existuje cesta alternativní [4]. Výsledkem syntézy jsou primární žlučové kyseliny, cholová a chenodeoxycholová, které jsou konjugovány s glycinem a taurinem. Konjugované primární žlučové kyseliny jsou vylučovány do žluči a skladovány ve žlučníku. Po příjmu tuku potravou dochází k vyloučení žluče do duodena, a to pod vlivem cholecystokininu. Žlučové kyseliny mají rozhodující roli v trávení a vstřebávání tuků z potravy (mastných kyselin a monoglyceridů uvolněných po lipolýze triacylglycerolů ve střevě), ale také vitaminů rozpustných v tucích (A, D, E, K). Role žlučových kyselin však není omezená jen na metabolizmus tuků; slouží také jako signální molekuly a účastní se modulace proliferace epiteliálních buněk. Dále aktivují nukleární receptory (zejména receptor pro farnesoid X) a spolu s inzulinem regulují lipidový a glukózový metabolizmus v játrech [2–4].
Více než 95 % žlučových kyselin je aktivně vstřebáno v ileu pomocí ASBT receptoru (apical sodium dependent bile acid transporter) a enterohepatální cirkulací, portální krví, se vrací do jater (obr. 1, 2) [4].
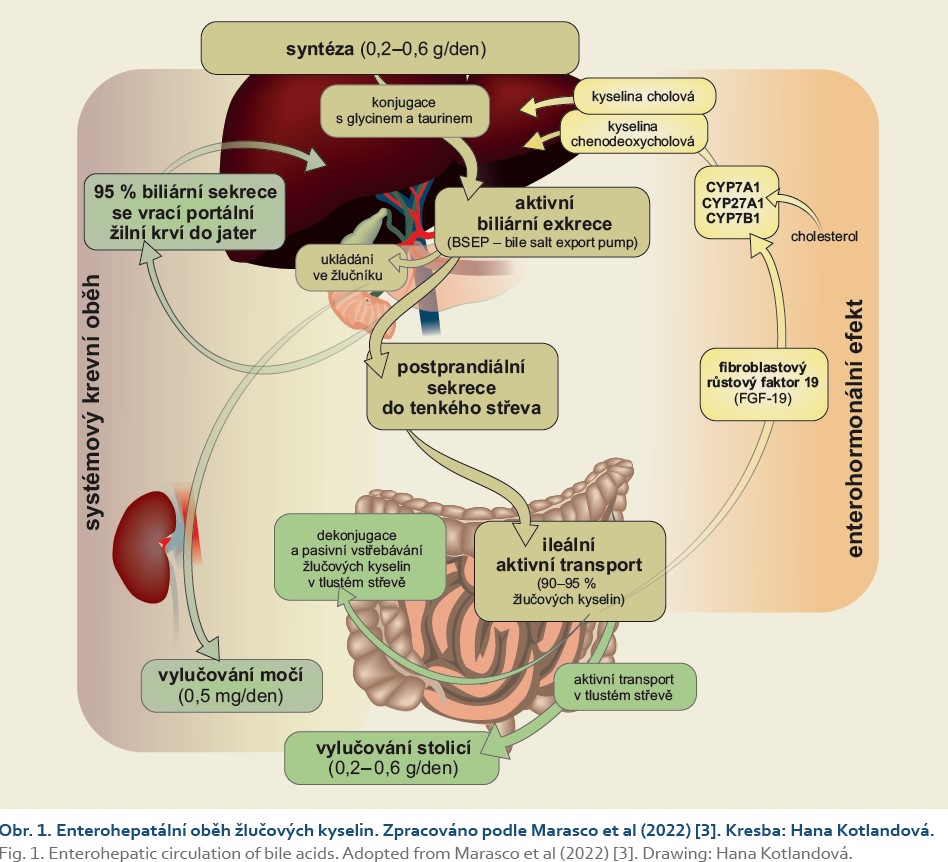

Pool žlučových kyselin v organizmu dospělého člověka je 2–6 g, denní syntéza 0,2–0,6 g. Enterohepatální cirkulací projde za 24 hod celý objem žlučových kyselin 4–12krát [3]. Rychlost syntézy žlučových kyselin je kontrolována negativní zpětnou vazbou FXR (farnesoidový receptor X) a FGF-19 (fibroblastový růstový faktor 19) [4]. Nepřímým markerem této biochemické syntézy je její meziprodukt 7α-hydroxy-4-cholesten-3-one (C4) [5,6]. Primární žlučové kyseliny jsou účinkem intestinálních mikrobiot dekonjugovány a posléze dehydroxylovány za vzniku sekundárních žlučových kyselin, mezi které patří především kyselina deoxycholová a litocholová [4].
Etiopatogeneze malabsorpce žlučových kyselin
Malabsorpce žlučových kyselin je výsledkem dysregulace enterohepatálního oběhu žlučových kyselin a jejich syntézy v játrech. Detailní přehled problematiky je k dispozici v několika recentních publikacích [3,7]. Při malabsorpci nejsou žlučové kyseliny dostatečně vstřebány v ileu, vstoupí do tlustého střeva a jsou příčinou chronického průjmu. Působí několika základními mechanizmy: zvýšenou sekrecí elektrolytů/vody, zvýšenou permeabilitou sliznice tlustého střeva, zvýšenou motilitou tlustého střeva a zvýšenou produkcí hlenu (obr. 3) [4].
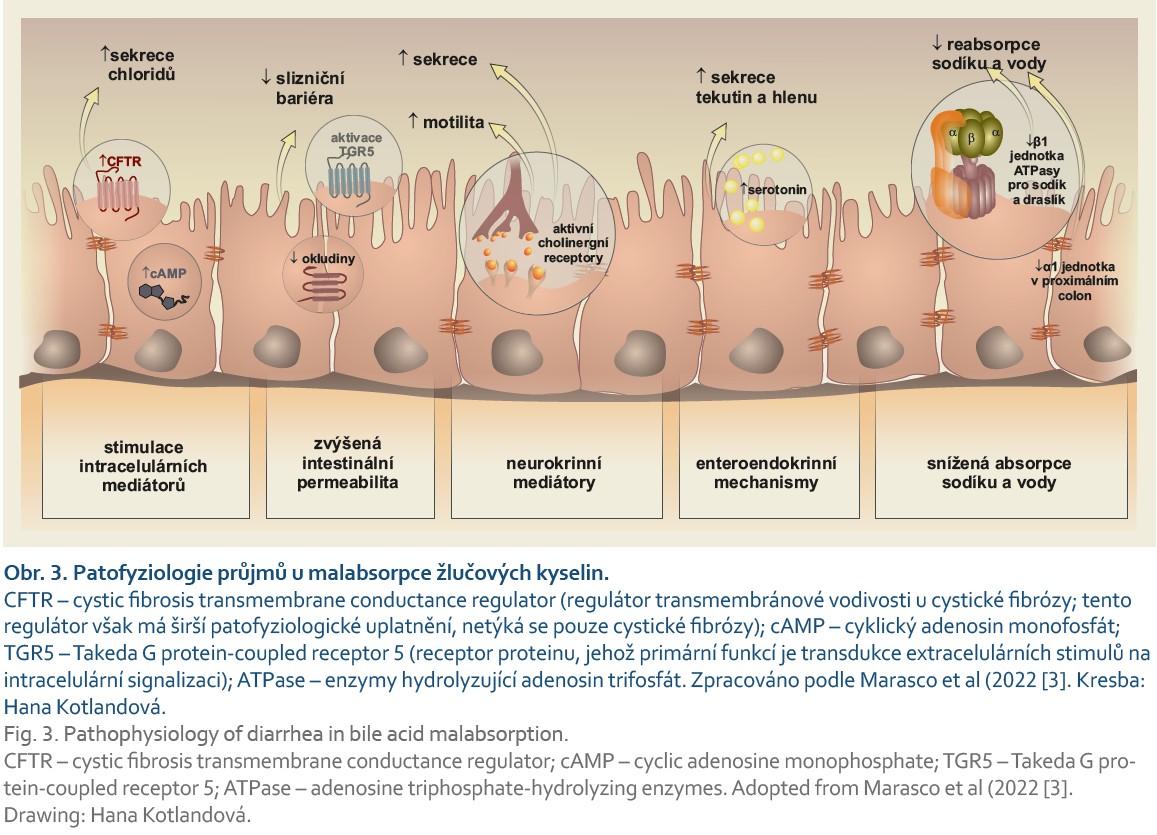
Klíčovou roli hrají střevní bakterie. Jsou hlavním regulátorem objemu a složení žlučových kyselin v organizmu. Interakce je oboustranná, žlučové kyseliny ovlivňují složení bakterií a jejich alfa- a beta-diverzitu [9,10]. Jsou také zodpovědné za transformaci primárních konjugovaných žlučových kyselin na sekundární [3,11,12].
Malabsorpci žlučových kyselin mohou indukovat některé léky, například lenalidomid používaný k terapii mnohočetného myelomu [13].
Klasifikace
Klasifikace malabsorpce žlučových kyselin je založena na příčinách, které k tomuto stavu vedou. V současné době se rozeznávají čtyři základní typy [14].
Typ 1
Tento typ zahrnuje stavy spojené s dysfunkcí ilea. Patří sem např. Crohnova choroba s ileitidou, stavy po resekci terminálního ilea, postiradiační ileitida, tuberkulóza nebo imunopatologické stavy postihující tenké střevo (např. AIDS, systémové choroby pojiva) [2,15,16].
Typ 2
Jako typ 2 se označuje primární („idiopatická“) malabsorpce žlučových kyselin. Zahrnuje chronické průjmy bez jasného organického gastroenterologického onemocnění a patří sem podstatná část pacientů s dráždivým tračníkem (zejména „postinfekčním“) [2,3,15,16]. Příčinou je nadprodukce žlučových kyselin při narušené negativní zpětné vazbě zprostředkovávané FGF-19 [2,3].
Typ 3
Pod typ 3 se řadí heterogenní skupina gastroenterologických chorob, které jsou způsobeny patologií lokalizovanou primárně mimo ileum. Patří sem například pankreatobiliární onemocnění, celiakie, mikroskopická kolitida, stavy po cholecystektomii a postvagotomické průjmy [2,3,15,16]. Nověji je do této skupiny zařazován také Habbaův syndrom (dysmotilitní porucha žlučníku s postprandiálními průjmy příznivě reagujícími na léčbu sekvestranty) [17]. Přesné mechanizmy zodpovědné za malabsorpci žlučových kyselin nejsou ve většině případů typu 3 objasněné [3].
Typ 4
Tato skupina je nově vyčleněna (dříve byla řazena pod typ 3). Do této skupiny patří stavy excesivní nadprodukce žlučových kyselin bez jasných známek jejich porušené střevní reabsorpce. Příkladem jsou non-alkoholová steatohepatitida s průjmy, významná hypertriacylglycerolemie s obezitou (a s deplecí HDL-cholesterolu) nebo léčba metforminem (průjmy až u 20 % pacientů) [2,3,18].
Prevalence malabsorpce žlučových kyselin
Prevalence primární malabsorpce žlučových kyselin je odhadována na 1 % všeobecné dospělé populace [15,19,20]. U osob splňujících diagnostická kritéria dráždivého tračníku se primární malabsorpce žlučových kyselin vyskytuje u čtvrtiny až poloviny nemocných [3,19,21–23]. U Crohnovy choroby s terminální ileitidou nebo po resekci terminálního ilea je malabsorpce žlučových kyselin přítomna u 50–100 % pacientů, z toho až v 94 % těžkého stupně [6,19,24–27].
Největší zkušenost s diagnostikou a léčbou malabsorpce žlučových kyselin u onkologických nemocných je ve Velké Británii, kde je SeHCAT scan (zlatý standard diagnostiky; viz níže) k dispozici déle než 30 let [15,28–33]. Dobře je doložena především u onkologických pacientů s chemo- a/nebo radioterapií, kdy postihuje až polovinu nemocných [34]. Širší zkušenosti s malabsorpcí žlučových kyselin komplikující systémovou protinádorovou imunoterapii dosud chybí, lze ji předpokládat především u komplikující enterokolitidy [35]. Malabsorpce žlučových kyselin je velmi častá u neuroendokrinních tumorů s průjmy. Tuto možnost je třeba v diferenciální diagnostice vždy zvažovat [36–38]. Podle jedné ze studií byla zjištěna u 92 % (48/52) nemocných [39]. Malabsorpce žlučových kyselin byla popsána i u nádorů mimo gastrointestinální trakt, např. u karcinomu prsu nebo u hematologických malignit [29].
Na pracovišti autorky tohoto příspěvku v Royal Marsden Hospital bylo pro podezření na malabsorpci žlučových kyselin v průběhu 6měsíčního období vyšetřeno 265 onkologických pacientů, z nichž diagnóza byla potvrzena u 87 (33 %) [34]. Nejčastěji byli postiženi nemocní s gynekologickými a hematologickými malignitami. Deficit vitaminu D byl zjištěn u 62/87 (71 %) osob, deficit vitaminu B12 u 39/87 (45 %) pacientů. Léčba byla úspěšná u téměř 90 % nemocných [34, 40].
V britské prospektivní studii FOCCUS (Focussing on Cancer Chemotherapy‘s Undiagnosed Symptoms) [33] bylo v období 2014–2017 zařazeno 241 onkologických pacientů. Po jednom roce sledování bylo k finálnímu hodnocení k dispozici pouze 119 nemocných. Častými obtížemi byly nepřiměřená únava (40 %), průjmy (30 %), inkontinence (> 20 %) a různé dyspeptické symptomy (> 10 %). Překvapivě velká část nemocných, i přes výrazné obtíže, odmítala doporučená vyšetření. Například pouze 30 osob podstoupilo neinvazivní SeHCAT test (pozitivní u 13/30; 43 %) a 39 pacientů dechový test bakteriálního přerůstání v tenkém střevě (pozitivní u 21/39; 54 %). Po 12 měsících terapie výrazné obtíže přetrvávaly u 15 % nemocných. Autoři upozorňují, že mezinárodní kritéria pro hodnocení nežádoucích vedlejších účinků onkologické léčby (Common Terminology Criteria for Adverse Events) výrazně podhodnocují gastrointestinální obtíže spojené s onkologickou léčbou [33].
Klinický obraz
Pacienti trpí frekventními vodnatými průjmy (v 80–100 % případů), defekačními imperativy – urgencemi (~ 90 %), občasnou inkontinencí (~ 80 %), bolestmi břicha (~ 75 %) a dyspeptickými obtížemi (nevolnost, nadýmání, borgorygmy). Mezi vedoucí příznaky zpravidla nepatří hubnutí. Další obtíže tvoří nepřiměřená celodenní únava (~ 40 %), závratě, nemocní se cítí malátní (s pocity na omdlení, „mozek jakoby v mlze“). Obtíže nepříznivě ovlivňují běžné denní aktivity a sociálně-společenský život, mají negativní dopad na práceschopnost a kvalitu života pacientů (viz níže) [2–4].
Diagnostika
SeHCAT test
Zlatým standardem diagnostiky je metoda nukleární medicíny – SeHCAT test (75Selenium HomoCholic Acid Taurine Test). Poprvé byl proveden již v roce 1981 [41]. Je velmi dobře tolerován, je jednoduchý, neinvazivní a představuje minimální radiační zátěž (370 kBq, tj. 10 μCi; poločas přeměny izotopu 75selenu je 120 dní) [42–44]. Praktický postup je následující: pacientovi je v kapsli perorálně podána syntetická žlučová kyselina konjugovaná s taurinem (23-seleno-25-homo-taurocholová kyselina), označená radioaktivním selenem (75Se). První scan je proveden 3 hod po podání kapsle, druhý scan za 1 týden v identické poloze na zádech. Výsledek je vyjádřen jako kalkulace retence SeHCAT v procentech. Normální hodnota je > 20 %. Jako mírná malabsorpce žlučových kyselin je označována retence 10–15 %, jako střední pak retence 5–10 % a za těžkou malabsorpci je pokládána retence radiofarmaka < 5 %. Test vyžaduje vyřazení antidiaroických medikamentů (pokud by je pacient užíval) těsně před prováděním a během provádění testu [4,42,43]. Senzitivita testu je > 80 %, specificita > 98 % [7,37,45]. Nízká retence radiofarmaka (< 10 %) koreluje s urychleným tranzitním časem tlustým střevem [46].
Potrava bohatá na taurin (např. „plody moře“), s vysokým obsahem tuků nebo s nízkým obsahem vlákniny zvyšuje množství žlučových kyselin konjugovaných s taurinem [7]. Roli hrají také léky, systémové glukokortikoidy „upregulují“ ASBT (apical sodium dependent bile acid transporter) [47]. Cholestyramin preferenčně redukuje dihydroxy-žlučové kyseliny (chenodeoxycholová a deoxycholová kyselina) a snižuje pool sekundárních žlučových kyselin [48].
7α-hydroxy-4-cholesten-3-one
Vysoké sérové koncentrace 7α-hydroxy-4-cholesten-3-one (> 50 µg/l) jsou diagnostické pro malabsorpci žlučových kyselin [25,43,45]. Stanovení se provádí vysokoúčinnou kapalinovou chromatografií (HPLC), metoda je náročná přístrojově i požadavkem vysoce kvalifikovaného personálu. Senzitivita testu je 85–90 %, specificita 71–79 % [45,49]. Negativní prediktivní hodnota je až 98 % [43]. Interpretace výsledků musí být opatrné u cholestatických chorob jater, výrazné hypertriacylglycerolemie nebo při léčbě statiny a také u osob s alterovaným cirkadiálním rytmem (směnný pracovní provoz, jet lag) [43,45]. Obtížná interpretace může být také u osob se zácpou v důsledku pomalého tranzitního času tlustým střevem [43].
Vysoké sérové koncentrace C4 korelují s nízkými hodnotami retence SeHCAT [50] a negativně korelují s FGF-19 (fibroblast growth factor 19) [25]. Sérové koncentrace C4 kolísají v průběhu dne, v závislosti na diurnálním rytmu syntézy žlučových kyselin [51].
Ostatní diagnostické testy
Sérové koncentrace FGF-19 se běžně nestanovují, přestože jsou k dispozici komerční soupravy ELISA. Vyšetření je třeba provést v ranních hodinách nalačno. Senzitivita a specificita stanovení jsou 64 a 72 % [45].
V minulosti byly vyšetřovány postprandiální vzestupy sérových koncentrací kyseliny cholové (ukazatel dysfunkce ilea) a chenodeoxycholové (porucha absorpční funkce tlustého střeva) [52]. Metoda se v běžné klinické praxi neujala. Schillingův test (cyanokobalamin značený 58kobaltem) se v současné době již neprovádí [53]. Dechové testy (13C-glykocholová kyselina; 13C-cholylglycin) mají vysokou diagnostickou přesnost, nejsou však běžně dostupné [43,54,55].
Stanovení koncentrace žlučových kyselin ve 48hodinovém sběru stolice (po předchozí 4denní dietě se 100 g tuků denně) se pro svoji náročnost dnes již neprovádí. Udávaná senzitivita byla 55 %, specificita 74 % [2].
Terapeutický test
Současná guidelines Britské gastroenterologické společnosti a Kanadské gastroenterologické společnosti nedoporučují provádět terapeutický test se sekvestranty bez náležitého stanovení diagnózy malabsorpce žlučových kyselin [56,57]. V minulosti se terapeutický test běžně prováděl (při nedostupnosti SeHCAT testu) [2].
Diferenciální diagnostika
Diferenciální diagnostika malabsorpce žlučových kyselin zahrnuje širokou oblast malasimilačních stavů s průjmy (maldigesce, malabsorpce, malnutrice, poruchy sekrece a motility) [4]. Obtížné může být odlišení syndromu bakteriálního přerůstání v tenkém střevě (SIBO) [58].
Z patofyziologického hlediska patří malabsorpce žlučových kyselin mezi chronické průjmy především sekrečního typu. Dalšími příčinami sekrečních průjmů jsou toxiny (např. ETEC – enterotoxigenní Escherichia coli; mediované cAMP), infekce (např. rotaviry), některé hormony (kalcitonin), serotonin (léky indukovaný serotoninový syndrom; karcinoidový syndrom u neuroendokrinních nádorů), řada léků (např. adefovir, ceftizoxim, furosemid, olsesartan, metotrexát a mnoho dalších), prostaglandin E1 (a jeho analog misoprostol) nebo některé peptidy (VIP – vazointestinální polypeptid). Stanovení sodíku ve stolici (> 90 mmol/l; nízký osmotický gap < 50 mOsm) k potvrzení sekrečního průjmu se v běžné praxi neprovádí. Diferenciálně diagnostickým vodítkem může být skutečnost, že sekreční průjem přetrvává zpravidla i při lačnění [4,59–61].
U onkologických pacientů je třeba v diferenciální diagnostice vyloučit jiné příčiny průjmů vzniklých v časové souvislosti s onkologickou terapií. Jsou to především infekce (Clostridioides difficile, cytomegalovirus), přímý toxický efekt onkologické léčby na střevo (např. fluorouracil), chemoterapií indukovaný deficit laktázy (fluorouracil, cetuximab), ischemická kolitida (docetaxel), imunopatologické stavy (protinádorová imunoterapie tzv. check-point inhibitory), dysbióza střevních bakterií (ipilimumab) nebo dosud latentní benigní gastrointestinální onemocnění v pozadí (celiakie, idiopatický střevní zánět) [35,62].
Je třeba zdůraznit, že v řadě případů je příčina průjmů u onkologických nemocných multifaktoriální. Například při léčbě irinotekanem se na průjmech podílejí malabsorpce žlučových kyselin (více v časné než v pozdní fázi), přímý toxický efekt na sliznici tenkého střeva, sekreční komponenty a dysmotilitní poruchy [63]. Při léčbě inhibitory tyrosinkinázy (imatinib) se na průjmech kromě malabsorpce žlučových kyselin uplatňují zvýšená sekrece chloridů do střeva (dysregulace EGFR – receptoru pro epidermální růstový faktor), poškození krypt sliznice tlustého střeva, dysmotilita a dysbióza střeva [62].
Principy léčby malabsorpce žlučových kyselin
Dietní opatření
Hlavním dietním opatřením je omezení tuků v potravě, a to < 20 % denního energetického příjmu [4]. Tato dietní intervence v horizontu 4–12 týdnů výrazně zlepší především bolesti břicha, urgence, inkontinenci a noční průjmy. V menší míře zlepšuje také další dyspeptické obtíže (plynatost, nevolnost, zvracení) [30].
Sekvestranty
Základem farmakoterapie je podání sekvestrantů žlučových kyselin [64]. Perorálně podaný cholestyramin, nejvíce rozšířený sekvestrant, váže žlučové kyseliny, a brání tak jejich efektu v tlustém střevě. V praxi je důležité podávat cholestyramin odděleně od dalších léčiv, neboť může způsobit jejich nedostatečné vstřebávání (např. statiny, sartany, propranolol, levotyroxin, furosemid, glypizid, perorální kontraceptiva aj.). Dalším důležitým doporučením je dávku cholestyraminu zvyšovat postupně (až na cílových 12–16 g denně) a sledovat toleranci tohoto léčiva [4]. Nežádoucím účinkem může být zácpa (~ 10 %), pyróza, nechutenství, nevolnost, zvracení, abdominální křeče/nadýmání a bolesti hlavy (1–10 %). Nezanedbatelné je riziko navození deficitů vitaminů rozpustných v tucích, kdy například nedostatek vitaminu D může v krajním případě vyústit v metabolickou kostní nemoc. Cholestyramin může způsobit hyperchloremickou metabolickou acidózu [3]. V průběhu léčby cholestyraminem je třeba kontrolovat jaterní testy a sérové koncentrace triacylglycerolů. Ve Velké Británii a některých dalších státech je možné místo cholestyraminu podat cholesevelam nebo cholestipol (rovněž sekvestranty žlučových kyselin), které jsou lépe tolerovány [4]. V České republice tyto další léky dostupné dosud nejsou.
Symptomatická terapie
Symptomatická léčba zahrnuje především loperamid (v denní dávce 2–16 mg per os), spazmoanalgetika (mebeverin) a hydroxid hlinitý [4,64]. Přínosné může být podání selektivních inhibitorů zpětného vychytávání serotoninu (SSRI, např. sertralin nebo escilopram). Vhodným doplňkem terapie jsou prebiotika (v této indikaci např. sterculia) [34,65].
Substituce vitaminů a mikronutrientů
Léčba sekvestranty žlučových kyselin interferuje s absorpcí vitaminů rozpustných v tucích, vitaminu A, D, E, K. V klinické praxi je tedy obzvlášť nutné kontrolovat sérové hodnoty vitaminu D a ten řádně perorálně suplementovat. Dále je vhodné kontrolovat protrombinový čas (vitamin K) a sérové koncentrace vitaminů A a E. Vitamin B12 se vstřebává v terminálním ileu, proto je jeho deficit často pozorován u primární malabsorpce žlučových kyselin. Může být vyjádřena symptomatická megaloblastová makrocytární anemie, případně i s psychiatrickými nebo neurologickými projevy tohoto deficitu (postižení zadních a postranních míšních pletenců, ataxie, porucha kognitivních funkcí až demence, atrofie n. opticus). U těchto pacientů je třeba vitamin B12 podávat parenterálně, neboť perorálně podaný vitamin B12 by se nevstřebal. Z mikronutrientů je třeba suplementovat především vápník, hořčík a zinek [4,34].
Agonisté farnesoidového receptoru X
Agonisté farnesoidového receptoru X (FXR) zvyšují sérový FGF-19, snižují 7α-hydroxy-4-cholesten-3-one (C4) v séru a snižují žlučové kyseliny ve stolici [2,64,66]. V krátkodobé klinické studii kyselina obeticholová, agonista farnesoidového receptoru X, snižovala syntézu žlučových kyselin a příznivě ovlivňovala choleretické průjmy [28].
Nové možnosti studiové farmakoterapie
V léčbě je nově zkoušen liraglutid, agonista receptoru GLP-1 (glucagon-like peptide-1) [67–69]. Staronovou kandidátní molekulou by mohl být cholylsarkosin (syntetický N-acyl konjugát kyseliny cholové s N-metylglycinem; rezistentní vůči dekonjugaci ve střevě) [70].
Léčba syndromu bakteriálního přerůstání v tenkém střevě
Terapii malabsorpce žlučových kyselin je třeba mnohdy doplnit o léčbu koincidujícího syndromu bakteriálního přerůstání v tenkém střevě (až v 85 % případů) a/nebo exokrinní pankreatické insuficience (až u jedné třetiny nemocných) [30,71].
Význam mezioborové spolupráce
V diagnostice a léčbě pacientů s malabsorpcí žlučových kyselin je zásadně důležitá mezioborová spolupráce, nejlépe pokud je řízena multidisciplinárním týmem (MDT – multidisciplinary team). Pro diagnostiku je klíčová role nukleární medicíny a klinické biochemie. Terapii zpravidla řídí gastroenterolog/internista ve spolupráci s onkology, chirurgy a farmakology. Velmi důležité je zapojení dietního specialisty. V některých případech je nezbytná pomoc psychologa nebo psychiatra.
Kvalita života pacientů
Malabsorpce žlučových kyselin výrazně zhoršuje kvalitu života nemocných [4,72]. V jedné ze studií autoři porovnávali kvalitu života dvou skupin pacientů s dráždivým tračníkem, a to se současnou malabsorpcí a bez malabsorpce žlučových kyselin [73]. Nemocní se současnou malabsorpcí měli signifikantně vyšší frekvenci stolic a intenzitu urgencí, ale i vyšší skóre psychických depresí (> 8 dle Hospital Anxiety and Depression Scale) [73]. U pacientek po léčbě gynekologických malignit (analýza 220 osob v 3letém období) úspěšná terapie malabsorpce žlučových kyselin signifikantně zlepšila kvalitu života [72]. Podle jiné, dánské studie (377 neonkologických pacientů) trvaly průjmy i přes léčbu u dvou třetin osob (s trvalou nutností užívání antidiarhoik) a zhoršená kvalita života přetrvávala u poloviny nemocných [74].
Prognóza
U onkologických pacientů je prognóza malabsorpce žlučových kyselin dána především základním onemocněním a nutností další protinádorové terapie. Při správně stanovené diagnóze malabsorpce žlučových kyselin je její léčba úspěšná až u tří čtvrtin nemocných [30,34,40,44]. Zásadně důležitá je compliance správně edukovaných a motivovaných pacientů. Prognózu pochopitelně nepříznivě ovlivňuje nemožnost pokračovat v terapii sekvestranty pro jejich intoleranci. Bez léčby je stav zpravidla stacionární, méně často dojde ke spontánní úpravě (např. u akutní reakce štěpu proti hostiteli po transplantaci progenitorových krvetvorných buněk). Prognóza malabsorpce žlučových kyselin může být nepříznivě ovlivněna také komplikacemi (metabolická kostní nemoc, deficit vitaminů A a B12) [4].
Analýza nákladů a ekonomického přínosu
Malabsorpce žlučových kyselin patří mezi nejvíce poddiagnostikované stavy v gastroenterologii vůbec. U > 40 % pacientů se symptomatickou malabsorpcí žlučových kyselin je časová prodleva do správného stanovení diagnózy 5 a více let [15,75]. Včasná diagnóza malabsorpce žlučových kyselin je z hlediska finančních nákladů vysoce efektivní. V jedné ze studií ve Velké Británii autoři porovnávali skupiny pacientů s chronickými vodnatými průjmy s časným provedením SeHCAT scanu (jako prvního vyšetření) a s odloženým vyšetřením (v průměru o 30 měsíců od vzniku obtíží). Včasná diagnostika malabsorpce žlučových kyselin sníží náklady na zdravotní péči jednoho pacienta o 750 GBP za rok, celkově pak v Británii o 13,5 mil. GBP ročně [15].
Dostupnost SeHCAT
SeHCAT se v současné době provádí v 19 evropských zemích a v Kanadě. Po téměř 2letém schvalovacím úsilí je SeHCAT nyní nově k dispozici také v České republice. Za podpory České společnosti nukleární medicíny, Společnosti pro gastrointestinální onkologii a České gastroenterologické společnosti byly postupně získány souhlasy Státního úřadu pro jadernou bezpečnost, Státního ústavu pro kontrolu léčiv (Seznam individuálně připravovaných léčivých přípravků, kód 0259481, ATC V09DX01) a schválení Ministerstvem zdravotnictví ČR (rozhodnutím č. j. MZDR 11123/2022-4/OLZP). Od 1. 7. 2022 je již SeHCAT uveden také v seznamu výkonů (kód výkonu 47187) a má stanovenou úhradu zdravotními pojišťovnami včetně úhrady za radiofarmakum. Prováděn může být jako specifický léčebný program.
Závěry
U onkologických nemocných s chronickými průjmy by měla být malabsorpce žlučových kyselin zvažována na prvním místě. Nejen u onkologických pacientů patří mezi nejvíce poddiagnostikované gastroenterologické poruchy, s velkou časovou prodlevou od vzniku obtíží do správné diagnózy a zahájení léčby. Příčiny jsou jak v nedostatečném povědomí odborné veřejnosti (lékař na tuto možnost nepomýšlí), tak v nedostupnosti potřebného vyšetření (SeHCAT). Současná komplexní terapie stav upraví v převážné většině případů. Příslibem do budoucnosti jsou léčebné postupy modulující střevní mikrobiota.
Další rozsáhlá literatura u autorů.
ORCID authors
D. Kohoutová ORCID 0000-0001-6937-309X,
D. Zogala ORCID 0000-0003-3372-1667,
J. Doležal ORCID 0000-0001-8870-9425,
O. Lang ORCID 0000-0002-2818-8792,
J. Bureš ORCID 0000-0003-0326-117X.
Doručeno/Submitted: 28. 8. 2022
Přijato/Accepted: 12. 9. 2022
prof. MUDr. Darina Kohoutová, Ph.D.
Centrum biomedicínského výzkumu
FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
Darina.Kohoutova@rhm.nhs.uk
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Hofmann AF. The syndrome of ileal disease and the broken enterohepatic circulation: cholerheic enteropathy. Gastroenterology 1967; 52(4): 752–757.
2. Camilleri M, Vijayvargiya P. The Role of Bile Acids in Chronic Diarrhea. Am J Gastroenterol 2020; 115(10): 1596–1603. doi: 10.14309/ajg.0000000000000696.
3. Marasco G, Cremon C, Barbaro MR et al. Pathophysiology and Clinical Management of Bile Acid Diarrhea. J Clin Med 2022; 11(11): 3102. doi: 10.3390/jcm11113102.
4. Kohoutová D. Malabsorpce žlučových kyselin. In: Zavoral M, Bureš J, Ryska M et al. Mařatkova gastroenterologie. Praha: Karolinum 2021; 1485–1489.
5. Bunnett NW. Neuro-humoral signalling by bile acids and the TGR5 receptor in the gastrointestinal tract. J Physiol 2014; 592(14): 2943–2950. doi: 10.1113/jphysiol.2014.271155.
6. Vítek L. Bile acid malabsorption in inflammatory bowel disease. Inflamm Bowel Dis 2015; 21(2): 476–483. doi: 10.1097/MIB.0000000000000193.
7. Barkun AN, Love J, Gould M et al. Bile acid malabsorption in chronic diarrhea: pathophysiology and treatment. Can J Gastroenterol 2013; 27(11): 653–659. doi: 10.1155/2013/485631.
8. Vanuytsel T, Tack J, Farre R. The Role of Intestinal Permeability in Gastrointestinal Disorders and Current Methods of Evaluation. Front Nutr 2021; 8: 717925. doi: 10.3389/fnut.2021.717925.
9. Jeffery IB, Das A, O‘Herlihy E et al. Differences in Fecal Microbiomes and Metabolomes of People With vs Without Irritable Bowel Syndrome and Bile Acid Malabsorption. Gastroenterology 2020; 158(4): 1016–1028.e8. doi: 10.1053/ j.gastro.2019.11.301.
10. Sagar NM, Duboc H, Kay GL et al. The pathophysiology of bile acid diarrhoea: differences in the colonic microbiome, metabolome and bile acids. Sci Rep 2020; 10(1): 20436. doi: 10.1038/s41598-020-77374-7.
11. Joyce SA, Gahan CGM. Bile Acid Modifications at the Microbe-Host Interface: Potential for Nutraceutical and Pharmaceutical Interventions in Host Health. Annu Rev Food Sci Technol 2016; 7: 313–333. doi: 10.1146/annu rev-food-041715-033159.
12. Singh J, Metrani R, Shivanagoudra SR et al. Review on Bile Acids: Effects of the Gut Microbiome, Interactions with Dietary Fiber, and Alterations in the Bioaccessibility of Bioactive Compounds. J Agric Food Chem 2019; 67(33): 9124–9138. doi: 10.1021/acs.jafc.8b07306.
13. Pawlyn C, Khan MS, Muls A et al. Lenalidomide-induced diarrhea in patients with myeloma is caused by bile acid malabsorption that responds to treatment. Blood 2014; 124(15): 2467–2468. doi: 10.1182/blood-2014-06-583302.
14. Walters JRF, Arasaradnam R, Andreyev HJN; UK Bile Acid Related Diarrhoea Network. Diagnosis and management of bile acid diarrhoea: a survey of UK expert opinion and practice. Frontline Gastroenterol 2019; 11(5): 358–363. doi: 10.1136/flgastro-2019-101301.
15. Fernandes DCR, Poon D, White LL et al. What is the cost of delayed diagnosis of bile acid malabsorption and bile acid diarrhoea? Frontline Gastroenterol 2019; 10(1): 72–76. doi: 10.1136/flgastro-2018-101011.
16. Farrugia A, Arasaradnam R. Bile acid diarrhoea: pathophysiology, diagnosis and management. Frontline Gastroenterol 2020; 12(6): 500–507. doi: 10.1136/flgastro-2020-101436.
17. Habba SF. Chronic diarrhea: identifying a new syndrome. Am J Gastroenterol 2000; 95(8): 2140–2141. doi: 10.1111/j.1572-0241.2000.02 219.x.
18. Appleby RN, Moghul I, Khan S et al. Non-alcoholic fatty liver disease is associated with dysregulated bile acid synthesis and diarrhea: A prospective observational study. PLoS One 2019; 14(1): e0211348. doi: 10.1371/journal.pone.0211348.
19. Camilleri M. Bile Acid diarrhea: prevalence, pathogenesis, and therapy. Gut Liver 2015; 9(3): 332–339. doi: 10.5009/gnl14397.
20. Kurien M, Thurgar E, Davies A et al. Challenging current views on bile acid diarrhoea and malabsorption. Frontline Gastroenterol 2018; 9(2): 92–97. doi: 10.1136/flgastro-2017-100808.
21. Wedlake L, A‘Hern R, Russell D et al. Systematic review: the prevalence of idiopathic bile acid malabsorption as diagnosed by SeHCAT scanning in patients with diarrhoea-predominant irritable bowel syndrome. Aliment Pharmacol Ther 2009; 30(7): 707–717. doi: 10.1111/j.1365-2036.2009.04081.x.
22. Slattery SA, Niaz O, Aziz Q et al. Systematic review with meta-analysis: the prevalence of bile acid malabsorption in the irritable bowel syndrome with diarrhoea. Aliment Pharmacol Ther 2015; 42(1): 3–11. doi: 10.1111/apt.13227.
23. Flores V, Martínez-Lozano H, Bighelli F et al. Prevalence of biliary acid malabsorption in patients with chronic diarrhoea of functional characteristics: a prospective study. BMC Gastroenterol 2021; 21(1): 56. doi: 10.1186/s12 876-021-01637-4.
24. Smith MJ, Cherian P, Raju GS et al. Bile acid malabsorption in persistent diarrhoea. J R Coll Physicians Lond 2000; 34(5): 448–451.
25. Lenicek M, Duricova D, Komarek V et al. Bile acid malabsorption in inflammatory bowel disease: assessment by serum markers. Inflamm Bowel Dis 2011; 17(6): 1322–1327. doi: 10.1002/ibd.21502.
26. Gracie DJ, Kane JS, Mumtaz S et al. Prevalence of, and predictors of, bile acid malabsorption in outpatients with chronic diarrhea. Neurogastroenterol Motil 2012; 24(11): 983–e538. doi: 10.1111/j.1365-2982.2012.01953.x.
27. Mena Bares LM, Benítez Cantero JM et al. Bile acid malabsorption in patients with chronic diarrhea and Crohn‘s disease. Rev Esp Enferm Dig 2019; 111(1): 40–45. doi: 10.17235/reed.2018.5376/2017.
28. Walters JR, Johnston IM, Nolan JD et al. The response of patients with bile acid diarrhoea to the farnesoid X receptor agonist obeticholic acid. Aliment Pharmacol Ther 2015; 41(1): 54–64. doi: 10.1111/apt.12999.
29. Phillips F, Muls AC, Lalji A et al. Are bile acid malabsorption and bile acid diarrhoea important causes of loose stool complicating cancer therapy? Colorectal Dis 2015; 17(8): 730–734. doi: 10.1111/codi.12932.
30. Jackson A, Lalji A, Kabir M et al. The efficacy of a low-fat diet to manage the symptoms of bile acid malabsorption – outcomes in patients previously treated for cancer. Clin Med (Lond) 2017; 17(5): 412–418. doi: 10.7861/clin medicine.17-5-412.
31. Gadhok R, Paulon E, Tai C et al. Gastrointestinal consequences of cancer treatment: evaluation of 10 years‘ experience at a tertiary UK centre. Frontline Gastroenterol 2020; 12(6): 471–477. doi: 10.1136/flgastro-2020-101430.
32. Kohoutova D, Worku D, Aziz H et al. Malignant Melanoma of the Gastrointestinal Tract: Symptoms, Diagnosis, and Current Treatment Options. Cells 2021; 10(2): 327. doi: 10.3390/ cells10020327.
33. Andreyev HJN, Lalji A, Mohammed K et al. The FOCCUS study: a prospective evaluation of the frequency, severity and treatable causes of gastrointestinal symptoms during and after chemotherapy. Support Care Cancer 2021; 29(3): 1443–1453. doi: 10.1007/s00520-020-05 610-x.
34. Kohoutova D, Gee C, Fleuret C et al. Bile acid malabsorption as a consequence of cancer treatment: prevalence and management in the national leading centre. UEG J 2021; 9(8): 207.
35. Bureš J, Kohoutová D, Zavoral M. Gastrointestinální toxicita systémové onkologické imunoterapie. Klin Onkol. In press 2022.
36. Naraev BG, Halland M, Halperin DM et al. Management of Diarrhea in Patients With Carcinoid Syndrome. Pancreas 2019; 48(8): 961–972. doi: 10.1097/MPA.0000000000001384.
37. Pusceddu S, Rossi RE, Torchio M et al. Differential Diagnosis and Management of Diarrhea in Patients with Neuroendocrine Tumors. J Clin Med 2020; 9 (8): 2468. doi: 10.3390/jcm9082468.
38. Khan MS, Walter T, Buchanan-Hughes A et al. Differential diagnosis of diarrhoea in patients with neuroendocrine tumours: A systematic review. World J Gastroenterol 2020; 26(30): 4537–4556. doi: 10.3748/wjg.v26.i30.4537.
39. Khanna L, Halfdanarson TR, Sonbol MB et al. Bile Acid Malabsorption in Patients with Neuroendocrine Tumors. Dig Dis Sci 2022; 67(6): 2517–2525. doi: 10.1007/s10620-021-07189-7.
40. Gee C, Fleuret C, Wilson A et al. Bile acid malabsorption as a consequence of cancer treatment: prevalence and management in the national leading centre. Cancers (Basel) 2021; 13(24): 6213. doi: 10.3390/cancers13246213.
41. Boyd GS, Merrick MV, Monks R et al. Se-75-labeled bile acid analogs, new radiopharmaceuticals for investigating the enterohepatic circulation. J Nucl Med 1981; 22(8): 720–725.
42. Westergaard H. Bile Acid malabsorption. Curr Treat Options Gastroenterol 2007; 10(1): 28–33. doi: 10.1007/s11938-007-0054-7.
43. Vijayvargiya P, Camilleri M, Shin A et al. Methods for diagnosis of bile acid malabsorption in clinical practice. Clin Gastroenterol Hepatol 2013; 11(10): 1232–1239. doi: 10.1016/j.cgh.2013.04.029.
44. Gupta A, Muls AC, Lalji A et al. Outcomes from treating bile acid malabsorption using a multidisciplinary approach. Support Care Cancer 2015; 23(10): 2881–2890. doi: 10.1007/s00 520-015-2653-5.
45. Lyutakov I, Ursini F, Penchev P et al. Methods for diagnosing bile acid malabsorption: a systematic review. BMC Gastroenterol 2019; 19(1): 185. doi: 10.1186/s12876-019-1102-1.
46. Bajor A, Törnblom H, Rudling M et al. Increased colonic bile acid exposure: a relevant factor for symptoms and treatment in IBS. Gut 2015; 64(1): 84–92. doi: 10.1136/gutjnl-2013-305 965.
47. Jung D, Fantin AC, Scheurer U et al. Human ileal bile acid transporter gene ASBT (SLC10A2) is transactivated by the glucocorticoid receptor. Gut 2004; 53(1): 78–84. doi: 10.1136/gut.53.1.78.
48. Garbutt JT, Kenney TJ. Effect of cholestyramine on bile acid metabolism in normal man. J Clin Invest 1972; 51(11): 2781–2789. doi: 10.1172/JCI107100.
49. Sauter GH, Münzing W, von Ritter C et al. Bile acid malabsorption as a cause of chronic diarrhea: diagnostic value of 7alpha-hydroxy-4-cholesten-3-one in serum. Dig Dis Sci 1999; 44(1): 14–19. doi: 10.1023/a:1026681512303.
50. Brydon WG, Nyhlin H, Eastwood MA et al. Serum 7 alpha-hydroxy-4-cholesten-3-one and selenohomocholyltaurine (SeHCAT) whole body retention in the assessment of bile acid induced diarrhoea. Eur J Gastroenterol Hepatol 1996; 8(2): 117–123. doi: 10.1097/00042737-19960 2000-00005.
51. Gälman C, Angelin B, Rudling M. Bile acid synthesis in humans has a rapid diurnal variation that is asynchronous with cholesterol synthesis. Gastroenterology 2005; 129(5): 1445–1453. doi: 10.1053/j.gastro.2005.09.009.
52. Aldini R, Roda A, Festi D et al. Diagnostic value of serum primary bile acids in detecting bile acid malabsorption. Gut 1982; 23(10): 829–834. doi: 10.1136/gut.23.10.829.
53. Yeoh EK, Lui D, Lee NY. The mechanism of diarrhoea resulting from pelvic and abdominal radiotherapy; a prospective study using selenium-75 labelled conjugated bile acid and cobalt-58 labelled cyanocobalamin. Br J Radiol 1984; 57(684): 1131–1136. doi: 10.1259/0007-1285-57-684-1131.
54. Lauterburg BH, Newcomer AD, Hofmann AF. Clinical value of the bile acid breath test. Evaluation of the Mayo Clinic experience. Mayo Clin Proc 1978; 53(4): 227–233.
55. Hughes LE, Ford C, Brookes MJ et al. Bile acid diarrhoea: Current and potential methods of diagnosis. Ann Clin Biochem 2021; 58(1): 22–28. doi: 10.1177/0004563220966139.
56. Arasaradnam RP, Brown S, Forbes A et al. Guidelines for the investigation of chronic diarrhoea in adults: British Society of Gastroenterology, 3rd edition. Gut 2018; 67(8): 1380–1399. doi: 10.1136/gutjnl-2017-315909.
57. Sadowski DC, Camilleri M, Chey WD et al. Canadian Association of Gastroenterology Clinical Practice Guideline on the Management of Bile Acid Diarrhea. Clin Gastroenterol Hepatol 2020; 18(1): 24–41.e1. doi: 10.1016/j.cgh.2019.08. 062.
58. Bures J, Cyrany J, Kohoutova D et al. Small intestinal bacterial overgrowth syndrome. World J Gastroenterol 2010; 16(24): 2978–2990. doi: 10.3748/wjg.v16.i24.2978.
59. Moon C, Zhang W, Sundaram N et al. Drug-induced secretory diarrhea: A role for CFTR. Pharmacol Res 2015; 102: 107–112. doi: 10.1016/ j.phrs.2015.08.024.
60. Keely SJ, Barrett KE. Intestinal secretory mechanisms and diarrhea. Am J Physiol Gastrointest Liver Physiol 2022; 322(4): G405–G420. doi: 10.1152/ajpgi.00316.2021.
61. Una Cidon E. Vasoactive intestinal peptide secreting tumour: An overview. World J Gastrointest Oncol 2022; 14(4): 808–819. doi: 10.4251/wjgo.v14.i4.808.
62. Krishnamurthi SS, Macaron C. Management of acute chemotherapy-related diarrhea. UpToDate on-line. Waltham, MA: Wolters Kluwer, 2022. Dostupné: www.uptodate.com (staženo 8.8.2022).
63. Bailly C. Irinotecan: 25 years of cancer treatment. Pharmacol Res 2019; 148: 104398. doi: 10.1016/j.phrs.2019.104398.
64. Wilcox C, Turner J, Green J. Systematic review: the management of chronic diarrhoea due to bile acid malabsorption. Aliment Pharmacol Ther 2014; 39(9): 923–939. doi: 10.1111/apt.12684.
65. Mogbojuri OM, Adedapo AA, Abatan MO. Phytochemical screening, safety evaluation, anti-inflammatory and analgesic studies of the leaf extracts of Sterculia tragacantha. J Complement Integr Med 2016; 13(3): 221–228. doi: 10.1515/jcim-2015-0114.
66. Hvas CL, Ott P, Paine P et al. Obeticholic acid for severe bile acid diarrhea with intestinal failure: A case report and review of the literature. World J Gastroenterol 2018; 24(21): 2320–2326. doi: 10.3748/wjg.v24.i21.2320.
67. Kårhus ML, Brønden A, Røder ME et al. Remission of Bile Acid Malabsorption Symptoms Following Treatment With the Glucagon-Like Peptide 1 Receptor Agonist Liraglutide. Gastroenterology 2019; 157(2): 569–571. doi: 10.1053/ j.gastro.2019.04.002.
68. Valencia-Rodríguez A, Aquino-Matus J, Vera-Barajas A et al. New therapeutic options for bile acid malabsorption diarrhea. Ann Transl Med 2019; 7(22): 695. doi: 10.21037/atm.2019.09.112.
69. Kårhus ML, Brønden A, Lyng Forman J et al. Protocol for a randomised, double-blinded, placebo-controlled, double-dummy 6-week clinical trial comparing the treatment effects of the glucagon-like peptide 1 receptor agonist liraglutide versus the bile acid sequestrant colesevelam on bile acid malabsorption. BMJ Open 2021; 11(2): e044711. doi: 10.1136/bmjopen-2020-044 711.
70. Longmire-Cook SJ, Lillienau J, Kim YS et al. Effect of replacement therapy with cholylsarcosine on fat malabsorption associated with severe bile acid malabsorption. Studies in dogs with ileal resection. Dig Dis Sci 1992; 37(8): 1217–1227. doi: 10.1007/BF01296 563.
71. Kim BT, Kim KM, Kim KN. The Effect of Ursodeoxycholic Acid on Small Intestinal Bacterial Overgrowth in Patients with Functional Dyspepsia: A Pilot Randomized Controlled Trial. Nutrients 2020; 12(5): 1410. doi: 10.3390/nu12 051410.
72. Muls A, Taylor A, Lalondrelle S et al. A proposed tailored investigational algorithm for women treated for gynaecological cancer with long-term gastrointestinal consequences. Support Care Cancer 2020; 28(10): 4881–4889. doi: 10.1007/s00520-020-05309-z.
73. BouSaba J, Sannaa W, McKinzie S et al. Impact of Bile Acid Diarrhea in Patients With Diarrhea-Predominant Irritable Bowel Syndrome on Symptoms and Quality of Life. Clin Gastroenterol Hepatol 2021: 20(9): 2083–2090.e1. doi: 10.1016/j.cgh.2021.11.035.
74. Damsgaard B, Dalby HR, Krogh K et al. Long-term effect of medical treatment of diarrhoea in 377 patients with SeHCAT scan diagnosed bile acid malabsorption from 2003 to 2016; a retrospective study. Aliment Pharmacol Ther 2018; 47(7): 951–957. doi: 10.1111/apt.14533.
75. Bannaga A, Kelman L, O‘Connor M et al. How bad is bile acid diarrhoea: an online survey of patient-reported symptoms and outcomes. BMJ Open Gastroenterol 2017; 4(1): e000116. doi: 10.1136/bmjgast-2016-000116.