Endoskopická liečba dominantných stenóz žlčovodov pri primárnej sklerózujúcej cholangitíde (PSC)
Marián Bátovský Orcid.org 1
+ Pracoviště
Souhrn
PSC je chronické cholestatické ochorenie pečene charakterizované progresívnym zápalom a fibrózou žlčovodov, vyús»ujúce do biliárnej cirhózy a s vysokým rizikom vzniku cholangiokarcinómu. Jeho etiológia nie je známa a okrem transplantácie pečene nejestvuje ani kuratívna liečba. Zápalové zmeny extrahepatálnych žlčovodov vedú k tvorbe takmer kompletných stenóz s akútnym zhoršením pečeňových funkcii. Takéto lézie sa nazývajú dominantné striktúry a postihujú 15-20 % PSC pacientov. Endoskopická liečba sa zameriava najmä na striktúry pravého a µavého hepatiku ako aj spoločného hepatiku, resp. hepatocholedochu. Endoskopická liečba ponúka balónikovú dilatáciu dominantných stenóz alebo ich dilatáciu búžiami a zakladanie duodenobiliárnych drenáží, prípadne kombináciu oboch týchto metód. Ktorýkoµvek z týchto prístupov vedie k predĺženiu prežívania PSC pacientov, aj keď dosiaµ nie je arbitrážne stanovená najvhodnejšia endoskopická liečebná metóda na riešenie dominantných stenóz. Väčšina centier uprednostňuje ich balónikovú dilatáciu kvôli nižšiemu výskytu komplikácii (hnisavá cholangitída, sepsa). Prítomnos» distálne lokalizovanej dominantnej stenózy, vysoká hyperbilirubinémia a včasná endoskopická liečba dominantných stenóz sú nezávislými prediktívnymi faktormi úspešného efektu terapie PSC.
Kµúčové slová: primárna sklerózujúca cholangitída - biliárna stenóza - endoskopická liečba - cholestáza - cholangiokarcinóm.
Táto práca bola prednesená v skrátenej podobe ako prednáška na XXXI. slovenskom a českom gastroenterologickom kongrese, 11.-13. 6. 2009 v Ružomberoku.
ÚVOD
PSC je chronické cholestatické ochorenie pečene charakterizované progresívnym zápalom a fibrózou žlčových ciest, vyús»ujúce do biliárnej cirhózy a s vysokým rizikom vzniku cholangiokarcinómu(1). Prvýkrát ju popísal francúzsky lekár Delbet roku 1924 (cit. podµa 2).
Incidencia PSC je 1 : 100 000 a prevalencia sa pohybuje medzi 1-6/100 000 osôb(1,3). Priemerný vek v čase stanovenia diagnózy je 40 rokov a choroba postihuje častejšie mužov, a to v pomere 2 : 1 ku ženám(2).
Etiológia a patofyziológia nie sú známe, predpokladá sa, že ide o autoimunitný proces namierený proti epitelovým bunkám žlčových ciest. Ide zrejme o komplexný proces zahŕňajúci imunologické a imunogenetické mechanizmy, aj keď sa zatiaµ nenašli génové polymorfizmy predisponujúce k PSC(4).
Diagnóza je založená primárne na cholangiografických nálezoch získaných pri endoskopickej retrogádnej cholangiografii (ERC) a magnetickej rezonančnej cholangiografii (MRC). MRC je považovaná za vhodnú metódu sledovania PSC pacientov(5) (tab. 1).
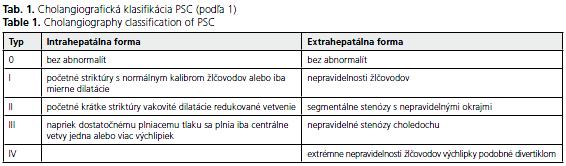
Biochemické (cholestáza) a imunosérologické nálezy (orgánovo-špecifické protilátky p-ANCA, AMA, ANA, SMA, hyperimunoglobulinémia IgM a cirkulujúce imunokomplexy) ako aj histológia (v 5-10 % negatívna, najmä v počiatočných štádiach, kedy je PSC fokálnym procesom) hrajú pomocnú úlohu(2).
Samotná ERC má nedostatočnú senzitivitu a špecifitu (62,5 %, resp. 53,1 %) pri odlíšení malígnych a benígnych stenóz, preto sa dopĺňa kefkovou cytológiou, alebo klieš»ovou biopsiou (riziková), intraduktálnou ultrasonografiou (87,5 %, resp. 90,6 %) a priamou vizualizáciou žlčovodov cholangioskopickým vyšetrením. V žlči odsatej pri ERC možno stanovi» k-ras onkogén, žlčový inzulín-like rastový faktor, ktoré pomáhajú v stanovení rizika cholangiokarcinómu, ktoré kolíše medzi 10-23 % PSC pacientov(1,6,7).
Klinicky sa okrem
a) klasickej globálnej, resp. zmiešanej formy rozoznáva aj
b) forma s postihnutím veµkých žlčovodov a
c) forma s postihnutím malých žlčovodov (5-15 % PSC pacientov), ktorá sa napriek cholestáze a pozitívnemu histologickému obrazu nedá cholangiograficky detekova». Táto forma má menej agresívny priebeh so zriedkavým prechodom na veµké žlčovody, pričom vznik cholangiokarcinómu zatiaµ nebol popísaný.
Ďalšími variantými formami PSC sú:
d) overlap s autoimúnitnou hepatitídou a
e) IgG4 sklerózujúca cholangitída, ktorá je často spojená s autoimúnitnou pankreatitídou a dobre reaguje na kortikoterapiu. V bioptických vzorkách z Vaterovej papily možno nájs» IgG4 pozitívne plazmatické bunky, pričom papila typicky hypertrofuje.
15-40 % PSC pacientov je v čase stanovenia diagnózy klinicky asymptomatických. Najčastejšími subjektívnymi príznakmi PSC je nafukovanie pruritus. Od stanovenia diagnózy PSC po vznik pečeňového zlyhania uplynie v priemere 12-18 rokov. Stredné prežívanie sa skracuje najmä pri overlape s autoimúnitnou hepatitídou.
70-80 % PSC pacientov má ulceróznu kolitídu a naopak, 2-7,5 % pacientov s ulceróznou kolitídou a 1,4-3,4 % pacientov s Crohnovou chorobou majú PSC(6,8-10).
Liečba kyselinou ursodeoxicholovou neovplyvňuje tvorbu dominantných stenóz ani prežívanie pacientov(11), aj keď sa recentné práce prihovárajú za podávanie vysokých dávok (25-30 mg/kg/deň)(12). Ďalšie farmakologické intervencie (kortikoidy, imunosupresíva) zlyhali.
Novými preparátami, ktoré vzbudzujú očakávania, sú kyselina dekosahexaeniková, inhibítory tumor nekrózujúceho faktora, niektoré antifibrotické agensy (ACE inhibítory), sirolimus/rapamycín a inhibítory formovania toxickej žlče (kyselina 24-nor-ursodeoxicholová)(6).
Najvyšší liečebný potenciál má transplantácia pečene, ktorá ak je správne načasovaná, prináša vysoké skóre prežívania PSC pacientov. Pä»ročné prežívanie po úspešnej transplantácii kolíše medzi 83-88 % a 10-ročné prežívanie naplní až 70 % pacientov, pričom rekurencia PSC dosahuje 20 až 25 %(6,13,14).
ENDOSKOPICKÁ LIEČBA
Terapeutické úsilie sa sústreďuje na riešenie dominantných stenóz, ktoré postihujú 15-20 % PSC pacientov, podµa Bjornssona et al. až 45 % pacientov s PSC(15). Za dominantnú stenózu sa považuje kompletná alebo takmer kompletná stenóza pravého alebo µavého d. hepaticus alebo d. hepaticus communis, ktorá vedie k zábrane odtoku žlče s nárastom biliárneho tlaku(16). Objektívne je dominantná stenóza definovaná šírkou choledochu do 1,5 mm a šírkou postihnutého hepatiku do 1 mm(11,15). Dôsledkom cholestázy je pruritus, infekcie biliárneho traktu až cholangiosepsa, formovanie žlčových kameňov nad stenózou a funkčná i morfologická prestavba pečene v zmysle biliárnej cirhózy(17,18).
Cieµom endoskopickej liečby je udržanie priechodnosti žlčovodov so zlepšením klinických a biochemických parametrov. Podµa viacerých autorov má dokázaný priaznivý efekt aj na prežívanie pacientov(19,20,21), ako ukazujú aplikácie matematického modelu prežívania známeho ako Mayo Clinic Survival Model(22). Podµa tohto modelu sa očakávané prežívanie vypočítava podµa vzorca:
rizikové prežívanie PSC pacienta = 0,03 × vek v rokoch + 0,54 × logBi (v mg/dl/ + 0,54 × logAST (U/l) + 1,24 × krvácanie z varixov (0/1) - 0,84 × albumín (g/dl)
Napríklad v štúdii Baluyuta et al.(19) bol vyrátaný počet PSC pacientov, ktorí prežijú 5 rokov 65 % z celkového počtu 63 pacientov. Výpočet sa konal tri mesiace pred zahájením endoskopickej liečby. Skutočný počet pacientov, ktorí prežili 5 rokov po endoskopickej intervencii bol však 83 % (p = 0,027).
V repertoári ponúkajúcich sa metód je balóniková dilatácia alebo dilatácia búžiami so stúpajúcim kalibrom, zakladanie duodenobiliárnych drenáží a dokonca boli popísané aj nazobiliárne drenáže s preplachovaním žlčovodov kortikoidmi (čo však neviedlo k priaznivému efektu). Z transhepatálneho prístupu možno tiež vykona» balónikovú dilatáciu alebo založi» vonkajšiu drenáž žlčových ciest.
Randomizované štúdie porovnávajúce efekt jednotlivých endoskopických metód boli publikované iba v obmedzenom množstve. Prekážkou ich realizácie je najmä heterogénna populácia PSC pacientov a ich nízky počet. Preto zatiaµ ani nejestvuje jednoznačné odporúčanie týkajúce sa najefektívnejšieho endoskopického prístupu v liečbe dominantných stenóz. Vo všeobecnosti sa udáva, že stentovanie prináša častejšie komplikácie, najmä cholangitídy a pankreatitídy, zatiaµčo balóniková dilatácia vyžaduje častejšie opakovanie výkonu pre restenózy(6,23).
Pri balónikovej dilatácii sa používajú balóniky s priemerom 4-8 mm, ktoré sa po vodiči zavádzajú do miesta stenózy. Predtým možno použi» dilatačné búžie. Priemer a tuhos» stenózy určujú dosiahnutý tlak v balóniku, ktorý sa pohybuje medzi 4 až 10 atm, pričom trvanie maximálnej insuflácie a počet dilatačných cyklov počas jednej terapeutickej procedúry nie sú arbitrážne stanovené. Balóniková dilatácia dominantných stenóz je jedinou liečebnou možnos»ou v prípade jej umiestnenia v blízkosti bifurkácie, keďže založený drén by spomalil odtok žlče z druhého hepatiku(24).
Klasická vnútorná drenáž žlčovodov pozostáva zo založenia dvoch aspoň 10 F plastových drénov, ktoré sa vymieňajú každé 3 mesiace. Samoexpandovateµné kovové drény sa v tejto indikácii nepoužívajú, o biodegradabilných možno uvažova»(25-27). V súčasnosti sa uprednostňujú agresívnejšie stratégie, pri ktorých sa zavádza maximálny počet stentov, ktoré sa vymieňajú v trojmesačných intervaloch, pričom sa zakladá stúpajúci počet drénov do dosiahnutia kompletnej morfologickej rezolúcie striktúry(28). Bergman(25) v tejto súvislosti stanovuje pravidlo dvoch maxím: bez maxima periódy drénovania a s maximom možných inzercii drénov.
Tento typ endoskopickej liečby možno z hµadiska výskytu komplikácii rozdeli» do troch štádií:
1. fáza: založenie drenáže - komplikácie sa pohybujú v priemere okolo 10 %.
2. fáza: drén in situ a jeho výmena v trojmesačných intervaloch - komplikácie oscilujú medzi 10 až 15 % za jeden rok.
3. fáza sledovania pacienta po vyňatí drénu - rekurencia stenóz dosahuje 20 %, pričom približne polovica z nich vzniká do dvoch rokov.
Štúdie s použitím intraduktálnej ultrasonografie ukázali, že drenáž indukuje zhrubnutie a fibrózu steny žlčovodu už dva týždne po inzercii plastového stentu. Založenie početných drénov počas viac ako jedeného roka potom znižuje šance na úspešnú chirurgickú rekonštrukčnú liečbu. V týchto súvislostiach preto opä» vyvstáva otázka zavádzania biodegradabilných drénov, ktoré sa za 1-2 roky "rozpustia"(25).
Častejšou výmenou duodenobiliárnych drénov zaujali dve práce z holandského pracoviska, ktoré boli publikované už koncom devä»desiatych rokov(23,29). Za účelom zníženia frekvencie komplikácii pristúpili k výmene stentov každých 9, resp. 11 dní s 80% pretrvávaním efektu endoskopickej terapie aj po jednom roku od vyňatia posledného drénu. V tomto čase sa zrejme začala éra favorizácie drénovania žlčovodov v krátkych intervaloch. Práce Kayu et al.(30) ako aj ďalších autorov, ktorí neskôr retrospektívne porovnali efekt balónikovej dilatácie s duodenobiliárnou drenážou, skončili tvrdením, podµa ktorého stenting neprináša viac pridaných výhod ako samotná balóniková dilatácia. Výsledky týkajúce sa bezprostredného zlepšenia klinických a laboratórnych parametrov ako aj doby prežívania, resp. času do transplantácie pečene boli pri oboch metódach približne rovnaké, iba komplikácii po založení duodenobiliárnej drenáže bolo dvakrát viac než po samotnej balónikovej dilatácii - okolo 10%, resp. okolo 5% - v Kayovom súbore dokonca 5× viac.
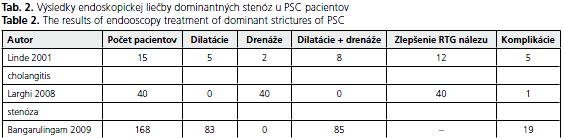
V prácach terajších autorov preto mierne prevláda uprednostňovanie samotnej balónikovej dilatácie pred kombináciou oboch metód. Za nimi s odstupom nasleduje zakladanie samotnej duodenobiliárnej drenáže(19,20,21,31,32). Sú však aj autori - napr. Wittman et al.(33), v súbore ktorých bola zastúpená samotná drenáž až 46 percentami endoskopických terapeutických výkonov. Komparáciu skúseností niektorých ďalších autorov(28,32,34) s obomi technikami ukazuje tabuµka 2. Medzi najčastejšie komplikácie endoskopickej drenáže sa ráta cholangitída, cholangiosepsa, pankreatitída, krvácanie a perforácie žlčovodu s únikom žlče do retroperitonea, ktoré však nie sú častejšie v porovnaní s drénovaním benígnych stenóz inej ako PSC etiológie(34,35).
Dominantné stenózy môžu by» po zlyhaní endoskopickej liečby riešené aj chirugicky, ale iba u necirhotických pacientov. Najčastejšími chirurgickými výkonmi bývajú opä» dilatácie a zriedkavejšie choledochojejunostómie alebo Roux-en-Y-hepatikojejunostómie so 75-93 % úspešnos»ou, avšak s až 20 % vznikom stenóz anastomózy . Pacienti po chirurgickej liečbe vyžadujú pri prípadnej následnej transplantácii pečene dlhší operačný čas, viac jednotiek erytrocytovej masy a majú vyššiu incidenciu biliárnych komplikácii(6,25,30).
ZÁVER
PSC je ochorenie neznámej etiológie bez možnosti kuratívnej terapie okrem transplantácie pečene. V súčasnosti sa považuje za jednu z najväčších výziev v dnešnej hepatológii.
Keď sa u pacienta objaví ikterus, je indikované ERCP vyšetrenie za účelom zistenia dominantnej striktúry, dôsledku ktorej vzniká významná proximálna suprastenotická dilatácia žlčovodov. V týchto prípadoch vedie dekompresia nielen k poklesu hyperbilirubinémie, ale aj k zlepšeniu subjektívnych »ažkostí pacienta (pruritus). Aj parciálne obnovenie prietoku žlče dokáže významne pomôc». PSC pacienti s dominantnou stenózou sú liečení častými opakovanými endoskopickými dilatáciami nezriedka kombinovanými s duodenobiliárnymi drenážami, ktoré sa vymieňajú najmenej v trojmesačných intervaloch, alebo i skôr, ak dôjde k ich spontánnej oklúzii. Dlhotrvajúca endoskopická liečba vedie k dramatickým efektom: až v 80 % sa stáva, že pokročilá extrahepatálna striktúra sa rozšíri natoµko, že zavedenie ďalšej drenáže nie je potrebné.
Otázka výberu vhodnej endoskopickej metódy nie je nateraz celkom doriešená - dôležitejšie však je, aby bol pacient s dominantnou stenózou liečený včas. Samotná vysoká hyperbilirubinémia s distálne uloženou dominantnou stenózou sa ukázali ako nezávislé prediktívne faktory úspešnosti takejto terapie, v ktorej väčšina autorov uprednostňuje balónikovú dilatáciu pred stentovaním kvôli nižšej frekvencii komplikácii(16).
Endoskopická liečba PSC dokáže oddiali» transplantáciu pečene, ale nevedie k signifikantnému zníženiu mortality na základné ochorenie. Pri oddaµovaní transplantácie teoreticky prichádza do úvahy poskytnutie časového intervalu na "umožnenie" vzniku cholangiocelulárneho karcinómu. Pri každej výmene drenáže by sa mali robi» kefkové stery na cytologické vyšetrenie. Na toto vyšetrenie je vhodné posla» aj eluát z extrahovaného stentu za účelom vylúčenia prípadnej malignity. Často sa zis»uje mierne zvýšenie CA 19-9 na hodnoty okolo 100-200, ale stúpajúce hodnoty alebo výraznejšia elevácia pri absencii aktívnej infekcie vedú k podozreniu na malignitu.
Tesné hilové striktúry s dilatáciou intrahepatálnych žlčovodov sa vyskytujú zriedkavejšie. Pacienti s léziami pripomínajúcimi Klatskinove tumory sú prednostne indikovaní na transplantáciu pečene a v prechodnom období sa po zlyhaní pokusu o za vedenie duodenobiliárnej drenáže vykonávajú aj externé drenáže. Chirurgická liečba týchto striktúr sa skôr neodporúča kvôli interferencii s následnou transplantáciou.
LITERATÚRA
- 1. Weissmuller TJ, Wedemeyer J, Kubicka S. The chalenges in primary sclerosing cholangitis -aetiopathogenesis, autoimmunity, management and malignancy. J Hepatol 2008; 48(Suppl 1): S38-S57.
- 2. Portincasa P, Vacca M, Moschetta A. Primary sclerosing cholangitis: updates in diagnosis and therapy. World J Gastroenterol 2005, 11: 7-16.
- 3. Vacca M, Krawczyk M, Petruzzelli M. Current treatments of primary sclerosing cholangitis. Curr Med Chem 2008; 14: 2081-2094.
- 4. Gaj P, Habior A, Mikola M. Lack of evidence for association of primary sclerosing cholangitis with risk allelesfor Crohn disease in Polish patients. BMC Med Genet 2008, 9: 81.
- 5. Bader T. MR imaging features of primary sclerosing cholangitis. Radiology 2003; 226: 675-685.
- 6. Silveira MG, Lindor KD. Clinical features and management of primary sclerosing cholangitis. World J Gastroenterol 2008; 14: 3331-3349.
- 7. Lindberg B, Arnelo U, Bergquist A. Diagnosis of biliary strictures in conjunction with endoscopic retrograde cholangiopancreatography, with special reference to patients with primary sclerosing cholangitis. Endoscopy 2002; 34: 909-916.
- 8. Nikolaidis NL, Giouleme M, Tziomalos KA. Small- duct primary sclerosing cholangitis. A single center seven-year experience. Dig Dis Sci 2005; 50: 324-326.
- 9. Kubota K, Kato S, Akiyama T. Differentiating sclerosing cholangitis caused by autoimmune pancreatitis and primary biliary cholangitis according to endoscopic duodenal papillary features. Gastrointest Endoscopy 2008; 68: 1204-1208.
- 10. Angulo P, Maor-Kendler Y, Linder K. Small-duct primary sclerosing cholangitis: a long-term follow-up study. Hepatology 2002; 35: 1494-1500.
- 11. Stiehl A, Rost D. Endoscopic treatment of dominant stenoses in patients with primary sclerosing cholangitis. Clin Res Allerg Immunol 2005; 28: 159-165.
- 12. Cullen SN, Rust C, Fleming K. High-dose of ursodeoxycholic acid for the treatment of primary sclerosing cholangitis is safe and effective. J Hepatol 2008; 48: 792-794.
- 13. Graziadei IW, Wiesner RH, Batts KP. Recurrence of primary sclerosing cholangitis following liver transplantation. Hepatology 1999; 29: 1050-1056.
- 14. Bjornsson E. Management of primary sclerosing cholangitis. Minerva Gastroenterol Dietol 2009; 55: 163-172.
- 15. Bjornsson E, Lindqvist-Ottosson J, Asztely M. Dominant strictures in patients with primary sclerosing cholangitis. Am J Gastroenterol 2004; 99: 502-508.
- 16. Michaels A, Levy C. Endoscopic therapy in primary sclerosing cholangitis. Medscape J Med 2008; 10: 242.
- 17. Rudolph G, Gotthardt D, Kloters-Plachky P. Influence of dominant bile duct stenoses and biliary infections in outcome in primary sclerosing cholangitis. Doi:10.1016/j.hep.2009.01.023
- 18. Charatcharoenwitthaya P, Enders FB, Halling KC. Utility of serum markers, imaging and biliary cytology for detecting cholangiocarcinoma in primary sclerosing cholangitis. Hepatology 2008; 48: 1106-1117.
- 19. Baluyut AR, Sherman S, Lehman GA, Hoen H. Impact of endoscopic therapy in patients with primary sclerosing cholangitis. Gastrointest Endosc 2001; 53: 308-331.
- 20. Johnson GK, Saeian K, Geenen JE. Primary sclerosing cholangitis treated by endoscopic biliary dilation: review and long-term follow-up evaluation. Curr Gastroenterol Rep 2006; 8: 147-155.
- 21. Gluck M, Cantone R, Brandabur JJ. A twenty-years experience with endoscopic therapy for symptomatic primary sclerosing cholangitis. Clin Gastroenterol 2008; 42: 1032-1039.
- 22. Kim WR, Therneau TM, Wiesner RH. A revised natural history model for primary sclerosing cholangitis. Scopus - Mayo Clin Proc, 2006.
- 23. vanMilligen deWitt AV, Rauws EA, vanBracht J. Lack of complications for extrahepatic bile duct strictures in primary sclerosing cholangitisC. Gastrointest Endosc 1997; 92: 1076-1085.
- 24. Wagner S, Gebel M, Meier P. Endoscopic management of biliary tract strictures in primary sclerosing cholangitis. Endoscopy 1996; 28: 546-551.
- 25. Bergman JJGHM. Management of postsurgical bile leaks and bile duct strictures. In: Cotton PB. ERCP. GastroHep eBook, 2008.
- 26. Siriwardana HP, Siriwardena AK. Systematic appraisal of the role of metallic endobiliary stenting of benign bile duct stricture. Am Surg 2006; 244: 164-165.
- 27. Martin EC, Laffey KJ, Bixon A. Gianturco-Rosch biliary stents: preliminary experience. Vasc Interv Radiol 1990; 1: 101-105.
- 28. Larghi A, Tringali A, Lecca PG. Management of biliary strictures. Am J Gastroenterol 2008; 103: 458-473.
- 29. Ponsioen CY, Lam K, vanMiligen deWitt AV. Four years stenting in primary sclerosing cholangitis. Am J Gastroenterol 1999; 94: 2403-2409.
- 30. Kaya M, Petersen BT, Angulo P. Balloon dilatation compared to stenting of dominant stenoses in patients with primary sclerosing cholangitis. Am J Gastroenterol 2001; 96: 1059-1066.
- 31. Stiehl A, Rudolph G, Kloters-Plachky P. Development of dominant stenoses in patients with primary sclerosisng cholangitis trated with ursodeoxycholic acid. J Hepatol 2002; 36: 151-153.
- 32. Linder S, Sodelund C. Endoscopic therapy in primary sclerosing cholangitis: outcome of treatment and risk of cancer. Hepatogastroenterol 2001; 48: 387-392.
- 33. Wittman J, Webster GJM, Hatfield ARW. Endoscopic therapy of 110 patients with primary sclerosing cholangitis in a single centre 1984-2003. Gastrointest Endoscopy 2004; 59: 180.
- 34. Bangarulingam SY, Gossard AA, Petersen BT. Complication of ERCP in primary sclerosing cholangitis. Am J Gastroenterol 2009; 104: 855-860.
- 35. Etzel JP, Eng SC, Ko CW. Complications after ERCP in patients with primary sclerosing cholangitis. Gastrointest Endoscopy 2008; 67: 649-650.
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené