Azathioprin v terapii idiopatických střevních zánětů u dětí – díl I: indikace, dávkování a nežádoucí účinky léčby thiopuriny
Kristýna Pospíšilová1, Jiří Bronský Orcid.org 1
+ Pracoviště
Souhrn
Východiska: Thiopuriny (v Evropě pak především azathioprin) patří mezi nejčastěji užívaná léčiva v terapii idiopatických střevních zánětů u dětí. Vzhledem k relativně dlouhotrvajícímu nástupu účinku jsou tyto léky nevhodné pro indukci remise, ale užívají se spíše v udržovací fázi terapie. V některých případech jsou pak thiopurinová léčiva užívána v kombinaci s jinou terapií (s aminosalicyláty či přípravky biologické léčby). Nežádoucí účinky thiopurinů se mohou vyskytovat u 15–40 % pacientů a v nezanedbatelném procentu případů pak vedou k nutnosti léčbu přerušit. Cíle: Zpřehlednit dostupné informace o terapii a možnosti její optimalizace u (především) dětských pacientů s idiopatickými střevními záněty. Závěr: Genetické vyšetření a pečlivá pravidelná monitorace krevního obrazu a biochemických parametrů (především v počátku terapie) mohou pomoci části z vážnějších nežádoucích účinků předcházet.
Klíčová slova
Crohnova nemoc, ulcerózní kolitida, pediatrie, merkaptopurin, thiopuriny
Thiopuriny v terapii idiopatických střevních zánětů
Azathioprin (AZA) a jeho metabolit 6-merkaptopurin (6-MP) patří mezi nejčastěji užívaná imunosupresiva pro „udržení“ remise – tzv. udržovací léčbu – idiopatických střevních zánětů (IBD), tedy Crohnovy choroby (CD) i ulcerózní kolitidy (UC).
Thiopuriny v terapii CD u dospělých pacientů
Dle metaanalýzy randomizovaných placebem kontrolovaných studií z roku 2009 zabývajících se efektem azathioprinu (AZA) a 6-merkaptopurinu (6-MP) v léčbě Crohnovy choroby (CD) vykazují v případě udržení remise CD u dospělých pacientů oba thiopuriny pozitivního efektu (nižší procento relapsů ve srovnání s placebem). Pokud byl AZA podáván ve vyšších dávkách kolem 2,5 mg/kg/den, byla léčba účinnější než u dávek nižších (1,0 a 2,0 mg/kg/den) [1]. Navíc bylo vypozorováno, že léčba thiopuriny snižuje riziko chirurgického zásahu [2–4]. Časná terapie (zahájení léčby thiopuriny do 1–3 let od diagnózy, ještě lépe do 6 měsíců) vykazuje dle některých studií v tomto směru lepší účinek. Jiné však podobný efekt neprokázaly [5–7]. Dlouhodobě AZA snižuje potřebu systémových kortikosteroidů [8].
Thiopuriny v terapii CD u dětí
Pozitivní efekt 6-MP na udržení remise byl prokázán i v randomizované studii, která se zaměřila na dětské pacienty s CD [9]. Další studie zaměřené na účinnost thiopurinů u dětí (observační, retrospektivní) tento efekt podporují, jejich výsledky však nejsou tak optimistické. Kromě prodloužení remise byla popsána nižší potřeba kortikoterapie (tj. systémové kortikosteroidy podávané kratší dobu, v nižších dávkách, event. vůbec) a méně hospitalizací u pacientů léčených AZA [10–12].
Thiopuriny v terapii UC u dospělých pacientů
Podobně i v případě UC v udržení remise prokázala metaanalýza lepší efekt AZA v prevenci relapsu UC ve srovnání s placebem [13]. I v tomto případě snižují thiopuriny nutnost hospitalizace (dny hospitalizace přepočteny na pacienta a rok) či podávání systémových kortikosteroidů [14].
Thiopuriny v terapii UC u dětí
Účinek terapie v udržení remise choroby i snížení spotřeby kortikosteroidů podporují i studie zaměřené na pediatrickou populaci [10,15–17]. Dle prospektivní multicentrické kohortové studie z roku 2011 zůstane v remisi onemocnění 1 rok od nasazení terapie thiopuriny bez nutnosti konkomitantní kortikosteroidní terapie přibližně 50 % dětských pacientů s UC. Tento efekt byl pozorován nezávisle na tom, zda terapie thiopuriny byla zahájena do 3 měsíců od diagnózy [17].
Dle evropských i českých doporučení je možno AZA nebo 6-MP zvolit jako udržovací léčbu CD i UC. Efekt thiopurinů v indukci remise IBD je neprůkazný [18], proto není monoterapie AZA/6-MP ve snaze o indukci remise (na rozdíl od udržovací fáze) doporučována [19–23].
Indikace terapie
Thiopurinové preparáty jsou všeobecně doporučovány jako jedna z možností udržovací terapie u dětí trpících IBD. Efekt terapie nenastoupí ihned, účinnost léku je možné posuzovat až po několika týdnech podávání [19–23]. AZA a 6-MP jsou brány jako rovnocenné a prvotní volba závisí především na ošetřujícím lékaři, přesto však existují geografické rozdíly v preferenci jednoho nebo druhého. V Evropě je v terapii IBD preferován spíše AZA, zatímco v USA dávají lékaři přednost 6-MP [24].
Crohnova choroba
U všech pacientů, u nichž byla diagnostikována středně těžká až těžká forma CD ve věku < 17 let, by měla být zahájena terapie thiopuriny. Totéž platí pro pacienty, u nichž bylo remise onemocnění dosaženo systémovými kortikosteroidy nebo choroba alespoň jednou relabovala. Vzhledem k tomu, že lze efekt terapie očekávat až s odstupem několika týdnů, je ve většině případů léčba AZA/6-MP zahajována již v době stanovení diagnózy, a podávána tak v kombinaci s indukční terapií (výlučná enterální výživa, systémově podávané kortikosteroidy, event. biologická terapie) [19,20].
Ulcerózní kolitida
Primárním udržovacím lékem u mírnějších forem UC je 5-aminosalicylová kyselina (5-ASA). V případě na kortikosteroidech dependentní formy onemocnění (relaps při snižování dávky kortikosteroidů nebo do 3 měsíců od jejich vysazení) nebo pokud tito pacienti často relabují (alespoň 2–3 relapsy ve 12 měsících) i přes plně dávkované aminosalicyláty, je vhodné přidat do terapie imunosupresivum – obvykle thiopurinový preparát. Imunosupresivní terapie by měla být zahájena také u pacientů s extraintestinálními projevy choroby. Často je terapie dlouhodobě kombinována s 5-ASA, v některých případech i s biologickou léčbou [20,22,25].
Optimalizace dávkování a role TPMT
Vzhledem k tomu, že je AZA přeměněn na 6-MP pouze z 88 % a molekulární hmotnost 6-MP odpovídá pouze 55 % molekulární hmotnosti AZA, liší se dávkování 6-MP a AZA [26]. Doporučené standardní dávkování AZA je 2,0–2,5 mg/kg/den, většinou podáváno v jedné denní dávce, v případě 6-MP pak 1,0–1,5 mg/kg/den, taktéž jednou denně [19–22,25]. Zdá se však, že u dětí mladších 6 let jsou jako terapeutické nutné dávky vyšší (v některých případech i ekvivalent > 3 mg/kg AZA), než jaké jsou doporučovány v případě dětí starších [28,29]. Oproti tomu byl u dospělých pacientů popsán v případě udržení remise UC dostatečný terapeutický efekt dávek < 1,5 mg/kg/den AZA [30].
Důležitou roli v metabolizmu thiopurinů hraje thiopurinmetyltransferáza (TPMT), při jejíž snížené aktivitě dochází ke snížené přeměně AZA na vedlejší produkty (a tedy ke zvýšené produkci aktivních metabolitů) a ke zdánlivému předávkování léčivem (včetně zvýšeného výskytu na dávce závislých nežádoucích účinků). Aktivitu TPMT lze v podmínkách České republiky predikovat cíleným genetickým vyšetřením zaměřeným na detekci nejčastějších mutací v genu kódujícím tento enzym. Dané vyšetření je plně indikováno u všech pacientů před zahájením terapie AZA [19,20,25]. Přestože existuje úzká korelace mezi fenotypem a genotypem [27,31], nemusí genotypizace odhalit všechny rizikové pacienty ze skupiny intermediárních metabolizátorů, zčásti proto, že rutinní vyšetření neodhalí nové a méně časté mutace, zčásti z dosud neobjasněných důvodů. Přesto si však genetické vyšetření (obzvlášť jsou-li vyšetřeny všechny dosud známé mutace) zachovává velmi vysokou senzitivitu (90 %) a ještě vyšší specificitu (až 99 %) [32]. Stanovení fenotypu enzymu (stanovení aktivity biochemickými metodami) by mělo být, pokud je dostupné, nadřazeno genotypizaci [19,33]. Až 3 měsíce před tímto vyšetřením však nesmí být pacientovi podána transfuze erytrocytů [19]. Rutinní fenotypizace není na rozdíl od genetického vyšetření v naší zemi dostupná.
Dominantní homozygoté v genu pro TPMT jsou považováni za „normometylátory“, někdy též nepřesně nazývanými „rychlí“ metabolizátoři, dávkování AZA u nich odpovídá obecným doporučením. Heterozygoté („hypometylátoři“) mají pouze jednu aktivní alelu kódující daný enzym, mohou užívat AZA v redukované dávce, která odpovídá 30–50 % doporučené. Recesivním homozygotům (pomalým metabolizátorům), kteří tvoří pouze 0,3 % populace, AZA zpravidla nepodáváme (výjimečně lze léčivo podat ve výrazně redukované dávce – 10 % doporučené) [20,22,25]. Blíže se problematice polymorfizmu v genu pro TPMT budeme věnovat v druhé části tohoto článku.
V praxi by dle doporučení pro pediatrickou populaci měl být AZA nasazen zpočátku (v případě neznalosti aktivity TPMT) pouze v poloviční dávce (tj. přibližně 1 mg/kg/den). Vzhledem k riziku výskytu nežádoucích účinků v začátcích je důrazně doporučováno pravidelně monitorovat krevní obraz, jaterní testy (ALT, AST) a pankreatické enzymy (alespoň sérovou amylázu). V prvním měsíci je vhodná častější kontrola – v intervalu à 14 dní, poté à 1 měsíc do třetího měsíce od nasazení a dále trvale alespoň jednou za 3 měsíce [19–21,25]. Po obdržení výsledků genetického vyšetření, pokud nebyla prokázána mutace TPMT, může být denní dávka léku plně navýšena [20,21]. Jako další možnost se jeví zahájení terapie až po obdržení výsledků vyšetření TPMT.
Efekt léčby AZA/6-MP lze očekávat nejdříve za 2–3 měsíce [23], proto pokud není po 6–9 měsících dosaženo očekávaného efektu, není vhodné v monoterapii pokračovat. V případě dobrého efektu pokračujeme v podávání AZA dlouhodobě [20,22] a rozhodnutí o ukončení léčby lze v pediatrii stále považovat za kontroverzní [25].
Kombinovaná terapie s anti-TNF
Konkomitantní podávání AZA při léčbě infliximabem (IFX) vede k nižší tvorbě protilátek proti infliximabu (anti-IFX), a tím i k výskytu méně infuzních reakcí [34–36]. Přidaná hodnota AZA při léčbě IFX hraje roli především v prvních 6 měsících kombinované léčby [35,37]. Polská studie 99 dětí s CD randomizovala pacienty též po 6 měsících konkomitantní terapie na skupinu pokračují v konkomitantní léčbě a skupinu, u níž byl AZA vysazen. Po půl roce sledování bylo procento relapsů srovnatelné [38]. Ve srovnání s evropskou praxí jsou thiopuriny v kombinaci s IFX v terapii pediatrických pacientů s IBD v USA výrazněji méně rozšířeny [39]. Nejen z těchto důvodů pak i některá evropská doporučení považují zvážení vysazení AZA po 6 měsících konkomitantní terapie u pacientů v remisi CD (především u adolescentních chlapců vzhledem k riziku vzniku hepatosplenického T-buněčného lymfomu) za opodstatněné [19,25,35,40]. Pokud došlo ke ztrátě odpovědi na léčbu IFX (v monoterapii) z důvodu vytvoření anti-IFX, bylo popsáno několik případů, u nichž opětovné nasazení imunosupresiva (např. AZA) vedlo k obnovení odpovědi na léčbu doprovázené poklesem vytvořených protilátek [41].
Podobně jako v případě IFX může přidání imunosupresiva do terapie vést k reverzní sérokonverzi – tedy eliminaci protilátek proti ADA (anti-ADA) – až v téměř 50 % případů (retrospektivní studie na 23 dospělých pacientech) [42]. Retrospektivní studie 207 dospělých pacientů s CD však neprokázala rozdíl v dosažení remise mezi pacienty léčenými adalimumabem (ADA) v monoterapii a v kombinaci s AZA (82 vs. 85 %) [43]. Ani prospektivní randomizovaná studie z roku 2016 zabývající se CD u dospělých pacientů (n = 176) neprokázala přidanou hodnotu konkomitantní terapie v prvním půl roce léčby (78,1 vs. 68,1 % pacientů v remisi) [44].
Přídavný efekt imunosupresiva (včetně thiopurinových léčiv) nebyl prokázán ani při terapii (v pediatrii zatím omezeně dostupným) vedolizumabem – kombinace vs. monoterapie [45–47].
Nežádoucí účinky
Jedním z omezení léčby AZA/6-MP jsou její nežádoucí účinky (NÚ), které se u dospělých pacientů s IBD vyskytují v 15–40 %. V 5–28 % všech léčených pacientů vedou NÚ ke snížení dávky podávaného léčiva a v 11–31 % je nutné léčbu úplně přerušit [1,5,27,48–53]. U pediatrické populace se NÚ thiopurinů obecně vyskytují s nižší četností, než je tomu u dospělých pacientů (přibližně v 15 %), studií zabývajících se problematikou u dětí je však nepoměrně méně [27,54]. NÚ thiopurinových léčiv lze rozdělit na závislé na dávce (myelotoxicita, hepatotoxicita) a idiosynkratické – nezávislé na dávce (alergické kožní reakce, nauzea, únavnost, nechutenství, pankreatitida). Zatímco idiosynkratické NÚ se většinou objeví v prvních týdnech od zahájení terapie, a pokud je lék dobře tolerován po 3 týdnech léčby, obvykle se předpokládá jeho dlouhodobá tolerance, NÚ závislé na dávce se mohou objevit i po měsících až letech užívání léku [19–21,55].
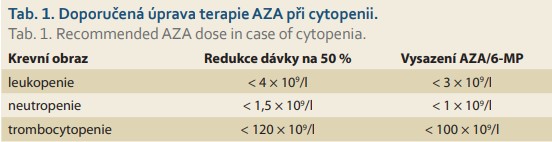
Posoudit výskyt závažné leukopenie (myelotoxicity) na léčbě thiopuriny je obtížné, neboť rozdílné studie užívají rozdílných cut-off hodnot a i délka sledování pacientů se liší [52], většinou je však udávána četnost kolem 3–15 % [5,19,20,48,49,53,55]; výskytu u dětí pak odpovídá spíše dolní hranice daného rozmezí (tj. okolo 3 %) [54]. Lymfopenii a potažmo též mírnější leukopenii lze do určité míry považovat za chtěný účinek léčby. Oproti tomu neutropenii lze za NÚ na dávce závislý považovat. Neutropenie postihne přibližně 2–3 % pacientů [48,51,56], dostupná data však nelze považovat za dostačující, protože studie většinou posuzují neutropenii a leukopenii společně. Trombocytopenie se objeví u 2–3 % pacientů [48,52,53]. Výsledný krevní obraz ovlivňuje kromě léčby také aktivita onemocnění a další faktory – především konkomitantní virové infekce [57]. Ve většině případů se počet bílých krvinek, neutrofilů, trombocytů i lymfocytů upraví spontánně bez nutnosti zásahu, po snížení dávky či úplném vyřazení léku [51]. Byl však popsán i případ, kdy trombocytopenie přetrvávala po dobu 2 let i přes ukončení terapie AZA [53]. Přibližně v 1/4 případů je pak leukopenie asociována se sníženou aktivitou enzymu podílejícím se na thiopurinovém metabolizmu – TPMT [55,58]. Těžkou myelosupresí jsou nejvíce ohroženi recesivní homozygoté, u nichž je možné, v případě jejich včasné identifikace, ohrožující AZA indukované cytopenii předcházet [59,60]. U heterozygotů se případná cytopenie rozvine v průměru dříve (v prvním trimestru od zahájení terapie) než u dominantních homozygotů (měsíce až roky) [61]. V případě dostatečné aktivity TPMT je vhodné zvážit probíhající infekci jako možnou příčinu (tranzientní) leukopenie. Leukopenie je pouze přibližně v 1/4 případů asociována se sníženou funkcí TPMT [62], čehož lze využít v identifikaci velmi rizikových pacientů. Vzhledem ke zbývajícím 3/4 se v predikci výskytu leukopenie však nelze spoléhat pouze na vyšetření aktivity TPMT (ať už genotypu, nebo fenotypu) a je potřeba pacienty pečlivě monitorovat (pravidelné vyšetření krevního obrazu). V případě výrazného poklesu počtu leukocytů (a/nebo trombocytů) je pak dle doporučení vhodné dávku léčiva snížit a/nebo lék úplně vysadit (tab. 1). V první linii, pokud není pokles příliš výrazný, může být tato změna pouze přechodná a po úpravě parametrů krevního obrazu se lze pokusit o opětovné navrácení léku do terapie v plné dávce, samozřejmě za pečlivé kontroly pacienta [22,25].
Zvýšené hodnoty transamináz pozorované u 2–17 % dospělých pacientů léčených thiopuriny vždy neznačí těžké jaterní poškození [5,48,49,51,53]. Výsledná četnost tohoto NÚ opět závisí na cut-off hodnotách užitých v jednotlivých studiích i délce sledování pacienta. V naprosté většině případů se v horizontu nanejvýš několika týdnů vrátí hodnoty transamináz do normálních rozmezí spontánně, bez nutnosti změny terapie, po snížení dávky nebo přerušení/ukončení léčby thiopuriny [48,50,61]. V případě zaznamenání laboratorní elevace transamináz je možné (pokud se nejedná o příliš výrazný vzestup) se pokusit nějakou dobu vyčkat na stávající dávce či snížit dávku léčiva o 25–50 %, podmínkou je pravidelná laboratorní monitorace pacienta à 1 týden do normalizace hodnot [48,50]. Případně je možné se pokusit o změnu thiopurinového preparátu – dle studie z roku 2013 až 80 % pacientů s projevy hepatotoxicity při léčbě AZA dobře toleruje 6-MP [63]. Pokud však laboratorní nález přetrvává či jsou jaterní funkce výrazněji alterovány, je vhodné pátrat po jiné příčině. V této souvislosti je vhodné pomýšlet i na nodulární regenerativní hyperplazii (NRH). Přestože se zvýšené riziko vzniku NRH pojí především s léčbou 6-thioguaninem (6-TG) – dalším z thiopurinů, který je z tohoto důvodu v terapii IBD spíše opomíjen – bylo u dospělých pacientů popsáno několik případů NRH asociovaných s AZA [64,65].
Akutní pankreatitidu řadíme mezi NÚ na dávce nezávislé a považujeme ji za reakci hypersenzitivity [19]. V dospělé populaci i u dětí se vyskytuje přibližně u 2–7 % pacientů [48,49,53,54,57,66] ve většině případů v 1. měsíci léčby [27,67] a je častější u kuřáků [52]. Pouhá elevace pankreatických enzymů bez diagnózy pankreatitidy (nesplňující diagnostická kritéria) se vyskytuje mnohem častěji – u dospělých až v 16 % [49,53]. Mezi Asiaty je zánět slinivky břišní jako NÚ terapie thiopuriny spíše vzácný [68]. Akutní pankreatitida se u pacientů s CD vyskytuje častěji než u pacientů léčených thiopuriny z jiné indikace [67], velmi pravděpodobně za určitou část onemocnění slinivky břišní je u těchto pacientů zodpovědná CD sama o sobě (duodenální postižení nebo extraintestinální manifestace), případně konkomitantní terapie (např. aminosalyciláty nebo výlučná enterální výživa) [19,69]. Jako rizikové pro vznik AZA indukované pankreatitidy byly recentně popsány genotypy HLA-DQA1*02: 01-HLA-DRB1*07:01 v heterozygotní A/C a homozygotní C/C formě [70]. Akutní zánět slinivky indukovaný thiopuriny je ve většině případů pouze mírný a rychle ustoupí po vysazení terapie [69]. Pokud se u pacienta vyskytne AZA indukovaná pankreatitida, je tedy vhodné tento lék okamžitě vysadit, v tomto případě však není po ústupu symp- tomů většinou doporučováno pokoušet se o opětovné navrácení thiopurinů do terapie, tedy ani 6-MP [19,22,25,71]. Bylo však publikováno několik případů, kdy taková změna terapie byla úspěšná, zánět slinivky se u pacientů po zahájení léčby 6-MP znovu neobjevil a pacienti dále lék dobře tolerovali [72,73]
Gastrointestinální intolerance (průjem, zvracení, bolesti břicha) se projeví u 4–10 % léčených dospělých [5,48,49, 56,57]. Vzhledem k tomu, že pacienti s těmito projevy na terapii AZA ve vysokém procentu dobře tolerují 6-MP, se někteří autoři domnívají, že za část této intolerance i dalších časných idiosynkratických NÚ je zodpovědné imidazolové jádro odštěpené z AZA při přeměně na 6-MP [74]. Takzvané chřipkové příznaky („flu-like“ syndrom – myalgie, artralgie, horečka, nevolnost, bolesti hlavy) se objevují především ve 2.–3. týdnu léčby [20,21] a zakusí je kolem 8–13 % dospělých pacientů, u dětí se objevují přibližně v 7 %. Kterýkoli z těchto symptomů se může projevit osamoceně nebo společně s jiným NÚ [19,22,49,53]. Mezi další možné na dávce nezávislé NÚ patří kožní reakce v podobě rashe, alopecie a alergické reakce [1,51,75].
Gastrointestinální obtíže vymizí rychle po vysazení terapie stejně jako většina ostatních NÚ. V případě idiosynkratických NÚ vzniklých na terapii AZA je možno se pokusit o změnu terapie na 6-MP, která je úspěšná přibližně v 50 %, ačkoli dostupná data se různí. Nejlepších výsledků dosahuje tato změna u myalgií a artralgií, ale i u gastrointestinálních příznaků či „chřipkových“ symptomů může být relativně často úspěšná (kolem 20–30 %). V případech, kdy se změna terapie nezdaří a u pacienta se opět objeví vedlejší účinky, jedná se v 60 % o stejný NÚ, pro který byl AZA vysazen [19,22,27,74,63,71,76]. Dle studie z roku 2004 lze za část NÚ (především flu-like syndromu, pankreatitidy, rashe) podezřívat polymorfizmus v genu kódujícím inosintrifosfatázu, konkrétně 94C>A, a bylo navrženo, aby byl takovým pacientům v případě intolerance AZA/6-MP podáván 6-thioguanin (6-TG) [77]. V jiné studii ale asociace nebyla pozorována [78].
Pacienti léčení thiopuriny mohou být náchylnější k infekcím – častěji virovým, ale objevit se mohou i infekce bakteriální či mykotické. Riziko roste s množstvím podávaných imunosupresivních léků a je vyšší ve skupině starších pacientů [48,79–81]. Infekce bývají většinou pouze mírné – např. u pacientů léčených AZA byl popsán častější výsev herpes simplex (HSV) labialis/genitalis a virových bradavic než u pacientů AZA naivních [82]. Data z registrů shromažďujících informace o dětské (DEVELOP) i dospělé (TREAT) populaci pacientů s CD zvýšené riziko závažných infekčních komplikací u pacientů léčených thiopuriny neprokázala – na rozdíl od skupiny na biologické terapii anti-TNF preparáty nebo jedinců léčených systémovými kortikosteroidy [83,84].
Prevence infekcí je u jedinců užívajících imunosupresivní terapii vhodná [85]. Před zahájením terapie thiopuriny je vhodné zkontrolovat a eventuálně doplnit povinná očkování, pokud to klinický stav při základním onemocnění dovolí. Očkování živou vakcínou (především očkovací látky proti spalničkám, zarděnkám, příušnicím, planým neštovicím, případně tuberkulóze – BCG) je možné s odstupem 6 týdnů před zahájením imunosupresivní léčby nebo alespoň 3 měsíce po jejím ukončení. Na druhou stranu odklad léčby, která je nezbytně nutná pro kontrolu onemocnění, z důvodů doplnění vakcinace není považován za vhodný. Aktivní imunizace neživými vakcínami (včetně očkování proti lidskému papilomaviru – HPV) není kontraindikována, naopak se spíše doporučuje, přestože její účinnost může být snížena [20–22,80,86].
U varicella zoster virus (VZV) naivních, neimunizovaných, imunosupresivy léčených pacientů je v případě kontaktu s varicellou k dispozici pasivní imunizace, v případě propuknutí planých neštovic je indikována časná antivirová terapie. V případě opakovaných lokálních výsevů herpes simplex virus (HSV) labialis/genitalis je vhodné zvážit perorální antivirotickou terapii v době aktivního výsevu. V případě těžkého onemocnění je vhodné okamžitě zahájit antivirotickou terapii a imunosupresiva dočasně vysadit – podobně je tomu také v případě těžší formy infekční mononukleózy. Je vhodné zvážit očkování proti pneumokokovým onemocněním a chřipce [21,22,80].
Thiopurinová terapie zvyšuje riziko rozvoje lymfomu u pacientů s IBD přibližně 4–5krát. Ohrožena je především starší populace, v mladším věku je riziko lymfomu nižší – v dětské populaci přibližně 4,5 případů/10 tisíc paciento-roků léčby. Riziko narůstá s délkou léčby a klesá po jejím ukončení [87–92]. Vzácnou formu neléčitelného lymfomu představuje u pacientů s IBD léčených imunosupresivy hepatosplenický T-buněčný lymfom (HSTCL). V naprosté většině případů byl HSTCL popsán u mužů mladších 35 let, v 50 % dokonce 20 let (byl tedy popsán výskyt i v pediatrické populaci). V polovině případů je jeho výskyt asociován s kombinovanou terapií biologické léčby a thiopurinu, v druhé (téměř) polovině pak s AZA/6-MP v monoterapii. Pouze ojediněle je pak HSCTL asociován pouze s preparáty z řad biologické léčby [92–94]. Do skupiny lymfomů vzniklých na thiopurinové léčbě patří i vzácně se vyskytující s virem Ebsteina a Barrové (EBV) asociovaný lymfom, jehož riziko výskytu thiopuriny mírně zvyšují [95]. Mezi mladšími jedinci (včetně pediatrické populace) převyšuje pozitivní vliv terapie na udržení remise i na celkovou kvalitu života pacienta zvýšené riziko rozvoje lymfomu [88,89,96]. Nadto thiopuriny působí protektivně proti rozvoji kolorektálního karcinomu u pacientů s CD i UC – snižují riziko výskytu, které je u pacientů s IBD zvýšené [97].
Ve skupině pacientů, kteří jsou nebo v minulosti byli léčeni thiopurinovými preparáty, stoupá riziko výskytu nádorových onemocnění kůže nemelanomového typu – karcinomů (bazaliomu a dlaždicobuněčného karcinomu). Riziko je zvýšené i mezi jedinci mladšími 50 let [3,98,99]. Všichni pacienti, kteří byli někdy léčeni thiopuriny, by měli být celoživotně sledováni dermatologem a svou kůži dostatečně chránit proti UV záření [3,19,25].
Závěr
Azathioprin (AZA) stále zastává v udržovací terapii dětských pacientů s IBD své pevné místo. Stanovením aktivity TPMT před zahájením léčby a pečlivou pravidelnou monitorací pacientů lze předcházet mnohým z jeho nežádoucích účinků. V případě na dávce nezávislých nežádoucích účinků pak má význam pokusit se o změnu léčiva i v rámci skupiny (z AZA na 6-MP).
Doplnění terapie o AZA vede při léčbě anti-TNF k nižší tvorbě protilátek proti biologiku. Současný trend se v případě IFX kloní ke konkomitantnímu podávání AZA v prvních měsících terapie, při léčbě ADA se dle dostupných dat jeví současná terapie thiopuriny jako opodstatněná především v případě vytvoření protilátek proti ADA.
ORCID autorů
K. Pospíšilová ORCID 0000-0002-6850-5588,
J. Bronský ORCID 0000-0002-2641-7280.
Doručeno/Submitted: 2. 8. 2021
Přijato/Accepted: 29. 11. 2021
MUDr. Kristýna Pospíšilová
Oddělení dětské gastroenterologie
Pediatrická klinika
2. LF UK v Praze a FN v Motole
V Úvalu 84/1
150 06 Praha 5
potuznikovakris@gmail.com
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Prefontaine E, Sutherland LR, MacDonald JK et al. Azathioprine or 6-mercaptopurine for maintenance of remission in Crohn‘s disease. Cochrane Database Syst Rev 2010; 1: CD000067. doi: 10.1002/14651858.CD000067.pub3.
2. Ramadas AV, Gunesh S, Thomas GA et al. Natural history of Crohn‘s disease in a population-based cohort from Cardiff (1986–2003): a study of changes in medical treatement and surgical resection rates. Gut 2010; 59(9): 1200–1206. doi: 10.1136/gut.2009.202101.
3. Peyrin-Biroulet L, Oussalah A, Williet N et al. Impact of azathioprine and tumour necrosis factor antagonists on the need for surgery in newly diagnosed Crohn‘s disease. Gut 2011; 60(7): 930–936. doi: 10.1136/gut.2010.227884.
4. Cleynen I, Ganzales JR, Figueroa C et al. Genetic factors conferring an increased susceptibility to develop Crohn‘s disease also influence disease phenotype: results from IBSchip European project. Gut 2013; 62(11): 1556–1565. doi: 10.1136/gutjnl-2011-300777.
5. Fraser AG, Orchard TR, Jewell DP. The efficacy of azathioprine for the treatement of inflammatory bowel disease: a 30 year review. Gut 2002; 50(4): 485–489. doi: 10.1136/gut.50.4.485.
6. Cosnes J, Bourier A, Laharie D et al. Early administration of azathioprine vs conventional management of Crohn‘s disease: a randomized controlled trial. Gastroenterol 2013; 145(4): 758–765. doi: 10.1053/j.gastro.2013.04.048.
7. Panés J, López-Sanromán A, Bermejo A et al. Early azathioprine therapy is no more effective than placebo for newly diagnosed Crohn‘s disease. Gastroenterol 2013; 145(4): 766–774. doi: 10.1053/j.gastro.2013.06.009.
8. Pearson DC, May GR, Fick GH et al. Azathioprine and 6-mercaptopurine in Crohn disease. Ann Intern Med 1995; 123(2): 132–142. doi: 10.7326/0003-4819-123-2-199507150-00009.
9. Markowitz J, Grancher K, Kohn N et al. A multicenter trial of 6-mercaptopurine and prednisone in children with newly diagnosed Crohn‘s disease. Gastroenterol 2000; 119(4): 895–902. doi: 10.1053/gast.2000.18144.
10. Barabino A, Torrente F, Ventura A et al. Azathioprine in paediatric inflammatory bowel disease: an Italian multicentre survey. Aliment Pharmacol Ther 2002; 16(6): 1125–1130. doi: 10.1046/j.1365-2036.2002.01269.x.
11. Punati J, Markowitz J, Lerer T et al. Effect of early immunomodulator use in moderate to severe pediatric Crohn disease. Inflamm Bowel Dis 2008; 14(7): 949–954. doi: 10.1002/ibd.20412.
12. Riello L, Talbotec C, Garnier-Lengliné H et al. Tolerance and efficacy of azathioprine in pediatric Crohn‘s disease. Inflamm Bowel Dis 2011; 17(10): 2138–2143. doi: 10.1002/ibd.21612.
13. Timmer A, Patton PH, Chande N et al. Azathioprine and 6-mercaptopurine for maintenance of remission in ulcerative colitis. Cochrane Database Syst Rev 2016; 2016(5): CD000478. doi: 10.1002/14651858.CD000478.pub4.
14. Gisbert JP, Nino P, Cara C et al. Comparative effectivenes of azathioprine in Crohn‘s disease and ulcerative colitis: prospective, long-term, follow-up study of 394 patients. Aliment Pharmacol Ther 2008; 28(2): 228–238. doi: 10.1111/j.1365-2036.2008.03732.x.
15. Verhave M, Winter HS, Grand RJ. Azathioprinein the treatement of children with inflammatory bowel disease. J Pediatr 1990; 117(5): 809–814. doi: 10.1016/s0022-3476 (05) 83349-9.
16. Kader HA, Mascarenhas MR, Piccoli DA et al. Experiences with 6-mercaptopurine and azathioprine therapy in pediatric patients with severe ulcerative colitis. Gastroenterol Nutr 1999; 28(1): 54–58. doi: 10.1097/00005176-19 9901000-00013.
17. Hyams JS, Lerer T, Mack D et al. Outcome following thiopurine use in children with ulcerative colitis: a prospective multicenter registry study. Am J Gastroenterol 2011; 106(5): 981–987. doi: 10.1038/ajg.2010.493.
18. Khan N, Dubinsky MC, Ford AC et al. Efficacy of immunosuppresive therapy for inflammatory bowel disease: a systematic review and meta-analysis. Am J Gastroenterol 2011; 106(4): 630–642. doi: 10.1038/ajg.2011.64.
19. Ruemmelle FM, Veres G, Kolho KL et al. Consensus guidelines of ECCO/ESPHGAN on the medical management of pediatric Crohn‘s disease. J Crohns Colitis 2014; 8(10): 1179–1207. doi: 10.1016/j.crohns.2014.04.005.
20. Adamcová M, Bajer M, Bajerová K et al. Doporučení Pracovní skupiny dětské gastroenterologie a výživy ČPS pro diagnostiku a léčbu nespecifických střevních zánětů u dětí. Čes-slov Pediat 2012; 67(Suppl 2): S5–S47.
21. Bronský J, Beránková K, Černá Z et al. Doporučení Pracovní skupiny dětské gastroenterologie a výživy ČPS pro diagnostiku a léčbu nespecifických střevních zánětů u dětí – doplněk k 1. vydání. Gastroent Hepatol 2017; 71(1): 11–18. doi: 10.14735/amgh201711.
22. Turner D, Levine A, Escher JC et al. Management of pediatric ulcerative colitis: joint ECCO and ESPHGAN evedence-based consensus guidelines. J Pediatr Gastroenterol Nutr 2012; 55(3): 340–361. doi: 10.1097/MPG.0b013e3182662233.
23. Pozler O, Chládek J, Malý J et al. Steady-state of azathioprine during initiation treatement of pediatric inflammatory bowel disease. J Crohns Colitis 2010; 4(6): 623–628. doi: 10.1016/j.crohns.2010.06.005.
24. Louis E, Belaiche J. Optimizing treatement with thioguanine derivates in inflammatory bowel disease. Best Pract Res Clin Gastroenterol 2003; 17(1): 37–46. doi: 10.1053/bega.2002.0346.
25. Turner D, Ruemmele FM, Orlanski-Meyer E et al. Management of paediatric ulcerative colitis, part 1: ambulatory care- an evidence-based guideline from ECCO and ESPGHAN. J Pediatr Gastroenterol Nutr 2018; 67(2): 257–291. doi: 10.1097/MPG.0000000000002035.
26. Van Os EC, J A McKinney JA, Zins BJ et al. Simultaneous determination of azathioprine and 6-mercaptopurine by high-performance liquid chromatography. J Chromatogr B Biomed Appl 1996; 679(1–2): 147–154. doi: 10.1016/0378-4347(96)00007-2.
27. Hindorf U, Lindqvist M, Hildebrand H et al. Adverse events leading to modification of therapy in a large cohort of patients with inflammatory bowel disease. Aliment Pharmacol Ther 2006; 24(2): 331–342. doi: 10.1111/j.1365-2036.2006.02977.x.
28. Stocco G, Martelossi S, Arrigo S et al. Multicentric case-control study on azathioprine dose and pharmacokinetics in early-onset pediatric inflammatory bowel disease. Inflamm Bowel Dis 2017; 23(4): 628–634. doi: 10.1097/MIB.0000000000001051.
29. Grossman AB, Noble AJ, Mamula P et al. Increased dosing requirements for 6-mercaptopurine and azathioprine in inflammatory bowel disease patients six years and younger. Inflamm Bowel Dis 2008; 14(6): 750–755. doi: 10.1002/ibd.20387.
30. Luan ZJ, Li Y, Zhao XY et al. Treatment efficacy and safety of low-dose azathioprine in chronic active ulcerative colitis patients: a meta-analysis and systemic review. J Dig Dis 2016; 17(10): 652–659. doi: 10.1111/1751-2980.12386.
31. Ansari A, Hassan C, Duley J et al. Thiopurine methyltransferase activity and the use of azathioprine in inflammatory bowel disease. Aliment Pharmacol Ther 2002; 16(10): 1743–1750. doi: 10.1046/j.1365-2036.2002.01353.x.
32. Schaeffeler E, Fisher C, Dierk B et al. Comprehensive analysis of thiopurine S-methyltransferase phenotype-genotype correlation in a large population of German-Caucasians and identification of novel TPMT variants. Pharmacogenetics 2004; 14(7): 407–417. doi: 10.1097/01.fpc.0000114745.08559.db.
33. Winter JW, Gaffney D, Shapiro D et al. Assesment of thiopurine methyltransferase nezyme activity is superior to genotpye in predicting myelosuppresion following azathioprine therapy in patients with inflammatory bowel disease. Aliment Pharmacol Ther 2007; 25(9): 1069–1077. doi: 10.1111/j.1365-2036.2007.03301.x.
34. Jones J, Kaplan GG, Peyrin-Biroulet L et al. Effects of concomitant immunomodulator therapy on efficacy and safety of anti-tumor necrosis factor therapy for Crohn‘s disease: a meta-analysis of placebo-controlled trials. Clin Gastroenterol Hepatol 2015; 13(13): 2233–2240. doi: 10.1016/j.cgh.2015.06.034.
35. Colombel JF, Sandborn WJ, Reinisch W et al. Infliximab, azathioprine, or combination therapy for Crohn‘s disease. N Engl J Med 2010; 362(15): 1383–1395. doi: 10.1056/NEJMoa0904492.
36. Panaccione R, Ghosh S, Middleton S et al. Infliximab, azathioprine or infliximab + azathioprine for treatment of moderate to severe ulcerative colitis. The UC SUCCESS trial. Gastroenterology 2011; 5(1): S8.
37. Van Assche G, Magdelaine-Beuzelin C, D‘Haens G et al. Withdrawal of immunosuppression in Crohn‘s disease treated with scheduled infliximab maintenance: a randomized trial. Gastroenterology 2008; 134(7): 1861–1868. doi: 10.1053/j.gastro.2008.03.004.
38. Kierkus J, Iwanczyk B, Wegner A et al. Efficacy infliximab with immunomodulator and infliximab alone of maintenance therapy in children with Crohn‘s disease – multicenter randomized study. J Crohns Colitis 2013; 7: 220–221.
39. Church PC, Hyams J, Ruemmele F et al. The continental divide anti-TNF use in pediatric IBD is different in North America compared to other parts of the world. Can J Gastroenterol Hepatol 2018; 2018: 3190548. doi: 10.1155/2018/3190548.
40. Pariente B, Laharie E. Review article: why, when and how to de-escalate therapy in inflammatory bowel diseases. Aliment Pharmacol Ther 2014; 40(4): 338–353. doi: 10.1111/apt.12838.
41. Ben-Horin S, Waterman M, Kopylov U et al. Addition of an immunomodulator to infliximab therapy eliminates antidrug antibodies in serum and restores clinical response of patients with inflammatory bowel disease. Clin Gastroenterol Hepatol 2013; 11(4): 444–447. doi: 10.1016/j.cgh.2012.10.020.
42. Ungar B, Kopylov U, Engel T et al. Addition of an immunomodulator can reverse antibody formation and loss of response in patients treated with adalimumab. Aliment Pharmacol Ther 2017; 45(2): 276–282. doi: 10.1111/apt.13862.
43. Reenaers C, Louis E, Belaiche J et al. Does co-treatment with immunosuppressors improve outcome in patients with Crohn‘s disease treated with adalimumab? Aliment Pharmacol Ther 2012; 36(11–12): 1040–1048. doiI: 10.1111/apt.12076.
44. Matsumoto T, Motoya S, Watanabe K et al. Adalimumab monotherapy and a combination with azathioprine for Crohn’s disease: a prospective randomized trial. J Crohns Colitis 2016; 10(11): 1259–1266. doi: 10.1093/ecco-jcc/jjw152.
45. Dulai PS, Singh S, Jiang X et al. The real-world effectiveness and safety of vedolizumab for moderate-severe Crohn‘s disease: results from the US VICTORY consortium. Am J Gastroenterol 2016; 111(8): 1147–1155. doi: 10.1038/ajg.2016.236.
46. Shelton E, Allegretti JR, Stevens B et al. Efficacy of vedolizumab as induction therapy in refractory IBD patients: a multicenter cohort. Inflamm Bowel Dis 2015; 21(12): 2879–2885. doi: 10.1097/MIB.0000000000000561.
47. Ledder O, Assa A, Levine A et al. Vedolizumab in paediatric inflammatory bowel disease: a retrospective multi-centre experience from the paediatric IBD Porto group of ESPGHAN. J Crohn Colitis 2017; 11(10): 1230–1237. doi: 10.1093/ecco-jcc/jjx082.
48. Kirschner BS. Safety of azathioprine and 6-mercaptopurine in pediatric patients with inflammatory bowel disease. Gastroenterol 1998; 115(4): 813–821. doi: 10.1159/000140974.
49. Costantino G, Furfaro F, Belvedere A et al. Thiopurine treatement in inflammatory bowel disease: response predictors, safety, and witchdrawal in follow-up. J Crohns Colitis 2012; 6(5): 588–596. doi: 10.1016/j.crohns.2011.11.007.
50. Gearry RB, Barclay ML, Burt MJ et al. Thiopurine drug adverse effects in a population of New Zealand patients with inflammatory bowel disease. Pharmacoepidemiol Drug Saf 2004; 13(8): 563–567. doi: 10.1002/pds.926.
51. Qiu Y, Mao R, Zhang S et al. Safety profile of thiopurines in Crohn disease: analysis of 893 patient-years follow-up in a Southern China cohort. Medicine 2015; 94(41): e1513. doi: 10.1097/MD.0000000000001513.
52. Lopéz-Martín C, Chaparro M, Espinosa L et al. Adverse events of thiopurine immunomodulators in patients with inflammatory bowel disease. Gastroenterol Hepatol 2011; 34(6): 385–392. doi: 10.1016/j.gastrohep.2011.03.023.
53. Goldberg R, Irving PM. Toxicity and response to thiopurines in patients with inflammatory bowel disease. Exp Rev Gastroenterol Hepatol 2015; 9(7): 891–900. doi: 10.1586/17474124.2015.1039987.
54. De Ridder L, Van Dieren JM, Van Deverten HJH et al. Pharmacogenetics of thiopurine therapy in paediatric IBD patients. Aliment Pharmacol Ther 2006; 23(8): 1137–1141. doi: 10.1111/j.1365-2036.2006.02853.x.
55. Bär F, Sina C, Fellermann K. Thiopurines in inflammatory bowel disease revisited. World J Gastroenterol 2013; 19(11): 1699–1706. doi: 10.3748/wjg.v19.i11.1699.
56. Kim MJ, Lee SY, Choe YH. Monitoring thiopurine metabolites in korean pediatric patients with inflammatory bowel disease. Yonsei Med J 2014; 55(5): 1289–1296. doi: 10.3349/ymj.2014.55.5.1289.
57. Schwab M, Schäffeler E, Marx C et al. Azathioprine therapy and adverse drug reactions in patients with inflammatory bowel disease: impact of thiopurine S-methyltransferase polymorphism. Pharmacogenetics 2002; 12(6): 429–436. doi: 10.1097/00008571-200208000-00003.
58. Colombel JF, Ferrari N, Debuysere H et al. Genotypic analysis of thiopurine S-methyltransferase in patients with Crohn‘s disease and severe myelosuppresion during azathioprine therapy. Gastroenterology 2000; 118(6): 1025–1030. doi: 10.1016/s0016-5085(00)70354-4.
59. Lennard L. TPMT in the treatement of Crohn‘s disease with azathioprine. Gut 2002; 51(2): 143–146. doi: 10.1136/gut.51.2.143.
60. Leipold G, Schütz E, Haas JP et al. Azathioprine-induced severe pancytopenia due to homozygous two-point mutation of the thiopurine methyltransferase gene in patient with juvenile HLA-B27_asociated spondylarthritis. Artritis Rheum 1997; 40(10): 1896–1898. doi: 10.1002/art.1780401026.
61. Dubinsky MC, Lamothe S, Ying Yang G et al. Pharmacogenomics and metabolite measurement for 6-mercaptopurine therapy in inflammatory bowel disease. Gastroenterol 2000; 118(4): 705–713. doi: 10.1016/s0016-5085(00)70140-5.
62. Dubinsky CM. Azathioprine, 6-mercaptopurine in inflammatory bowel disease: pharmacology, efficacy, and safety. Clin Gastroenterol Hepatol 2004; 2(9): 731–743. doi: 10.1016/s1542-3565(04)00344-1.
63. Kenedy NA, Ratigan E, Arnott IDR et al. A trial of mercaptopurine is a safe strategy in patients with inflammatory bowel disease intolerant to azathioprine: an observational study, systematic review and meta-analysis. Aliment Pharmacol Ther 2013; 38(10): 1255–1266. doi: 10.1111/apt.12511.
64. Vernier-Massouille G, Cosnes J, Lemann M et al. Nodular regenerative hyperplasia in patients with inflammatory bowel disease treted with azathioprine. Gut 2007; 56(10): 1404–1409. doi: 10.1136/gut.2006.114363.
65. Seiderer J, Zech CJ, Diebold J et al. Nodular regenerative hyperplasia: a reversible entity associated with azathioprine therapy. Eur J Gastroenterol Hepatol 2006; 18(5): 553–555. doi: 10.1097/00042737-200605000-00018.
66. Meyer L, Simian D, Lubascher J et al. Eventos adversos en la terapia farmacológica de la enfermedad inflamatoria intestinal. Rev Med Chile 2015; 143(1): 7–13. doi: 10.4067/S0034-98872015000100001.
67. Weersma RK, Peters FTM, Oostenburg LE et al. Increased incidence of azathioprine-induced pancreatitis in Crohn‘s disease compared with other diseases. Aliment Pharmacol Ther 2004; 20(8): 843–850. doi: 10.1111/j.1365-2036. 2004.02197.x.
68. Fanbing Z, Xiang G, Liang D et al. Prospective evaluation of pharmacogenomics and metabolite measurements upon azathioprine therapy in inflammatory bowel disease. Medicine 2016; 95(15): e3326. doi: 10.1097/MD. 0000000000003326.
69. Bermejo F, Lopez-Sanroman A, Taxonera C et al. Acute pancreatitis in inflammatory bowel disease, with special reference to azathioprine-induced pancreatitis. Aliment Pharmacol Ther 2008; 28(5): 623–628. doi: 10.1111/j.1365-2036.2008.03746.x.
70. Wilson A, Jansen LE, Rose RV et al. HLA-DQA1-HLA-DRB1 polymorfism is a major predictor of azathioprine-induced pancreatitis with inflammatory bowel disease. Aliment Pharmacol Ther 2017; 47(5): 615–620. doi: 10.1111/apt.14483.
71. Hindorf U, Johansson M, Eriksson A et al. Mercaptopurine treatement should be considered in azathioprine intolerant patients with inflammatory bowel disease. Aliment Pharmacol Ther 2009; 29(6): 654–661. doi: 10.1111/j.1365-2036.2008.03925.x.
72. Gallego-Gutiérrez S, Navas-Lopéz VM, Kolorz M et al. Successful mercaptopurine usage despite azathioprine-induced pancreatitis in paediatric Crohn‘s disease. J Crohns Colitis 2015; 9(8): 676–679. doi: 10.1093/ecco-jcc/jjv086.
73. Ledder OD, Lemberg DA, Ooi CY et al. Are thiopurines always contraindicated after thiopurine-induced pancreatitis in inflammatory bowel disease. J Pediatr Gastroenterol Nutr 2013; 57(5): 583–586. doi: 10.1097/MPG.0b013e31829f16fc.
74. Lees CW, Maan AK, Hansoti B et al. Tolerability and safety of mercaptopurine in azathioprine-intolerant patients with inflammatory bowel disease. Aliment Pharmacol Ther 2008; 27(3): 220–227. doi: 10.1111/j.1365-2036.2007.03570.x.
75. Schwab M, Klotz U. Pharmacokinetic considerations in the treatement of inflammatory bowel disease. Clin Pharmacokinet 2001; 40(10): 723–751. doi: 10.2165/00003088-200140100-00003.
76. Doménech E, Nos P, Papo M et al. 6-mercaptopurine in patients with inflammatory bowel disease and previous digestive intolerance of azathioprine. Scand J Gastroenterol 2005; 40(1): 50–52. doi: 10.1080/00365520410009492.
77. Marinaki AM, Ansari A, Duley JA et al. Adverse drug reactions to azathioprine therapy are associated with polymorphism in the gene encoding inosine triphosphate pyrophosphatase (ITPase). Pharmacogen 2004; 14(3): 181–187. doi: 10.1097/00008571-200403000-00006.
78. Gearry RB, Roberts RL, Barclay ML et al. Lack of association between the ITP 94C>A polymorphism and adverse effects from azathioprine. Pharmacogenetics 2004; 14(11): 779–781. doi: 10.1097/00008571-200411000-00010.
79. Toruner M, Loftus EV, Harmsen WS et al. Risk factors for opportunistic infections in patietnts with inflammatory bowel disease. Gastroenterol 2008; 134(4): 929–936. doi: 10.1053/j.gastro.2008.01.012.
80. Rahier JF, Ben-Horin S, Chowers Y et al. European evidence-based Consensus on the prevention, diagnosis and management of opportunistic infections in inflammatory bowel disease. J Crohns Colitis 2009; 3(2): 47–91. doi: 10.1016/j.crohns.2009.02.010.
81. Kirchgesner J, Lemaitre M, Carrat F et al. Risk of serious and opportunistic infections associated with treatment of inflammatory bowel disease. Gastroenterology 2018; 155(2): 337–346. doi: 10.1053/j.gastro.2018.04.012.
82. Seksik P, Cosnes J, Sokol H et al. Incidence of benign upper respiratory tract infections, HSV and HPV cutaneous infections in inflamatory bowel disease patients treated with azathioprine. Aliment Pharmacol Ther 2009; 29(10): 1106–1113. doi: 10.1053/j.gastro.2018.04.012.
83. Lichtenstein GR, Feagan BG, Cohen RD et al. Serious infection and mortality in patients with Crohn‘s disease: more than 5 years of follow-up in the TREAT registry. Am J Gastroenterol 2012; 107(9): 1409–1422. doi: 10.1038/ajg.2012.218.
84. Baldassano R, Colletti RB, Cucchiara S et al. Serious infections and associated risk factors in patients receiving infliximab and immunotherapies for children with inflammatory bowel disease: develop registry data. Gastroenterology 2013; 144(5): S-11. doi: 10.1016/S1 873-9946(13)60016-1.
85. Veereman-Wauters G, de Ridder L, Veres G et al. Risk of infection and preventio in pediatric patients with IBD: ESPHGAN IBD Porto Group commentary. J Pediatr Gastroenterol Nutr 2012; 54(6): 830–837. doi: 10.1097/MPG.0b013e31824d1438.
86. Magro F, Abreu C. Immunisations in Crohn‘s disease: who? why? what? when? Best Pract Res Clin Gastroenterol 2014; 28(3): 485–496. doi: 10.1016/j.bpg.2014.04.007.
87. Khan N, Abbas AM, Lichtenstein GR et al. Risk of lymphoma in patients withulcerative colitis treated with thiopurines: a nationwide retrospective cohort study. Gastroenterology 2013; 145(5): 1007–1015. doi: 10.1053/j.gastro.2013. 07.035.
88. Lewis JD, Schwartz JS, Lichtenstein GR. Azathioprine for maintenance of remission in Crohn‘s disease: benefits outweigh the risk of lymhoma. Gastroenterology 2000; 118(6): 1018––1024. doi: 10.1016/s0016-5085 (00) 70353-2.
89. Beaugerie L, Brousse N, Bouvier AM et al. Lymphoproliferative disorders in patients receiving thiopurines for inflammatory bowel disease: a propective observational cohort study. Lancet 2009; 374(9701): 1617–1625. doi: 10.1016/S0140-6736(09)61302-7.
90. Kandiel A, Fraser AG, Korelitz BI et al. Increased risk of lymphoma among inflammatory bowel disease patients treated with azathioprine and 6-mercaptopurine. Gut 2005; 54(8): 1121–1125. doi: 10.1136/gut.2004.049460.
91. Ashworth LA, Billet A, Mitchell P et al. Lymphoma risk in children and young adults with inflammatory bowel disease: analysis of a large single-center cohort. Inflamm Bowel Dis 2012; 18(5): 838–843. doi: 10.1002/ibd.21844.
92. Joose ME, Aardoom MA, Kemos P et al. Malignancy and mortality in paediatric-onset inflammatory bowel disease: a 3-year propsective, multinational study from the paediatric IBD Porto group of ESPHGAN. Aliment Pharmacol Ther 2018; 48(5): 523–537. doi: 10.1111/apt.14893.
93. Kotlyar DS, Osterman MT, Diamond RH et al. A systemic review of factors that contribute to hepatosplenic T-cell lymphoma in patients with inflammatory bowel disease. Clin Gastroenterol Hepatol 2011; 9(11): 36–41. doi: 10.1016/j.cgh.2010.09.016.
94. Chew C. FDA Drug Safety Communication: UPDATE on tumor necrosis factor (TNF) blockers and risk for pediatric malignancy. [online]. Dostupné z URL: https: //www.fda.gov/drugs/drug-safety-and-availability/fda-drug-safety-communication-update-tumor-necrosis-factor-tnf-blockers-and-risk-pediatric.
95. Dayhash GA, Loftus EV, Sandborn WJ et al. Ebstein-Barr virus-positive lymphoma in patients with inflammatory bowel disease treated with azathioprine or 6-mercaptopurine. Gastroenterology 2002; 122(1): 72–77. doi: 10.1053/gast.2002.30328.
96. Thai A, Prindiville T. Hepatosplenic T-cell lymphoma and inflammatory bowel disease. J Crohns Colitis 2010; 4(5): 511–522. doi: 10.1016/j.crohns.2010.05.006.
97. van Schaik FDM, van Oijen MGH, Smeets HM et al. Thiopurines prevent advanced colorectal neoplasia in patients with inflammatory bowel disease. Gut 2012; 61 (2): 235–240. doi: 10.1136/gut.2011.237412.
98. Singh H, Nuget Z, Demers AA et al. Increased risk of nonmelanoma skin cancers among individuals with inflammatory bowel disease. Gastroenterology 2011; 141 (5): 1612–1620. doi: 10.1053/j.gastro.2011.07.039.
99. O‘Donovan P, Perrett CM, Zhang X et al. Azathioprine and UVA light generate mutagenic oxidative DNA damage. Science 2005; 309 (5743): 1871–1874. doi: 10.1126/science.1114233.