Achalazie jícnu – aktuální přehled etiopatogeneze a dostupné terapie
Radek Kroupa Orcid.org 1, Aleš Hep Orcid.org 2, Jiří Dolina Orcid.org 2
+ Pracoviště
SOUHRN
Kroupa R, Hep A, Dolina J. Achalazie jícnu – aktuální přehled etiopatogeneze a dostupné terapie
Achalazie jícnu je nejlépe poznaná primární porucha motility. Dle aktuálních literárních údajů se v etiopatogenezi onemocnění uplatňuje zánět myenterického plexu vedoucí k degenerativním změnám na podkladě genetické predispozice a pravděpodobně autoimunitního poškození. Léčba je dosud jen symptomatická, vedoucí ke snížení tlaku v dolním jícnovém svěrači. Samotná aplikace bolulotoxinu by měla být rezervovaná pro pacienty neschopné podstoupit jinou léčbu. Použití a efekt pneumatické dilatace (eventuálně v kombinaci s botulotoxinem) nebo Hellerovy myotomie je většinou individualizováno dle dostupných možností a zkušeností na jednotlivých pracovištích. U mladých nemocných je vhodné vždy zvážit možnost operace.
Klíčová slova: achalazie – autoimunita – botulotoxin – pneumatická dilatace – Hellerova myotomie.
SUMMARY
Kroupa R, Hep A, Dolina J. Achalasia of the esophagus – contemporary review of etiopathogenesis and available treatment
Achalasia ot the esophagus is the best known primary motility dysfunction. According to recent literary review the inflammation of myenteric plexus leading to degenerative changes on basis of genetic predisposition and probably autoimmune injury is the main step in etiopathogenesis of that disorder. The treatment is only symptomatic which leads to decreasing of esophageal sfincter pressure. Botulotoxin only treatment should be reserved for patients unable to be treated by other methods. The pneumatic dilatation (or with botulotoxin application) or Heller’s myotomy is mostly individualised according to available methods and experience of each units. In young patients the consideration of surgery is necessary.
Key words: achalasia – autoimmunity – botulotoxin – pneumatic dilatation – Heller’s myotomy.
ÚVOD
Achalazie je primární porucha motility jícnu neznámé etiologie charakterizovaná narušenou relaxací dolního jícnového svěrače (LES), chyběním peristaltiky, u většiny pacientů zvýšeným klidovým tlakem LES a zvýšeným nitrojícnovým tlakem vzhledem k intragastrickému. Všechny tyto faktory vedou k funkční obstrukci distálního jícnu s městnáním potravy a slin nad překážkou a následnému rozvoji dilatace jícnu. Nejčastější obtíže pacientů s achalazií jsou dysfagie, regurgitace, pocit bolesti či tlaku za hrudní kostí, často ve vazbě na polykání, a pokračující hmotnostní úbytek. Vývoj potíží trvá někdy mnoho let. Jde o relativně vzácné onemocnění s literárně odhadovanou prevalencí 0,5 až 1,0 na 100 000 osob za rok, které se vyskytuje ve všech věkových skupinách. Na našem pracovišti ročně vyšetříme jícnovou manometrií přibližně 40–50 pacientů s achalazií. Tento počet zahrnuje nově diagnostikovaná onemocnění, kontroly u sledovaných pacientů po všech druzích terapie i superkonziliární vyšetření z jiných regionů. Dle našich dat tedy odhadujeme, že incidence onemocnění je 0,5–2 pacienti na 100 000 obyvatel (kolem 10 nově diagnostikovaných pacientů v milionovém regionu); prevalence je pak řádově vyšší, nebo» onemocnění významně neovlivňuje přežití.
Termínem pseudochalazie bývá označován podobný klinický obraz na podkladě jiné choroby – nejčastěji karcinomu jícnu(1).
V našich oblastech se nevyskytuje achalazie na podkladě infekce Trypanosoma cruzi, tzv. Chagasova nemoc, jinak endemická v Jižní Americe.
Vigorózní achalazie je manometricky definovanou podskupinou s vyššími amplitudami simultáních kontrakcí v těle jícnu a převažujícími bolestmi na hrudi(2).
ETIOLOGIE A PATOGENEZE
Fyziologie motility jícnu
Polykání je řízeno z jader n. vagus v prodloužené míše. Příčně pruhovaná svalovina v horní části jícnu je inervována přímo na cholinergní nervosvalové ploténce. Naproti tomu k hladkým svalům, které tvoří větší část těla jícnu a oblast dolního jícnového svěrače, vedou pregangliová vlákna n. vagus, která se přepojují na neuronech myenterického plexu.
V bazálním klidovém stavu je tonus jícnu řízen převahou excitačních (cholinergních) neuronů. Při polknutí se aktivují inhibiční neurony mediované NO (nitric oxid) a VIP (vasoactive intestinal polypeptid). Peristaltika jícnu a relaxace LES je tedy výsledkem složitě koordinované aktivace inhibičních a excitačních neuronů v podélném průběhu těla jícnu(3) (obr. 1.).
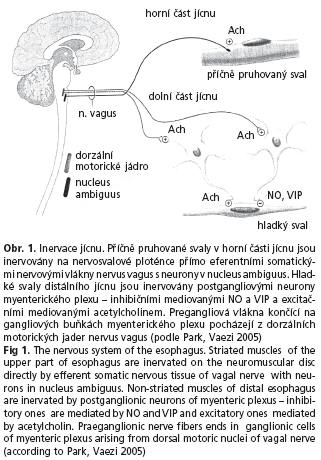
Histologickým vyšetřením jícnu u achalazie byl prokázán zánětlivý infiltrát a ireverzibilní degenerativní změny v plexus myentericus(4) s převažujícím postižením inhibičních NO- a VIP-neuronů(5). Jejich ztráta je tak zodpovědná za charakteristický manometrický obraz s postižením peristaltiky a relaxace LES.
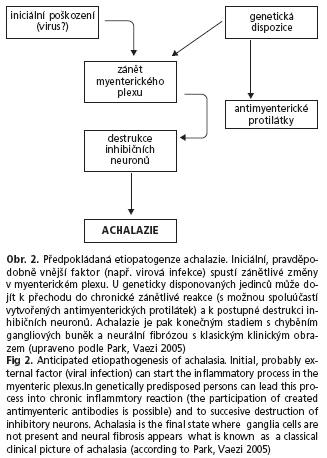
Dle aktuálních literálních údajů lze předpokládat možnou infekční či autoimunitní etiologii onemocnění na geneticky predisponovaném terénu (obr. 2).
Infekční etiologie achalazie vysvětluje degeneraci myenterických neuronů v asociaci s virovým onemocněním. Při studiu protilátek byl u achalatických pacientů popsán častější výskyt herpes virů (HSV, VZV) a spalniček ve srovnání s kontrolami(6,7). Pomocí PCR však v pozdějších studiích nebyl prokázán významější výskyt žádné infekce ve tkáni achalatického jícnu a/nebo byl výskyt HSV-1 bez rozdílu oproti kontrolám(8,9).
Autoimunitní etiologii onemocnění podporuje přítomnost cirkulujících protilátek proti myenterickému plexu, zánětlivá infiltrace T-lymfocyty v myenterickém plexu a zvýšená prevalence určitých antigenů HLA II. třídy.
Antimyenterické protilátky IgG byly opakovaně detekovány pomocí nepřímé imunoflurescence. Jejich výskyt v séru achalatických pacientů byl prokázán v 39–100 % vs 0–43 % u kontrol(10,11). Moses prokázal signifikantní zvýšení antimyenterických protilátek nejen u achalazie (51 %), ale i u pacientů s gastroezofageálním refluxem (50 %) oproti kontrolám (9 %)(13). Dle současných dat jsou pravděpodobně antimyenterické protilátky spíše nespecifickou reakcí na postižení jícnu než přímým etiologickým faktorem. Při experimentální kultivaci neuronů myenterického plexu se sérem pacientů s achalazií byly pozorovnány změny v produkci neuromediátorů podobné jako u achalazie. Tento nález tak podporuje možnou úlohu nějakých sérových faktorů v patogenezi onemocnění(14). Další výzkum v této oblasti bude jistě zajímavý.
Zánětlivý infiltrát v myenterickém plexu byl pozorován převážně v okolí gangliových buněk a svazků nervových vláken. Predominantně byly zastoupeny T-lymfocyty CD3+ a CD8+. Je možné, že na vzniku onemocnění se tak podílejí cytotoxické T-lymfocyty(15).
HLA antigeny II. třídy jsou častěji asociovány s některými autoimunitními onemocněními. Recentní studie(16) ukázala HLA asociaci DQA1*0103, DQB1*0603 alel a heterodimeru DQA1*0103-DQB1*0603 u achalatiků současně s vyšším výskytem antimyenterických protilátek. HLA asociace u achalazie tedy podporuje imunogenetickou dispozici vzniku onemocnění a zároveň autoimunitní spoluúčast na patogenezi onemocnění.
V ojedinělých případech je achalazie součástí tzv. triple A syndromu (AAAS, Allgroveův syndrom – alakrimie, achalazie, adrenální insuficience rezistentní na adrenokortikotropní hormon a autonomní dysfunkce) s autosomálně recesivní dědičností, u kterého byl již nalezen defektní gen na chromozomu 12q13 (ALADIN gen) (17). Některé dosud známé mutace genu AAAS byly sporadicky nalezeny i u tzv. idiopatické achalazie, ale ve většině případů genetický defekt prokázán nebyl(18).
I nadále je však jasná příčina nemoci z velké části neznámá. V korelaci klinických, histopatologických a imunologických nálezů lze jako možný mechanismus vzniku onemocnění uvažovat o akutním zánětu myenterického plexu jako reakci na vnější podnět (například virovou infekci). U disponovaných jedinců pak může dojít k tvorbě autoprotilátek, které se mohou podílet na chronickém zánětu v okolí gangliových buněk (ganglionitida) (19), které v pokročilém stadiu onemocnění degenerují a jsou nahrazeny vazivem, s klinickým obrazem klasické achalazie(20).
Teoretickou možností léčby tohoto jinak jen symptomaticky ovlivnitelného onemocnění by mohla být imunosupresivní a protizánětlivá léčba v časném stadiu onemocnění, kdy ještě nedošlo k ireverzibilní destrukci gangliových buněk. Základním problémem je pravděpodobně detekce ohrožených jedinců s počínajícím onemocněním, které má jen velmi vzácně klinické příznaky. K časnějšímu stadiu onemocnění by mohla patřit vigorózní achalazie(4), ale ani zde není jisté, zda by bylo postižení myenterického plexu reverzibilní, navíc není dostupná žádná metoda, která by umožnila stav inflamace in vivo monitorovat.
U pokročilého onemocnění by mohla být nadějná transplantace neuronálních kmenových buněk do myenterického plexu s obnovou neuronové populace(21). První výsledky již byly dosaženy s uchycením inhibičních neuronů v oblasti pyloru na myších(22).
DIAGNOSTIKA
Většina pacientů má dlouhodobé, pomalu progredující dysfagické obtíže, které po různou dobu nemají žádný objektivní korelát při endoskopii ani při pasáži kontrastní látkou. Dysfagie se projevuje typicky prvotním váznutím tužších jídel a až později tekutin. Dle našich zkušeností může být i intermitentní, zhoršující se například stresy, a naopak zlepšena např. po zapití pivem. Někteří nemocní se však naučí příjmu potravy s hojným zapíjením tak, že jsou dlouhou dobu adaptovaní bez hmotnostního úbytku a lékaře vyhledají až v pokročilém onemocnění. Anamnesticky je tedy nutno pátrat po přítomnosti a charakteru dysfagie, úbytku hmotnosti, bolestech a tlacích na hrudi při polykání a po regurgitaci. Jednotlivé příznaky mohou být zejména v časném stadiu onemocnění různě zastoupeny. Setkali jsme se i s dominující regurgitací zvažovanou k antirefluxní operaci.
Změny v endoskopickém nálezu se objevují až relativně pozdě jako částečná stenóza kardie s možnou stagnací potravy v jícnu a sekundární ezofagitidou. Časnější změny lze pozorovat na RTG pasáži jícnem (typicky je dilatovaný jícen s kónickým zúžením tvaru »ptačího zobáku«), ale v některých případech může být nález považován za normální. Charakteristický nález je při jícnové manometrii, která může potvrdit diagnózu i tehdy, nejsou-li morfologická vyšetření průkazná(23,24). K vyloučení infiltrace distálního jícnu lze doporučit endosonografii či výpočetní tomografii.
TERAPIE
Vzhledem k neznámé příčině onemocnění neexistuje kauzální léčba. Veškerá současná léčebná opatření jsou pouze symptomatická, slouží k obnovení volné pasáže jícnem. Cílem léčby je snížení tlaku v oblasti LES, a tím uvolnění funkční stenózy. Jen v ojedinělých případech je indikována chirurgická náhrada jícnu s obnovou kontinuity trávicího ústrojí střevem. V léčbě achalazie se uplatňují systémově podávané léky, lokální aplikace botulotoxinu do oblasti dolního jícnového svěrače, různé metody dilatace jícnu a chirugická myotomie.
Farmakoterapie
Farmakologická léčba nitráty či blokátory kalciových kanálů má většinou jen dočasný a nedostatečný efekt. Jako dočasné překlenutí k definitivnější terapii nebo jako doplňková léčba, pokud invazivnější postup nemá optimální výsledek, lze použít nitrát sublinguálně ve spreji před jídlem. V případě nežádoucích účinků doporučujeme vyzkoušet retardovaný preparát nebo nifedipin(25).
Botulotoxin
Již více než 10 let jsou publikovány zkušenosti s injekcí botulotoxinu do oblasti LES(26). Botulotoxin inhibuje uvolnění acetylcholinu z nervových zakončení, tím blokuje převládající cholinergní inervaci a vede ke snížení tlaku v LES. Obykle používané a srovnatelně účinné dávky jsou 200 až 250 IU preparátu Dysport nebo 80–100 IU preparátu Botox většinou injikované běžnou sklerotizační jehlou rozděleně do 4 kvadrantů(27). Zlepšení symptomů po 1 měsíci od aplikace bylo dosaženo asi u 85 % pacientů. S delším odstupem od léčby však účinnost klesá na 67–69 % v 6 měsících a po roce od léčby efekt přetrvává jen asi v 54 % léčených(28). Větší efekt byl pozorován u starších pacientů a u vigorózní achalazie(29). Zvýšení efektu bylo dosaženo opakováným podáním(30) nebo kombinovanou aplikací z přímé vize i retroflexe(31). Výhodou léčby je její bezpečnost a nízký výskyt nežádoucích účinků. Vzhledem k dočasnému efektu, nutnosti opakování a ceně by mělo být samotné podání botulotoxinu v léčbě achalazie jícnu rezervováno pro staré a velmi rizikové pacienty(28,32).
Při aplikaci botulotoxinu bylo dosaženo lepších výsledků u pacientů s nižším tlakem LES před léčbou(33).
Pneumatická dilatace
Pneumatická dilatace je nejefektivnější nechirurgická metoda léčby. Pomocí balónku zavedeného pod endoskopickou a/nebo RTG kontrolou je tlakem roztažena oblast LES, čímž dojde k dilataci a disrupci svalových vláken a snížení tlaku. Nejužívanější jsou balónky Rigiflex zaváděné po vodiči. Vždy by měla následovat kontrolní pasáž vodnou kontrastní látkou k vyloučení perforace jícnu. Riziko perforace je uváděno mezi 1–3 %(34). Efekt léčby je do 1 roku srovnatelný s aplikací botulotoxinu 70–80 %, v dalším průběhu je však menší výskyt recidivy obtíží a po 4, resp. 5 letech přetrvává úleva symptomů u 40–60 % pacientů., po 10 letech efekt dilatace přetrvává u 36–47 % pacientů(35–38). Ke zvýšení efektu je doporučována i série dilatací s postupně narůstajícím průměrem balónku 30–35–40 mm(39). Prediktorem dlouhodobějšího efektu je snížení tlaku LES pod 10 mm Hg(40).
Kombinovanou léčbu injekcí botulotoxinu s následnou pneumatickou dilatací popisují 2 práce. Dle publikovaných výsledků má některé výhody – zvýšení efektu a bezpečnosti, nevýhodou je vyšší ekonomická náročnost(41,42).
U pacientů po pneumatické dilataci bývá pozorována diskrepance mezi minimálními subjektivními obtížemi a progresí dilatace jícnu jako známky zhoršení pasáže při selhání léčby(43). Na našem pracovišti doporučujeme kontrolní RTG pasáž i u pacientů s minimálními obtížemi v intervalu 2–3 let.
Operace
Chirurgická léčba – Hellerova myotomie – je jednoznačně účinější než botulotoxin. Efekt po 2 letech trvá v 83–94 % bez významějšího snížení během dalších 5 let(44–46). Dlouhodobé sledování více než 10 let dokladuje dobrý symptomatický efekt až u 90 % pacientů(47). Operace je v posledních letech prováděna laparoskopicky a většinou je doplňována parciální antirefluxní manžetou. Výskyt časné pooperační dysfagie může být při nedostatečném rozsahu myotomie, periezofageální fibróze či příliš těsné manžetě(48). Peroperační manometrie LES by mohla zlepšit iniciální efekt operace(49). Srovnání myotomie s pneumatickou dilatací vykazuje mírně lepší redukci symptomů a trvání remise u operovaných, nevýhodou jsou vyšší náklady a horší výsledky léčby po jejím prvním selhání(50).
Vyšší tlak LES před operací predikuje lepší efekt výkonu(51).
U pacientů nereagujících na dosavadní léčbu s extrémní dilatací jícnu a rizikem komplikací (aspirace, perforace ap.) je indikována resekce jícnu.
Úskalí léčby achalazie
Snížení tlaku v dolním jícnovém svěrači se zlepšením dysfagických obtíží přináší riziko vzniku gastroezofageálního refluxu. Po pneumatické dilataci je popisován v 16 %, po myotomii bez provedené fundoplikace ve 13–64 %(46,25). Pacienti po léčbě botulotoxinem nebo pneumatické dilataci by měli užívat udržovací antisekreční léčbu k prevenci refluxních komplikací. U pacientů po kombinované léčbě botulotoxinem a pneumatickou dilatací vždy podáváme udržovací antirefluxní léčbu omeprazolem 20 mg jednou denně po dobu nejméně půl roku a dále pokračujeme dle symptomů. Kontrolní endoskopii provádíme za 2–3 roky i tehdy, není-li recidiva dysfagie, regurgitace či výskyt pyrózy.
Obtížnější provedení chirurgické léčby po předchozí aplikaci botulotoxinu i pneumatické dilataci vlivem zánětlivých změn a tvorbou vaziva není jednoznačně prokázáno, publikované údaje z relativně velkých souborů pacientů svědčí zhruba rovnoměrně pro i proti(52-56). Domácí chirurgická pracoviště (Olomouc, Praha), dle sdělení na odborných fórech, považují předchozí aplikaci botulotoxinu či pneumatickou dilataci za faktor komplikující průběh a výsledky operace(61). Při recidivě obtíží po Hellerově myotomii je další dilatace i reoperace méně úspěšná než u dosud neléčených (50–67 %)(34).
V terénu achalazie jícnu bylo popsáno vyšší riziko vzniku spinocelulárního karcinomu jako následek dlouhodobé iritace sliznice stagnujícím obsahem. Incidence karcinomu u pacientů sledovaných přes 10 let dosahuje 1,7–3,7 %(46,57).
V současné době není k dispozici jednoznačně optimální léčba achalazie. U pacientů s vysokým rizikem lze preferovat aplikaci botulotoxinu s vědomím většinou dočasného efektu. Volba mezi pneumatickou dilatací a chirurgickou léčbou není vždy jednoduchá a kromě předpokládaného efektu metody je nutno zohlednit věk, celkový zdravotní stav i přání informovaného pacienta s přihlédnutím k rizikům obou postupů. Některá centra doporučují jako první volbu myotomii, jiní preferují prvotní provedení pneumatické dilatace a v případě jejího selhání indikovat operaci(58,59). Dle našich vlastních zkušeností pokládáme za vhodný kompromis kombinaci aplikace botulotoxinu s následnou dilatací s efektem více než 80 % po 2 letech(60). U mladých nemocných je vhodné vždy uvažovat o myotomii doplněné antirefluxní parciální plastikou.
Terapie je tak většinou individualizována dle dostupných možností a zkušeností jednotlivých pracoviš».
Literatura
1. Gockel I, Eckardt VF, Schmitt T, et al. Pseudoachalasia: a case series and analysis of the literature. Scand J Gastroenterol 2005; 40(4): 378–385.
2. Richter J. Oesophageal motility disorders. Lancet 2001; 358: 823–828.
3. Crist J, Gidda JS, Goyal RK. Intramural mechanism of esophageal peristalsis: roles of cholinergic and non cholninergic nerves. Proc Natl Acad Sci USA 1984; 81: 3595–3599.
4. Goldblum JR, Rice TW, Richter JE. Histopatologic features in esophagomyotomy specimens from patients with achalasia. Gastroenterology 1996; 111: 648–654.
5. Mearin F, Mourelle M, Guarner F, et al. Patients with achalasia lack nitric oxide synthase in the gastro-oesophageal junction. Eur J Clin Invest 1993; 23: 724–728.
6. Jones DB, Mayberry JF, Rhodes J, et al. Preliminary report of an association between measles virus and achalasia. J Clin Pathol 1983; 36: 655–657.
7. Robertson CS, Martin BA, Atkinson M. Varicella-zoster virus DNA in the oesophageal myenteric plexus in achalasia. Gut 1993; 34: 299–302.
8. Niwamoto H, Okamoto E, Fujimota J, et al. Are human herpes viruses or measles associated with esophageal achalasia? Dig Dis Sci 1995; 40: 859–864.
9. Birgisson S, Galinsky MS, Goldblum JR, et al. Achalasia is not associates with measles or known herpes and human papilloma viruses. Dig Dis Sci 1997; 42: 300–306.
10. Storch WB, Eckardt VF, Wienbeck M, et al. Autoantibodies to Auerbach’s plexus in achalasia. Cell Mol Biol 1995; 41: 1033–1038.
11. Verne GN, Sallustio JE, Eaker EY. Anti-myenteric neuronal antibodies in patients with achalasia. A prospective study. Dig Dis Sci 1997; 42: 307–313.
12. Spechler SJ. AGA technical review on treatment of patients with dysfagie caused by benign disorders of the distal esophagus. Gastroenterology 1999; 117: 299–302.
13. Moses PL, Ellis LM, Anees MR, et al. Antineuronalantibodies in idiopathic achalasia and gastro-esophageal reflux disease. Gut 2003; 52: 629–636.
14. Bruley des Varannes S, Chevalier J, Pimont S, et al. The serum of achalasia patients alters neurochemical coding in the myenteric plexus and NO-mediated motor response in normal human fundus. Gut 2006; 55(3): 319–329.
15. Clark SB, Rice TW, Tubbs RR, et al. The nature of the myenteric infiltrate in achalasia: an immunohistochemical analysis. Am J Surg Pathol 2000; 24: 1153–1158.
16. Ruiz de Leon A, Mendoza J, Sevilla-Mantilla C, et al. Myenteric antiplexux antibodies and class II HLA in achalasia. Dig Dic Sci 2002; 47: 15–19.
17. Brooks BP, Kleta R, Stuart C, et al. Genotypic heterogeneity and clinical phenotype in triple A syndrome: a review of the NIH experience 2000–2005. Clin Genet 2005; 68(3): 215–221.
18. Di Nardo G, Tullio-Pelet A, Annese V, et al. Idiopathic achalasia is not allelic to alacrima achalasia adrenal insufficiency syndrome at the ALADIN locus. Dig Liver Dis 2005; 37(5): 312–315.
19. De Giorgio R, Guerrini S, Barbara G, et al. Inflammatory neuropathies of the enteric nervous system. Gastroenterology 2004; 126: 1872–1883.
20. Park W, Vaezi MF. Etiology and pathogenesis of achalasia: the current understanding. Am J Gastroenterol 2005; 100: 1404–1414.
21. Boeckxstaens GE, Jonge WD, van den Wijngaard RM, et al. Achalasia: from new insights in pathophysiology to treatment. J Pediatr Gastroenterol Nutr 2005; 41(Suppl. 1): S36.
22. Micci MA, Learish RD, Li H, et al. Neural stem cells express RET, produce nitric oxide, and survive transplantation in the gastrointestinal tract. Gastroenterology 2001; 121: 757–766.
23. Pandolfino JE, Kahrilas PJ, American Gastroenterological Association medical position statement: clinical use of esophageal manometry. Gastroenterology 2005; 128(1): 207–208.
24. Vaezi MF, Richter JE. Diagnosis and management of achalasia. Practice guidelines. Am J Gastroenterol 1999; 94: 3406–3412.
25. Tack J. Medical treatment of achalasia. In: Gouma DJ, et al. New developments in the management of benign GI disorders 2004. Paris: John Libbey Eurotext 2004: 13–23.
26. Pasricha PJ, Ravich WJ, Hendrix TR, et al. Treatment of achalasia with intrasphincteric injection of botulinum toxin: a pilot trial. Ann Intern Med 1994; 121: 590–591.
27. Annese V, Bassoti G, Cocia G, et al. Comparison of two different formulations of botulinum toxin A for treatment of esophageal achalasia. Aliment Pharmacol Ther 1999; 13: 1347–1350.
28. Gui D, Rossi S, Runfola M, et al. Review article: botulinum toxin in the therapy of gastrointestinal motility disorders. Aliment Pharmacol Ther 2003; 18: 1–16.
29. Pasricha PJ, Rai R, Ravich WJ, et al. Botulinum toxin for achalasia: long term outcome and predictors of response. Gastroenterology 1996; 110: 1410–1415.
30. Annese V, Basciani M, Borrelli O, et al. Intrasphincteric injection of botulinum toxin is effective in long- term treatment of achalasia. Muscle Nerve 1998; 21: 1540–1542.
31. Martinek J, Spicak J. A modified method of botulinum toxin injection in patients with achalasia: a pilot trial. Endoscopy 2003; 35(10): 841–844.
32. Zarate N, Mearin F, Baldovino F, et al. Achalasia treatment in the elderly: is botulinum toxin injection the best option? Eur J Gastroenterology and Hepatology 2002; 14: 285–290.
33. Neubrand M, Scheurlen C, Schepke M, et al. Long term results and prognostic factors in the treatment of achalasia with botulinum toxin. Endoscopy 2002; 34(7): 519–523.
34. Vela MF, Richter JE, Wachsberger D, et al. Complexities of managing achalasia at a tertiary referral center: use of pneumatic dilatation, Heller myotomy, and botulinum toxin injection. Am J Gastroenterol 2004; 99(6):1029–1036.
35. Allescher HD, Storr M, Seige M, et al. Treatment of achalasia: botulinum toxin injection vs. pneumatic balloon dilation. A prospective study with long-term follow-Up. Endoscopy 2001; 33(12): 1007–1017.
36. Muehldorfer SM, Schneider TH, Hochberger J, et al. Esophageal achalasia: intrasphincteric injection of botulinum toxin A versus baloon dilatation. Endoscopy 1999; 31(7): 517–521.
37. Vaezi MF, Richter JE, Wilcox CM, et al. Botulinum toxin versus pneumatic dilatation in the treatment of achalasia: a randomized trial. Gut 1999; 44: 231–239.
38. Chan KC, Wong SK, Lee DW, et al. Short-term and long-term results of endoscopic balloon dilation for achalasia: 12 years’ experience. Endoscopy 2004; 36(8): 690–694.
39. Kadakia SC, Wong RH. Graded pneumatic dilatation using Rigiflex achalasia dilators in patients with primary esophageal achalasia Am J Gastroenterol 1993; 88: 34–38.
40. Ghoshal UC, Kumar DM, Saraswar VA, et al. Long term follow up after pneumatic dilatation for achalasia cardia: factors associated with treatment failure and recurrence. Am J Gastroenterol 2004; 99: 2304–2310.
41. Hep A, Dolina J, Plottová Z, et al. Is the complex therapy of achalasia by application of botulotoxin in combination with balloon dilatation a prospective approach? Bratisl lek Listy 2000; 101: 433–437.
42. Mikaeli J, Bishehsari F, Montazeri G, et al. Efficacy of botulinum toxin injection before pneumatic dilatation in patients with idiopathic achalasia. Dis Esophagus 2004; 99: 213–217.
43. Vaezi MF, Baker ME, Richter JE. Assessment of esophageal emptying post-pneumatic dilatation: use of timed-barium esophagogram. Am J Gastroenterol 1999; 94: 1802–1807.
44. Zaninotto G, Annese V, Costantini M, et al. Randomized controlled trial of botulinum toxin versus laparoscopic heller myotomy for esophageal achalasia. Ann Surgery 2004; 239(3): 364–370.
45. Chen LQ, Chughtai T, Sideris L, et al. Long-term effects of myotomy and partial fundoplication for esophageal achalasia. Dis Esophagus 2002; 15(2): 171–179.
46. Liu JF, Zhang J, Tian ZQ, et al. Long-term outcome of esophageal myotomy for achalasia. World J Gastroenterol 2004; 10(2): 287–291.
47. Nguen NQ, Holloway RH. Recent developments in esophageal motor disorders. Current Opinion in Gastroenterology 2005; 21: 478–484.
48. Zaninotto G, Costantini M, Portale G, et al. Etiology, diagnosis, and treatment of failures after laparoscopic Heller myotomy for achalasia. Ann Surg 2002; 235(2): 186–192.
49. Loveček M, Gryga A, Herman J, et al. Peroperační diagnostické metody při operaci achalazie jícnu. První zkušenosti. Rozhl Chir 2003; 82(11): 566–569.
50. Richter JE. Comparison and cost analysis of different treatment strategies in achalasia. Gastrointest Endosc Clin N Am 2001; 11: 359–369.
51. Arain MA, Peters JH, Tamhankar AP, et al. Preoperative lower esophageal sphincter pressure affects outcome of laparoscopic esophageal myotomy for achalasia. J Gastrointest Surg 2004; 8(3): 328–334.
52. Bloomston M, Fraiji E, Boyce jr HW, et al. Preoperative intervention does not affect esophageal muscle histology or patient outcomes in patients undergoing laparoscopic Heller myotomy. J Gastrointestinal Surgery 2003; 7(2): 181–188.
53. Horgan S, Hudda K, Eubanks I, et al. Does botulinum toxin injection make esophagomyotomy a more difficult operation? Surg Endosc 1999; 13: 576–579.
54. Deb S, Deschamps C, Allen MS, et al. Laparoscopic esophageal myotomy for achalasia: factors affecting functional results. Ann Thorac Surg 2005; 80(4): 1191–1194.
55. Portale G, Costantini M, Rizzetto C, et al. Long-term outcome of laparoscopic heller-dor surgery for esophageal achalasia: possible detrimental role of previous endoscopic treatment. J Gastrointest Surg 2005; 9(9): 1332–1339.
56. Rosemurgy A, Villadolid D, Thometz D, et al. Laparoscopic Heller myotomy provides durable relief from achalasia and salvages failures after botox or dilation. Ann Surgery 2005; 241(5): 725–733.
57. Brucher BL, Stein HJ, Bartels H, et al. Achalasia and esophageal cancer: incidence, prevalence, prognosis. World J Surg 2001; 25: 745–779.
58. Shaheen NJ. What is the best management strategy for achalasia? Comment. Gastroenterology 2004; 127(6): 1850–1852.
59. Urbach DR, Hansen PD, Khajanchee YS, et al. A decision analysis of the optimal initial approach to achalasia: laparoscopic Heller myotomy with partial fundoplication, thoracoscopic Heller myotomy, pneumatic dilatation, or botulinum toxin injection. J Gastrointest Surg 2001; 5(2): 192–205.
60. Hep A, Kroupa R, Matyasova Z, et al. Combined treatment – botulinum toxin and pneumatic dilatation in patients with achalasia – long term results Dis Esophagus 2004; 17(Suppl. 1): A21.
61. Aujeský R, Neoral Č, Král V, et al. Současné možnosti léčby achalazie jícnu. Rozhl Chir 2000; 79(3): 99–101.
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené