Thalidomid in gastroenterology and hepatology
Miloš Jeseňák Orcid.org 1, Zuzana Havlíčeková Orcid.org 2, Peter Lietava3, Eva Babušíková Orcid.org , Peter Bánovčin Orcid.org 4, Renata Szépeová Orcid.org 1
+ Affiliation
Summary
SUMMARY
Jeseňák M, Szépeová R, Havlíčeková Z, Lietava P, Babušíková E, Bánovčin P Thalidomid in gastroenterology and hepatology
Thalidomide (THD) has been recently introduced into therapeutical algorithms of many diseases (especially those oncological and inflammatory) with poor response to standard therapy. THD is a potent immunomodulatory and antiangiogenic agens. Although we didn't know the exact mechanism of its action in organism, THD has been demonstrated as effective agent in the treatment of various diseases. There are many present clinical studies evaluating its effect, dose, or combination with the other medicaments. Up to this day, it has been proven with different successes in the treatment of various diseases of gastrointestinal tract and liver. Some results are very hopeful and it seems that this medicament will have benefit in the treatment of some of the studied diseases.
Key words: biologic based therapy - gastroenterology - hepatology - thalidomide.
ÚVOD
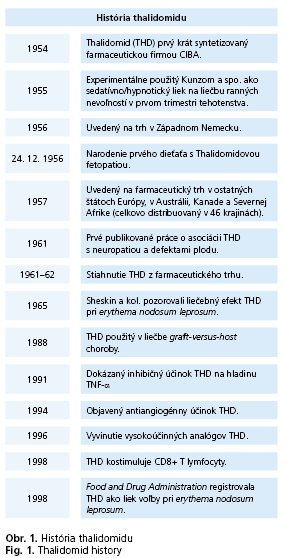
V posledných rokoch sa na poli viacerých medicínskych odborov objavuje kedysi dobre známy liek - thalidomid (THD). Patrí medzi lieky ktoré sa v minulosti nezapísali práve v najlepšom svetle v povedomí lekárskej komunity. Prvý krát bol syntetizovaný v roku 1954 a následne v 1955 použitý Kunzom et al.(1) ako výborný liek s antiemetickým a sedatívnym účinkom na liečbu rannej nevoµnosti v prvom trimestri tehotenstva. V 1956 bol uvedený na farmaceutický trh v Západnom Nemecku a krátko na to sa distribuoval v ostatných krajinách Európy, Afrike, Austrálii a Amerike. Prvé die»a s THD embryopatiou sa narodilo síce už 24. 12. 1956, ale prvé zmienky o asociácii THD s kongenitálnymi malformáciami (amélie, fokomélie, dysmélie, hypo-plázia kostí, defekty srdca, uší, očí a iných orgánov okrem mozgu) u detí matiek užívajúcich THD počas tehotenstva sa objavili v odbornej literatúre až v roku 1961. Následne bol liek v priebehu jedného roka stiahnutý z trhu. Postupom času sa však viacerí autori začali zaobera» experimentálnym použitím THD na liečbu chorôb, vznikajúcich na zápalovom podklade, ktoré neodpovedali na štandardne používanú terapiu. Súbežne s tým bolo popísaných mnoho nových vlastností a účinkov THD vyplývajúcich z rôznorodých mechanizmov pôsobenia v organizme(2). Ako prvé ochorenie, kde sa THD osvedčil bolo erythema nodosum leprosum(3), pričom v roku 1998 ho Food and Administration Drug v USA schválila ako oficiálny liek na liečbu tejto komplikácie lepry(4) (obr. 1). THD a jeho deriváty sa postupne dostávajú do liečebných schém mnohých chorôb predovšetkým zo skupiny hematoonkologickej, infekčnej a reumatologickej. Ironicky vyznieva fakt, že pôvodný nežiaduci účinok (inhibícia angiogenézy) sa stal jedným z dominantných mechanizmov, pre ktoré sa THD úspešne používa, naopak, sedatívny efekt je dnes jeden z nežiaducich účinkov THD terapie.
V súčasnosti prebieha mnoho klinických štúdií zhodnocujúcich jeho efekt, dávku, ev. kombináciu s inými liekmi v liečbe mnohých ochorení (najmä zo skupiny onkologickej a zápalovej), ktoré neodpovedajú na štandardnú liečbu. Dodnes bol vyskúšaný s rôznym efektom aj pri viacerých ochoreniach gastrointestinálneho traktu a pečene.
Thalidomid je derivát kyseliny glutámovej zaradený medzi tzv. biologickú liečbu (biologic based drugs). Medzi jeho základné účinky patria tieto: hypnoticko/sedatívny, antiemetický, protizápalový a antireumatický (cez úpravu narušenej rovnováhy cytokínov), antiangiogénny a antineoplastický (cez inhibíciu neovaskularizácie a rastových faktorov), virostatický, imunomodulačný (nie však imunosupresívny) a teratogénny(5). Keďže samotný THD má mnohé nežiadúce účinky (NÚ), boli vyvinuté dve nové skupiny liekov odvodených od THD, ktoré majú až 50 000x vyššiu účinnos» ako pôvodný preparát. Prvá skupina sa označuje ako SelCIDs (selective cytokine inhibitory drugs) a druhá ako IMiDs (immunomodulatory drugs). Vzhµadom na široké spektrum účinku oboch tried sa perspektívne počíta s ich využitím pri liečbe mnohých ochorení. THD analogy sú netoxické a nemajú teratogénny ani mutagénny účinok, výhodné sú aj niektoré iné fyzikálne alebo chemické vlastnosti (napr. zvýšená solubilita vo vode). Ich predstaviteµmi sú najmä dva preparáty: CC-5013 - Lenalidomid (Revlimid®) a CC-4047 (Actimid®)(6).
MECHANIZMUS ÚČINKU
Thalidomid pôsobí v organizme na viacerých miestach. Za jeho hlavný účinok sa považuje zníženie produkcie TNF-α v monocytoch a makrofágoch po ich stimulácii lipopolysacharidmi, pričom ide o selektívny a od dávky závislý efekt a inhibícia nikdy nie je kompletná. Zníženie TNF-α je na podklade viacerých mechanizmov: THD znižuje expresiu NF-κ B a zabraňuje jeho translokácii do jadra bunky, čím znižuje expresiu a urýchµuje degradáciu mRNA pre TNF-α, avšak produkcia sa neeliminuje kompletne. Preto je THD vhodný pri zápalových ochoreniach, kde nemusí by» imunitná odpoveď potlačená úplne(7). V niektorých prípadoch dochádza dokonca k zvýšeniu plazmatických hladín TNF-α, IL-2 a IL-12, čo závisí na relatívnej predominancii aktivácie monocytov/makrofágov a T-buniek, predovšetkým pri nezápalových ochoreniach. Pri subsekventnej kostimulácii CD4 a CD8 buniek dochádza k superindukcii TNF-α. THD má modulačný efekt pri nerovnováhe cytokínovej siete pri niektorých ochoreniach: ↓ IL-1, ↓IL-1β (→ proti-zápalový účinok), ↓ IL-12 (→ regulácia celulárnej imunitnej odpovede), ↓IL-6 a ↑ IL-2 (→ antitumorózny účinok), ↑ IL-8 (→ znižuje neovaskularizáciu), ↑ IL-10 a IFN-γ (→ imunomodulačný a antitumorózny účinok), dvojitý účinok na IL-12, ↑ IL-4 a IL-5(8-11). THD aktivuje proliferáciu CD8 aj CD4 lymfocytov cez T bunkové receptory. Suprimuje TH1cytokínovú odpoveď pri súčasnej aktivácii TH2 odpovede a zvyšuje prirodzenú cytotoxickú aktivitu NK buniek. Jeho vynikajúce protinádorové účinky vyplývajú jednak z priameho cytotoxického pôsobenia na plazmatické bunky, interferencie s väzbami nádorových buniek s okolím, z ovplyvnenia procesov prirodzenej apoptózy a z inhibície mnohých rastových faktorov(8,9). Selektívne inhibuje COX-2, čím znižuje produkciu PG-E2, a preto kombinácia THD so selektívnym inhibítorom COX-2 alebo s NSAiD vedie k zvýrazneniu jeho terapeutického efektu. Inhibíciou expresie molekúl celulárnej adhézie (ICAM-1, VCAM-1, E a L-selektín) a znížením produkcie regulačných faktorov angiogenézy (VEGF, bFGF) blokuje THD angiogenézu a neovaskularizáciu v nádore a v kostnej dreni, pričom je to možné až po jeho metabolizácii na účinný produkt. Medzi ostatné účinky patrí inhibícia pôsobenia insulin-like faktora 1 na chodrogenézu a vývin končatín, stabilizácia lyzozomálnych membrán (čím znižuje tkanivové poškodenie), zníženie proliferácie endoteliálnych buniek, aktivácia PG-H-syntázy, čo vedie k zvýšeniu produkcie voµných kyslíkových radikálov poškodzujúcich DNA a iné makromolekuly Nezanedbateµný je aj virostatický účinok a redukcia apoptózy neutrofilov pri HIV infekcii(10).
NEŽIADUCE ÚČINKY
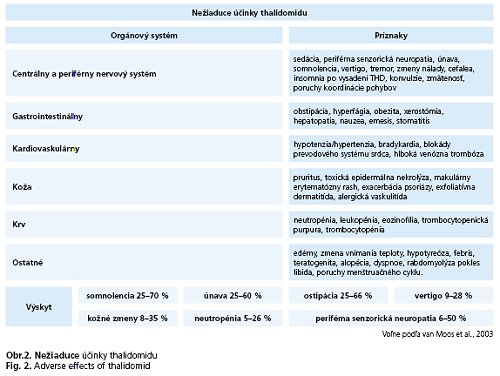
Liečba THD je sprevádzaná pomerne častým výskytom nežiaducich účinkov u väčšiny pacientov, ktoré často vedie k zastaveniu liečby alebo redukcii aplikovanej dávky. Podµa mnohých autorov je THD liek so širokým spektrom vedµajších účinkov (obr. 2), ktoré vedú k prerušeniu liečby až u 30 % pacientov. Vo všeobecnosti je najzávažnejším NÚ od dávky závislá reverzibilná neuropatia a teratogenita. Polyneuropatia asociovaná s užívaním THD je charakterizovaná akrálnymi parestéziami a znížením povrchovej citlivosti (6-50 % pacientov). Tieto príznaky sú obyčajne reverzibilné a ustúpia po prerušení liečby, hoci v literatúre bola dokumentovaná aj ireverzibilná strata citu, a to v dôsledku pokračovania liečby aj napriek objaveniu sa tohto NÚ. Najčastejšími NÚ sú obstipácia, somnolencia a sedacia, ktoré sa však počas užívania lieku môžu zlepši» až vytrati». Vzhµadom na tieto NÚ sa odporúča THD užíva» večer. V posledných rokov sa stretávame s čoraz častejšími prípadmi hlbokej venóznej trombózy počas liečby THD, predovšetkým v kombinácii s konvenčné používanou chemoterapiou alebo kortikoterapiou. Zvýšené riziko je u pacientov s onkologickým ochorením, systémovým lupusom a antifosfolipidovým syndrómom, a preto by títo pacienti mali by» monitorovaní pre možný vznik trombembolických príhod, obzvláš» pri kombinovanej liečbe. Ako prevenciu možno aplikova» nízkomolekulárny heparín alebo warfarin. Niektorí autori pozorovali aj vznik arteriálnej trombózy s následnou gangrénou prstov(6, 11-15). Aj napriek výskytu týchto NÚ je však liečba THD vo všeobecnosti pomerne dobre tolerovaná, keďže ostatné NÚ (okrem sedacie, somnolencie, obstipácie a neuropatie) sú mierne a pomerne zriedkavé.
MOŽNOSTI POUŽITIA THALIDOMIDU V GASTROENTEROLÓGII AHEPATOLÓGII (obr. 3)
Idiopatické črevné zápaly
(Inflammatory bowel diseases, IBD; Crohnova choroba a idiopatická proktokolitída)
Monoklonálne protilátky proti tumor-nekrotizujúcemu faktoru-α (TNF-α) sú účinnou liečbou pri refraktérnych formách IBD. THD je ďalší liek s anti-TNF vlastnos»ami, a preto sa predpokladal jeho význam aj pri liečbe týchto ochorení. Okrem blokády TNF-cesty sú v liečbe IBD významné aj ďalšie mechanizmy pôsobenia THD: redukcia expresie IL-12, down-regulácia integrínov, inhibícia migrácie leukocytov a angiogenézy(16). Inhibícia viacerých patofyziologických ciest zapojených do rozvoja IBD vysvetµuje vyššiu efektivitu THD v liečbe týchto ochorení v porovnaní so selektívnymi inhibítormi jednotlivých ciest(17). Potvrdila to nedávna štúdia s 10 pacientmi s terapeuticky refraktérnou IBD na liečbu kortikoidmi a/alebo azatioprínom, ktorým bol podávaný THD 300 mg/deň počas 12 týždňov(18). U 7 došlo k signifikantnému zníženiu aktivity ochorenia (Index aktivity Crohnovej choroby, CDAI: z 309 na 187, CAI: z 9 na 7, CDEIS skóre: zo 16.1 na 8.7), 4 pacienti dosiahli klinickú remisiu. Kultivácia mononukleárnych buniek lamina propria hrubého čreva in vitro s THD ukázala závislos» zníženia produkcie cytokínov od dávky lieku.

V ďalších humánnych štúdiách s rôznymi dávkami THD: 200 mg/deň(19) a 50-100 mg/deň(20) bola podobná klinická odpoveď (64 % a 70 %). V štúdii Ehrenpreisa et al. (1999) 3-mesačnú liečbu skončili 14 pacienti. U všetkých pozorovali klinické zlepšenie a 41 % bolo v klinickej remisii. U 5 zo 6 pacientov s fistulami bola pozorovaná ich obliterácia(19). THD môže by» rovnako účinný ako infiiximab, ev. môže by» podávaný ako udržiavacia liečba popri tejto terapii(17). U pacientov liečených THD bol pozorovaný pokles frekvencie stolíc(21), zníženie počtu fistúl(19) a zlepšenie CDAI. V jednej štúdii bolo možné u všetkých pacientov liečených THD zníži» dávku kortikoidov o viac ako polovicu. Ku klinickej odpovedi došlo už v priebehu 1. - 4. týždňa(20). THD liečba je účinná aj u pacientov s orálnou formou Crohnovej choroby, ktorá pred tým neodpovedala na inú imunosupresívnu liečbu(22). Lazzerini et al. (2007) skúmali dlhodobú účinnos» a bezpečnos» THD v skupine detí trpiacich na refraktérne IBD (19 s Crohnovou chorobou a 9 s idiopatickou proktokolitídou). THD bol účinný pri navodení dlhodobej remisie základného ochorenia (75 % pacientov), ktoré bolo bez odpovede na štandardne podávanú liečbu. Hlavným NÚ bola od dávky závislá reverzibilná neuropatia(23). V ďalšej štúdii pozorovali účinok THD u pacientov s refraktérnou formou luminálnej alebo fistulujúcej Crohnovej choroby. Takmer polovica pacientov musela liečba pre NÚ preruši» (neuropatia, sedacia, leukopénia alebo abdomenalgie). V zostávajúcej časti súboru pozorovali klinickú odpoveď u väčšiny pacientov. THD sa javil by» vhodnou krátko- prípadne strednedlho trvajúcou liečbou u vybraných pacientov s refraktérnou formou Crohnovej choroby. Dlhodobé užívanie je však limitované jeho toxicitou(24). V ďalšej štúdii v skupine 5 detských pacientov s refraktérnou Crohnovou chorobou neodpovedajúcou na žiadnu konzervatívnu liečbu podávali THD v dávke 1,5-2 mg/kg/deň. Účinnos» liečby posudzovali autori na základe Detského indexu aktivity Crohnovej choroby (pCDAI), modifikovaného Harvey-Brandshawovho skóre (H-Bs) a redukcie dávky kortikosteroidov. U 4 pacientov došlo k výraznému poklesu oboch skóre (pCDAI z 36,9 na 2,5 a H-BS z 8,5 na 0,75) po troch mesiacoch liečby. U všetkých najprv zredukovali dávku kortikoidov (priemerná dávka pred liečbou THD bola 35 mg/deň) a následne ich vysadili. Všetci 4 pacienti boli v remisii po 19-24 mesiacoch liečby. Piaty pacient prerušil liečbu po 1 týždni pre periférnu neuropatiu(25). Aj iní autori sa venovali použitiu THD pri liečbe IDB(26,27).
Súhrnne, vo všetkých citovaných štúdiách bola pozorovaná klinická odpoveď od 50-75 % pacientov s refraktérnymi IBD. Hoci v prípade Crohnovej choroby je známa spontánna variácia klinickej aktivity ochorenia, THD sa zdá by» efektívny a nádejný. Táto liečba bola vo všeobecnosti dobre tolerovaná, hoci čas» pacientov ju musela kvôli NÚ preruši». THD, podobne ako aj iná anti-TNF-α liečba, predstavuje nádej v liečbe Crohnovej choroby, najmä u rezistentných foriem(28,29). Kým však nebudú známe výsledky velkých kontrolovaných štúdií, stále bude THD viazaný predovšetkým na liečbu »ažkých, reftaktérnych foriem IBD s komplikáciami, ako napr. pyoderma gangrenosum alebo rozsiahlymi orálnymi ulceráciami(26).
Hepatocelulárny karcinóm
Hepatocelulárny karcinóm (HCC) je hypervaskulárny tumor, a preto antiangiogénna terapia je múdrou voµbou pre jeho liečbu a kontrolu. Liečba pacientov s HCC je pomerne komplikovaná, pretože častá pridružená hepatálna cirhóza limituje voµbu chemoterapeutík.
Patt et al. (2005) pozorovali ako odpoveď na THD v skupine 37 pacientov s HCC najčastejšie stabilizáciu ochorenia. Predpokladajú, že THD v inej dávke, resp. v kombinácii s inou chemoterapiou ale s iným THD-analógom by mohlo zabezpeči» dlhšie prežívanie chorých. THD podávaný vo vysokých dávkach v monoterapii vzhµadom na neurotoxicitu nemôže by» odporúčaný pre liečbu HCC(30). V inej štúdii zaznamenali výraznú klinickú odpoveď u pacienta s HCC v štádiu generalizácie, ktorému podávali THD v postupne zvyšujúcej sa dávke (prvá zmienka v odbornej literatúre o úspešnom použití THD pri HCC), pričom dávka nepriamo úmerne korelovala s poklesom sérovej hladiny a-fetoproteínu(31). Kombinácia trojdimenzionálnej rádioterapie s THD by mohla by» perspektívne účinnou liečbou pokročilých foriem HCC(32). Kombinovaná liečba s epirubicínom viedla u časti pacientov v stabilizácii ochorenia, avšak jednoznačný benefit tejto kombinácie v liečbe pokročilého HCC nebol dokázaný(33). Podobná situácia bola aj pri kombinácii s celecoxibom(34) alebo capecitabínom(35). Hsu et al. (2005) ukázali, že THD (200-300 mg/deň) indukoval objektívnu nádorovú odpoveď u malej časti pacientov s pokročilou HCC. U neresekovateµného HCC došlo u 10 % pacientov k parciálnej odpovedi a u 50 % k stabilizácii ochorenia. Lepšia odpoveď na THD bola u pacientov s vyšším USG indexom vaskularity(36). Ešte lepším indikátorom odpovede pokročilých foriem HCC na THD liečbu je však hladina α-fetoproteínu v sére(37).
Vo väčšine štúdii bola liečba obyčajne dobre tolerovaná, avšak pri THD v monoterapii bola pozorovaná len čiastočná klinická odpoveď u pacientov s neresekovateµným HCC v zmysle stabilizácie ochorenia v menšej časti súboru(34,35,38-43). Ani ďalšie štúdie nepotvrdili jednoznačný benefit THD v liečbe pokročilých foriem HCC(44-46), hoci pravdepodobne má svoj význam ako paliatívna liečba(47), a preto sú aj naďalej potrebné ďalšie štúdie s cieµom stanovi» účinnú liečbu pokročilého HCC. THD by mohol my» istý význam aj v liečbe skorých štádií HCC malej velkosti, najmä u pacientov s inými pridruženými ochoreniami(48).
Kolorektálny karcinóm
Pri kombinovanej liečbe metastázujúceho kolorektálneho karcinómu (CA) s irinotecanom, THD eliminoval gastrointestinálne toxické účinky irinotecanu, obzvláš» hnačku a nauzeu, pričom 8 z 9 pacientov boli schopní dokonči» chemoterapiu, 1 pacient dosiahol kompletnú a 2 čiastočnú remisiu. Keďže THD redukuje neskorý vznik hnačky asociovanej s liečbou irinotecanom, umožňuje pokračova» v začatej liečbe aj u pacientov, u ktorých by musela by» kvôli torpídnej hnačke a iným gastrointestinálnym NÚ prerušená. THD pomohol predís» deteriorácii nutričného statusu a zlepšil kvalitu života týchto pacientov. Mechanizmy, ktorými THD eliminuje gastrointestinálne toxické účinky irinotecanu, sú nejasné(49,50). V ďalšej štúdii porovnávali účinnos» THD v dvoch skupinách pacientov s pokročilou formou kolorektálneho CA, pričom obe skupiny dostávali irinotecan + fluorouracil + leukovorín. V jednej skupine k tejto liečbe pridali THD. Nepozorovali signifikantný rozdiel v klinickej odpovedi (28,1 % vs. 15,2 %, p = 0,2034), a preto autori uzatvárajú, že opísaná kombinovaná liečba bez THD je rovnako účinná ako s týmto liekom(51).
Neuroendokrinné metastázujúce tumory gastrointestinálneho traktu
Neuroendokrinné tumory GIT-u sú hypervaskularizované nádory, pri ktorých dodnes nepoznáme účinnú systémovú onkologickú liečbu. V nedávnej štúdií zahrnuli 18 pacientov s histologický verifikovaným metastázujúcim neuroendokrinným karcinómom. Dostávali THD v postupne sa zvyšujúcej dávke (z 200 mg/deň na 400 mg/deň po 2 týždňoch). Ani jeden z pacientov nedosiahol parciálnu alebo úplnú remisiu. Najlepšou odpoveďou bola stabilizácia ochorenia u 69 % pacientov. Liečba bola vcelku dobre tolerovaná (najčastejším NÚ bola obstipácia a únava), no nepreukázala žiadnu objektívne hodnotiteµnú klinickú odpoveď(52).
Angiodysplázia gastrointestinálneho traktu
THD sa javí by» účinný aj pri angiodysplázii GIT-u, pričom podávanie v dávke 100 mg/deň stabilizovalo klinický obraz a zabránilo recidíve krvácania do GIT-u. Monoterapia THD zlepšuje klinický obraz pri tomto ochorení, avšak z dlhodobej perspektívy asi bude nedostačujúca. Adjuvantná terapia ako napr. endoskopická koagulácia alebo nový derivát THD - lenalidomide môžu dopomôc» k stabilizácii stavu(53). Bauditz et al. (2004) skúmali vplyv THD na liečbu »ažkých foriem refraktérneho intestinálneho krvácania v nehomogénnej skupine pacientov (Crohnova choroba, idiopatická enterorágia). U všetkých 6 pacientov došlo k zastaveniu intestinálneho krvácania v priebehu 2 týždňov od začiatku liečby. Hodnoty hemoglobínu sa normalizovali bez transfúznej liečby počas celej doby sledovania pacientov (v priemere 33 mesiacov), čo bolo v kontraste s priemernou potrebou 2,2-3,1 transfúznych jednotiek na mesiac počas jedného roka pred zahájením liečby THD. THD môže by» užitočný v liečbe refraktérnych foriem krvácania do GIT-u(54).
Orálne ulcerácie, kachexia a proktitída pri HIV infekcii
THD je efektívny pri liečbe gastrointestinálnych príznakov u pacientov infikovaných HIV(55). V priebehu HIV infekcie sa môžu u týchto pacientov vyvinú» progresívne, rozsiahle, nekrotizujúce orálne ulcerácie (podobné tým pri Behcetovej chorobe), pričom môže by» postihnutý aj hypofarynx a pažerák. Často vedú k poruchám výživy a malnutrícii. THD bol efektívny pri liečbe bolestivých orálnych a orofaryngeálnych ulcerácií u 50 % HIV pozitívnych pacientov s refraktérnos»ou na inú liečbu pri dávkach 100-200 mg/deň v priebehu 2 týždňov, avšak pri prerušení terapie boli pozorované pomerne časté recidívy. THD je efektívny aj pri liečbe iných GIT lézií, proktitídy a kachexie u týchto pacientov(55-59). Niektorí autori však nabádajú k opatrnosti pri používaní imunomodulačných preparátov u imunokompromitovaných jedincov(56,59,60).
Gastrointestinálne postihnutie pri Behcetovej chorobe
Behcetová choroba je chronická relapsujúca vaskulitída charakterizovaná klinickou triádou: orálne a genitálne ulcerácie s uveitídou. V klinickom obraze možno pozorova» aj postihnutie kože, artritídu alebo neurologické príznaky. THD sa javí by» účinným v liečbe recidivujúcich »ažkých orálnych aftóznych ulcerácií rezistentných na inú podávanú liečbu.
Po prerušení tejto liečby však často pozorovali ich recidívu. Nízke dávky boli rovnako efektívne ako vysoké(61-63). V dávke 100-300 mg/deň výrazne zlepšuje rozsah a počet mukokutánnych ulcerácií, hoci plná remisia sa dosiahne len u asi 20 % pacientov(64). Menej častým príznakom tohto syndrómu býva »ažká kolitída. THD v dávke 400 mg/deň výrazne zlepšil kolitídu nereagujúcu na kolchicín. Hnačka a teplota ustúpili v priebehu 7 dní a pri kolonoskopickom vyšetrení o 4 týždne boli predchádzajúce rozsiahle ulcerácie črevnej sliznice prakticky vyliečené(65). U iného pacienta THD v dôsledku rapídneho zlepšenia klinického obrazu umožnil ustúpi» od kolektómie(66). THD predstavuje zároveň aj účinnú liečbu u pacientov postihnutých touto chorobou s rekurentnými perforujúcimi intestinálnymi ulceráciami napriek intenzívnej imunosupresívnej liečbe(67). THD v kombinácii napr. s kolchicínom by mohol ma» význam aj pri liečbe iných druhov rekurentných mukokutánnych aftóznych ulcerácií(68).
Alkoholické poškodenie pečene
Na potkaních modeloch bolo zistené, že THD bráni alkoholickému poškodeniu pečene prostredníctvom supresie tvorby TNF-α a potlačením senzibilizácie Kupfferových buniek na lipopolysacharidy, ktoré sú kritické pre progresiu hepatálnych lézií pri expozícii alkoholu(69).
Hepatálna cirhóza
V ďalšej štúdii na zvieracom modeli bol skúmaný vplyv THD na rozvoj hepatálnej cirhózy u potkanov. U zvierat, ktorým bol podávaný THD, autori pozorovali zníženie oxidačného stresu (prostredníctvom inhibičného pôsobenia THD na signálnu cestu NF-κB) a zlepšenie histologického nálezu v zmysle redukcie cirhózy. THD by mohol ma» efekt na zastavenie progresie hepatálnej cirhózy práve prostredníctvom viacerých signálnych dráh, na ktoré pôsobí(70).
Hepatotoxicita thalidomidu
Jedným z raritných NÚ THD liečby je aj »ažká hepatotoxicita. U pacientky liečenej kombináciou dexametazón + THD pre mnohopočetný myelóm pozorovali autori výrazný vzostup hepatálnych enzýmov v 6. týždni liečby. Histologický sa u tejto pacientky verifikovalo akútne poškodenie pečeňového parenchýmu v teréne pred tým nediagnostikovanej non-alkoholovej steatohepatitídy Po vysadení THD došlo k rýchlej normalizácii pečeňových funkcií. Vzhµadom na to, že sa tento liek začína používa» v liečbe mnohých ochorení, bude treba myslie» aj na tento NÚ, predovšetkým u pacientov s už preexistujúcim pečeňovým postihnutím(71). Aj v ďalšej kazuistike u 58 ročnej pacientky s anamnézou chronickej stabilizovanej hepatitídy C liečenej THD pre konečné štádium leukémie došlo počas prvého týždňa liečby k vzniku ikteru a výraznej elevácii transamináz, čo viedlo k vysadeniu THD(72). Mechanizmus pôsobenia THD na pečeň je nejasný. Je možné, že THD pôsobí ako priamy hepatotoxín, alebo ako imunomodulátor alterujúci aktivitu chronickej vírusovej hepatitídy.
ZÁVER
THD prináša nádej do liečby mnohých ochorení, predovšetkým onkologických a tých, ktoré vznikajú na podklade niektorých dysregulácií v imunitnom systéme. Pri správnej indikácii, citlivej titrácii znesiteµnej dávky a monitoringu nežiaducich účinkov, eventuálne v kombinácii s inými liekmi sa THD stáva alternatívou v liečbe tam, kde konvenčná terapia nezaznamenala žiadnu alebo len minimálnu odpoveď. Dodnes bolo schválené liečebné použitie THD pri mnohopočetnom myelóme a erythema nodosum leprosum. Perspektívne možno počíta» s jeho významom aj u viacerých ochorení gastrointestinálneho traktu a pečene. Treba však pripomenú», že použitie THD je v týchto indikáciách zatiaµ stále len experimentálne. Publikované výsledky vyžadujú ďalšie potvrdenie pomocou kontrolovaných klinických štúdií na veµkých súboroch pacientov.
LITERATÚRA
- 1. Kunz W, Keller H, Muckter H. N-phthalyl-gluta-minsaure-imid: experientalle untersuchungen an einem neuen synthetischen product mit sedativen eigenschaften. Arzneim Forsch 1956; 6: 426-430.
- 2. Sampaio EP, Sarno EN, Galilly R, et al. Thalidomide selectively inhibits tumor necrosis factor-a production by stimulated human monocytes. J Exp Med 1991; 173: 699-703.
- 3. Sheskin J. Thalidomide in the treatment of lepra reactions. Clin Pharmacol Ther 1965; 6: 303-306.
- 4. US Food and Drug Administration. FDA Approves Thalidomide for Hansen's Disease Side effect, Imposes Unprecedented Restrictions on Distribution. Rockwille, Md: National Press Office; July 16, 1998.
- 5. Powell R. New roles for thalidomide [editorials]. BMJ 1996; 313: 377-378.
- 6. Melchert M, List A. The thalidomide saga. Int J Bio-chem Cell Biol 2007; 39: 1489-1499.
- 7. Klausner JD, Freedman VH, Kaplan G. Thalidomide as an anti-TNF-a inhibitor: implications for clinical use. Clin Immunol Immunopathology 1996; 81: 219-223.
- 8. Singhal S, Mehta J. Thalidomide in cancer. Biomed Pharmacother 2002; 56: 4-12.
- 9. Hájek R, Maisnar V, Krejčí M. Thalidomid. Klin Farmakol Farm 2005; 19: 43-46.
- 10. Moreira AL, Corral LG, Ye W, et al. Thalidomide and thalidomide analogs reduce HIV type 1 replication in human macrophages in vitro. AIDS Res Hum Retroviruses 1997; 13: 857-863.
- 11. Shanbhag PS, Viswanath V, Torsekar RG. Thalidomide: Current status. Indian J Dermatol Venerol Lep-rol 2006; 72: 75-80.
- 12. Radomsky CL, Levine N. Thalidomide. Dermatol Clin 2001; 19: 87-103.
- 13. Tseng S, Pak G, Washenik K, et al. Rediscovering thalidomide: a review of its mechanism of action, side effects, and potential uses. J Am Acad Dermatol 1996; 35: 969-979.
- 14. Valorie AM. Thalidomide: A new beginning. Cancer Pract2000;8: 101-103.
- 15. Von Moos R, Stolz R, Cerny T, et al. Thalidomide: from tragedy to promise. Swiss Med Wkly 2003; 133: 77-87.
- 16. Sands BE, Podolsky DK. New life in a sleeper: thalidomide and Crohn's disease. Gastroenterol 1999; 117: 1485-1498.
- 17. Franks ME, MacPherson GR, Figg WD. Thalidomide. Lancet 2004; 363: 1802-1811.
- 18. Bauditz J, Wedel S, Lochs H. Thalidomide reduces tumour necrosis factor alpha and interleukin 12 production in patients with chronic active Crohn's disease. Gut 2002; 50: 196-200.
- 19. Ehrenpreis ED, Kane SV, Cohen LB, et al. Thalidomide therapy for patients with refractory Crohn's disease: an open- label trial [abstract]. Gastroenterol 1999; 117: 1271-1277.
- 20. Vasiliauskas EA, Kam LY, Abreu-Martin M et al. An open-label pilot study of low-dose thalidomide in chronically active, steroid-dependent Crohn's disease (abstract). Gastroenterol 1999; 117:1278-1287.
- 21. Bariol C, Meagher AP, Vickers CR, et al. Early studies on the safety and efficacy of thalidomide for symptomatic inflammatory bowel disease. J Gastroenterol Hepatol 2002; 17: 135-139.
- 22. Hegarty A, Hodgson T, Porter S. Thalidomide for the treatment of recalcitrant oral Crohn's disease and orofacial granulomatosis (abstract). Oral Surg Oral Med Oral Pathol Oral Rhadiol Endo 2003; 95: 576-585.
- 23. Lazzerini M, Martelossi S, Marchetti F, et al. Efficacy and safety of thalidomide in children and young adults with intractable inflammatory bowel disease: long-term results. Aliment Pharmacol Ther 2007; 25: 419-427.
- 24. Plamondon S, Ng SC, Kamm MA. Thalidomide in luminal and fistulizing Crohn's disease resistant to standard therapies. Aliment Pharmacol Ther 2007; 25: 557-567.
- 25. Facchini S, Candusso M, Martelossi S, et al. Efficacy of long-term treatment with thalidomide in children and young adults with Crohn's disease: preliminary results. J Ped Gastroenterol Nutr 2001; 32: 178-181.
- 26. Van Deventer SJH. Small therapeutic molecules for the treatment of inflammatory bowel disease. Gut 2002; 50: iii47-iii53.
- 27. Fishman SJ, Feins NR, DAmato RJ et al. Thalidomide therapy for Crohn's disease (correspondence). Gastroenterol 2000; 119: 596.
- 28. Osterman MT, Lichtenstein GR.
- 29. Wettstein AR, Meagher AP. Thalidomide in Crohn 's disease. Lancet 1997; 350: 1445-1446.
- 30. Patt YZ, Hassan MM, Lozano RD, et al. Thalidomide in the treatment of patients with hepatocellular carcinoma. A phase II trial. Cancer 2005; 103: 749-755.
- 31. Patt YZ, Hassan MM, Lorano RD, et al. Durable clinical response of refractory hepatocellular carcinoma to orally administered thalidomide. Am J Clin Oncol 2000;23:319-321.
- 32. Hsu WC, Chan SC, Ting LL, et al. Results of three-dimensional conform al radiotherapy and thalidomide for advanced hepatocellular carcinoma. Jpn J Clin Incol 2006; 36: 93-99.
- 33. Zhu AX, Fuchs CS, Clark JW, et al. A phase II study of epirubicin and thalidomide in unresectable or metastatic hepatocellular carcinoma. Oncologist 2005; 10: 392-398.
- 34. Chen CS, Hillebrand D, Hill K, et al. A pilot study of celecoxib combined with escalating doses of thalidomide for treatment of unresectable hepatocellular carcinoma (HCC) (abstract). Proc Am Soc Clin Oncol 2002; 21: 134b.
- 35. Chun HG, Waheed FA, Iqbal A. A combination of capecitabine and thalidomide in patients with unresectable, recurrent or metastatic hepatocellular carcinoma (abstract). Proc Am Soc Clin Oncol 2003; 22: 350.
- 36. Hsu C, Chen CN, Chen LT, et al. Effect of thalidomide in hepatocellular carcinoma: assessment with Power Doppler US and Analysis of circulating angio-genic factors. Radiology 2005; 235: 509-516.
- 37. Chen LT, Liu TW, Chao Y, et al. Alpha-fetoprotein response predicts survival benefits of thalidomide in advanced hepatocellular carcinoma. Aliment Pharmacol Ther 2005; 22: 217-226.
- 38. Feun LG, Marini A, Molina E, et al. Thalidomide as palliative care for patients with unresectable hepatocellular carcinoma (abstract). Proc Am Soc Clin Oncol 2003; 122: 216.
- 39. Han SH, Park SH, Kim JH, et al. Thalidomide for treating metastatic hepatocellular carcinoma: a pilot study. Korean J Intern Med 2006; 21: 225-229.
- 40. Hsu C, Chen CN, Chen LT, et al. Low- dose thalidomide treatment for advanced hepatocellular carcinoma. Oncology 2003; 65: 242-249.
- 41. Chuah B, Lim R, Boyer M, et al. Multi-centre phase II trial of thalidomide in the treatment of unresectable hepatocellular carcinoma. Acta Oncol 2007; 46: 234-238.
- 42. Lin AY, Brophy N, Fisher GA, et al. Phase II study of thalidomide in patients with unresectable hepatocellular carcinoma. Cancer 2005; 103: 119-125.
- 43. Wang TE, Kao CR, Lin SC, et al. Salvage therapy for hepatocellular carcinoma with thalidomide. World J Gastroenterol 2004; 10: 649-653.
- 44. Schwartz JD, Sung M, Lehrer D, et al. Thalidomide in advanced hepatocellular carcinoma with optional low- dose interferon- a2a upon progression. Oncologist 2005; 10: 718-727.
- 45. Kong HL, Boyer MJ, Lim R, et al. Phase II trial of thalidomide in unresectable hepatocellular carcinoma (HCC): a Cancer Therapeutics Research Group (CTRG) study [abstract]. Proc Am Soc Clin Oncol 2001; 20: 133b.
- 46. Cappa FM, Cantarini MC, Magini G, et al. Effects of the combined treatment with thalidomide, megestrol and interleukin-2 in cirrhotic patients with advanced hepatocellular carcinoma. Dig Liver Dis 2005; 37: 254-259.
- 47. Chang JY, Ka WS, Chao TY, et al. Hepatocellular carcinoma with intra-atrial tumor thrombi. A report of three cases responsive to thalidomide treatment and literature review. Oncology 2004; 67: 320-326.
- 48. Chiou HE, Wang TE, Wang YY, et al. Efficacy and safety of thalidomide in patients with hepatocellular carcinoma. World J Gastroenterol 2006; 12: 6955-6960.
- 49. Govindarajan R, Heaton KM, Broadwater R et al. Effect of thalidomide on gastrointestinal toxic effect of irinotecan. Lancet 2000; 356: 566-567.
- 50. Govindarajan R. Irinotecan and thalidomide in metastatic colorectal cancer. Oncology (Hunting) 2000; 4:29-32.
- 51. Zhang HG, Li J, Qin SK, et al. A randomized trial of irinotecan plus fluorouracil and leukovorin with thalidomide versus without thalidomide in the treatment for advanced colorectal cancer. Zhonghue Thong Liu ZaZhi 2007; 29: 228-231.
- 52. Varker KA, Campbell J, Shah MH. Phase II study of thalidomide in patients with metastatic carcinoid and islet cell tumours. Cancer Chemother Pharmacol 2007 (in press, personal communication).
- 53. Heidt J, Langers AMJ, van der Meer FJM, et al. Thalidomide as treatment for digestive tract angiodyspla-sias. Neth J Med 2006; 64: 425-428.
- 54. Bauditz J, Schachschal G, Wedel S, et al. Thalidomide for treatment of severe intestinal bleeding. Gut 2004; 53: 609-612.
- 55. Paterson DL, Georghiou PR, Allworth AM, et al. Thalidomide as treatment of refractory aphthous ulceration related to human immunodeficiency virus infection. Clin Infect Dis 1995; 20: 250-254.
- 56. Jacobson JM, Greenspan JS, Spritzler J, et al. Thalidomide for the treatment of oral aphthous ulcers in patients with human immunodeficiency virus infection. N Eng J Med 1997; 336: 1487-1493.
- 57. Jacobson JM, Spritzler J, Fox L, et al. Thalidomide for the treatment of esophageal aphthous ulcers in patients with human immunodeficiency virus infection. National Institute for Allergy and Infectious Disease AIDS Clinical Trails Group. J Infect Dis 1999; 180: 61-67.
- 58. Ramirez-Amador VA, Esquivel-Pedraza L, Ponce--de-Leon S, et al. Thalidomide as therapy for human immunodeficiency virus-related oral ulcers: a double-blind placebo-controlled clinical trial. Clin Infect Dis 1999; 28: 892- 894.
- 59. Sharpstone D, Rowbottom A, Nelson M, et al. The treatment of microsporidial diarrhoea with thalidomide. AIDS 1995; 9: 658.
- 60. Wohl DA, Aweeka FT, Schmitz J, et al. Safety, tolerability, and pharmacokinetic effects of thalidomide in patients infected with human immunodeficiency virus: AIDS Clinical Trials Group 267. J Infect Dis 2002; 185: 1359-1363.
- 61. Hamuryudan V, Mat C, Saip S, et al. Thalidomide in the treatment of mucocutaneous lesions of the Behcet syndrome: a randomized, double-blind, placebo controlled trial. Ann Intern Med 1998; 128: 443-450.
- 62. Kari JA, Shah V, Dillon MJ. Behcet's disease in UK children: clinical features and treatment including thalidomide. Rheumatol 2001; 40: 933-938.
- 63. Shek LPC, Lee YS, Lee BW, et al. Thalidomide responsiveness in an infant with Behcet's syndrome. Pediatrics 1999; 103: 1295-1297.
- 64. Bousvaros A, Mueller B. Thalidomide in gastrointestinal disorders. Drugs 2001; 61: 777-787.
- 65. Postenia PT, den- Haan P, van- Hagen PM, et al. Treatment of colitis in Behcet's disease with thalidomide. Eur J Gastroenterol Hepatol 1996; 8: 929-931.
- 66. Larsson H. Treatment of severe colitis in Behcet's syndrome with thalidomide (CG-217). J Inter Med 1990; 228: 405-407.
- 67. Sayarlioglu M, Kotan MC, Topcu N, et al. Treatment of recurrent perforating intestinal ulcers with thalidomide in Behcet's disease. Ann Pharmacother 2004; 38:808-811.
- 68. Genvo MF, Faure M, Thivolet J. Treatment of aphthosis with thalidomide and with colchicine. Dermatologica 1984; 168: 182-188.
- 69. Enomoto N, Takei Y, Hirose M, et al. Thalidomide prevents alcoholic liver injury in rats through suppression of Kupffer cell sensitization and TNF-α production (abstract). Gastroenterology 2002; 123: 291-300.
- 70. Lv P, Lou HS, Zhou XP, et al. Thalidomide prevents rat liver cirrhosis via inhibition of oxidative stress. Pathol Res Pract 2006; 202: 777-788.
- 71. Hanje AJ, Shamp JL, Thomas FB, et al. Thalidomide-induced severe hepatotoxicity Pharmacotherapy 2006; 26: 1018-1022.
- 72. Fowler R, Imrie K. Thalidomide-associated hepatitis: a case report. Am J Hematol 2001; 66: 300-302.
To read this article in full, please register for free on this website.
Benefits for subscribers
Benefits for logged users